10份桑种质资源亲缘关系鉴定
任迎虹,祁伟亮,陈 洁
(成都师范学院 化学与生命科学学院,四川 成都 611130)
桑树(Mulberry)属于重要的经济植物[1],叶片互生、叶缘有锯齿、花雌雄同株或异株。桑科共约53属,1400余种,我国是目前世界上桑树资源分布最多的国家。最初的植物学分类依据主要是形态学,如瑞典植物分类学家林奈将桑属植物分为7个种[2]。1842年Moretti将桑属分为10个种[3]。1873年法国植物分类学家Bureau根据桑叶和雌花特征进一步划分为19个变种以及12个亚变种[4]。后期夏明炯在1991年发表的《桑树分类概述》一文中指出我国桑树分为15个桑种和4个变种,是世界上桑种分布最多的国家[5]。桑树作为家蚕的饲料经过了上千年的栽培和杂交,在形态上发生了很多变异,形成了许多种和变种,因此单纯依靠形态学依据的分类显然可信性不高。
随着生物技术的不断发展,分类学家开始在分子水平上寻找分类依据。在被子植物基因组中,ITS(Internal trnscribed spacer)基因序列具有长度变异小、非常保守等特性,适合用于低分类群的系统发育分析。史全良和赵卫国[6]以蒙桑(M.mongolica)为材料采用PCR产物直接测序法,测定了核糖体基因转录内间隔区序列,指出ITS序列在桑树分子系统学研究的潜在重要性。2012年,Nepal和Ferguson[7]采用ITS和trnL-trnF将全球的桑属分为13个种,并强调桑属可能不是单源进化,分为北美和亚洲两个亚属。
本研究旨在对10份收集的桑树资源进行ITS序列分析,结合形态学调查和相关指标,从分子学和形态学角度阐明10个野外收集的桑树资源和已知桑属的亲缘关系,这对于桑种质的指纹鉴别、亲缘关系分析、育种亲本选择以及桑的分子育种等技术问题均具有重要意义。
1 材料与方法
1.1 材料
本试验材料主要收集于凉山州各主要蚕种场。由于地方蚕桑种植户对于引进的品种或者部分栽培品种信息不能准确描述,故将收集的10份桑种质资源以嫁接苗的形式,繁种于成都师范学院桑树资源圃,以编号形式暂命名为1,R-2016JLJ-1;2,R-2016HYB1-2;3,R-2016XYJL-2;4,湖桑32(已知品种);5,R-2016HYB2-2;6,R-2016KJ-1;7,R-2016LH-2;8,R-2016BL-2;9,R-2016SM-3;10,R-2016CS2-2。
1.2 DNA提取及PCR产物扩增
每个样品取2~3片嫩叶,采用CTAB法[8]提取桑树基因组DNA。PCR扩增20 uL反应体系中,包含Tag mix(10 uL)、ddH2O(7 uL)、DNA(1 uL)、引物ITS-F(ITS 5)(5'- GGAAGTAA AAGTCGTA ACAAGG-3')1 uL、引物ITS-R(ITS 4)(5'-TCCTC CGCTTATTG ATATGC-3')1 uL(购自上海生工生物工程有限公司)。
扩增程序:94℃预变性5 min,94℃变性30 s,55℃退火30 s,72℃延伸1 min,共38个循环,再72℃保温延伸10 min,12℃条件下保存。PCR反应产物经1%琼脂糖电泳,电压为120 V(稳压),电泳约10 min,溴化乙锭(Ethidium bromide,EB)染色5 min,在凝胶成像系统拍照记录[9]。
1.3 序列数据处理
测序结果用SeqMan5.01软件转换,对少数误判碱基,根据碱基峰形更正。用MEGA7.0.14软件进行裁剪比对,除去两端非ITS序列部分。根据GenBank Blast检索得到亲缘关系相近的白桑(M.alba,XNS0052)、鲁桑(M.multicaulis,AM042003)、鸡桑(M.australis,XNSK0024)和山桑(M.bombycis,XNS0277)4份桑属ITS序列,与本试验的10份ITS序列一起,利用MEGA7.0.14软件进行序列长度、G + C含量对比分析,单独分析变异位点和计算遗传距离。根据GenBank上检索到的暹罗桑(M.rotundiloba,AY345150)、蒙桑(M.mongolica,AY345158)、贵14号长穗桑(M.wittiorum,AY345155)、北美默里桑(M.murrayana,FJ605515)、新疆黑桑(M.nigra,XNS0218)5份桑属ITS序列和Blast得到的4份ITS序列与本试验桑种质材料ITS序列一起,构树(Broussonetiapapyrifera,XNS0377)、冠毛榕(Ficusgasparriniana,JQ773883)和柘树(Macluratricuspidata,XNS0007)作为外类群(Outgroup),通过MEGA7.0.14软件采用最大简约法(Maximum)分析,构建系统发育树。
1.4 形态特征调查
本次共调查10份桑树资源的农艺形状,参照《桑树种质资源描述规范和数据标准》[10],包括描述性状,如叶形、侧枝、叶色、叶尖、叶缘等,以及数量性状,如叶宽、叶长、叶柄长、叶柄宽等,每个植株随机抽样9根枝条并利用数据处理软件Excel进行数据统计。最后结合ITS数据分析结果,并参考中国高等植物图鉴[11]、中国桑树品种志[12]、中国数字植物标本馆(中国植物智 http://www.iplant.cn/)进行资源鉴定。
2 结果与分析
2.1 ITS序列长度及碱基比例
对10份材料进行凝胶电泳,图像大致在700 bp左右(图1),根据来自Genbank的鲁桑种(AM042003)的18S rRNA基因3′端、26S rRNA基因5′端、5.8S rDNA基因碱基序列,确定本试验各材料的ITS1、5.8S、ITS2序列范围[13-15]。
图1 引物ITS4/ITS5对10份桑树种质材料ITS 基因组DNA的PCR扩增产物电泳谱图Fig. 1 ITS4/ITS5 10 parts of mulberry germplasm material ITS Genomic DNA PCR products electrophoresis spectrum
软件分析显示,桑树ITS序列(包含5.8S rDNA)全长为576~578 bp,G+C含量为59.17%~59.97%(见表1),其中5.8S rDNA编码区极为保守,在所有测得以及对照的序列中,长度均为100 bp,且G+C含量都为48.00%;而ITS1和ITS2序列表现出差异性,长度分别为174~175 bp和302~303 bp,G+C含量分别为60.00%~62.07%和62.38%~62.71%。其中R-2016SM-3的ITS1、ITS2的长度分别为174 bp、303 bp,G+C的含量分别为62.07%、62.71%,与鸡桑一致,推测R-2016SM-3可能属于鸡桑(M.australis)。此外,R-2016HYB2-2、R-2016LH-2、R-2016BL-2和R-2016CS2-2都存在不同程度的变异。剩下的R-2016JLJ-1、R-2016HYB1-2、R-2016XYJL-2、湖桑32以及R-2016KJ-1的ITS序列长度及G+C含量与白桑相同,推测他们可能属于白桑(M.alba)。
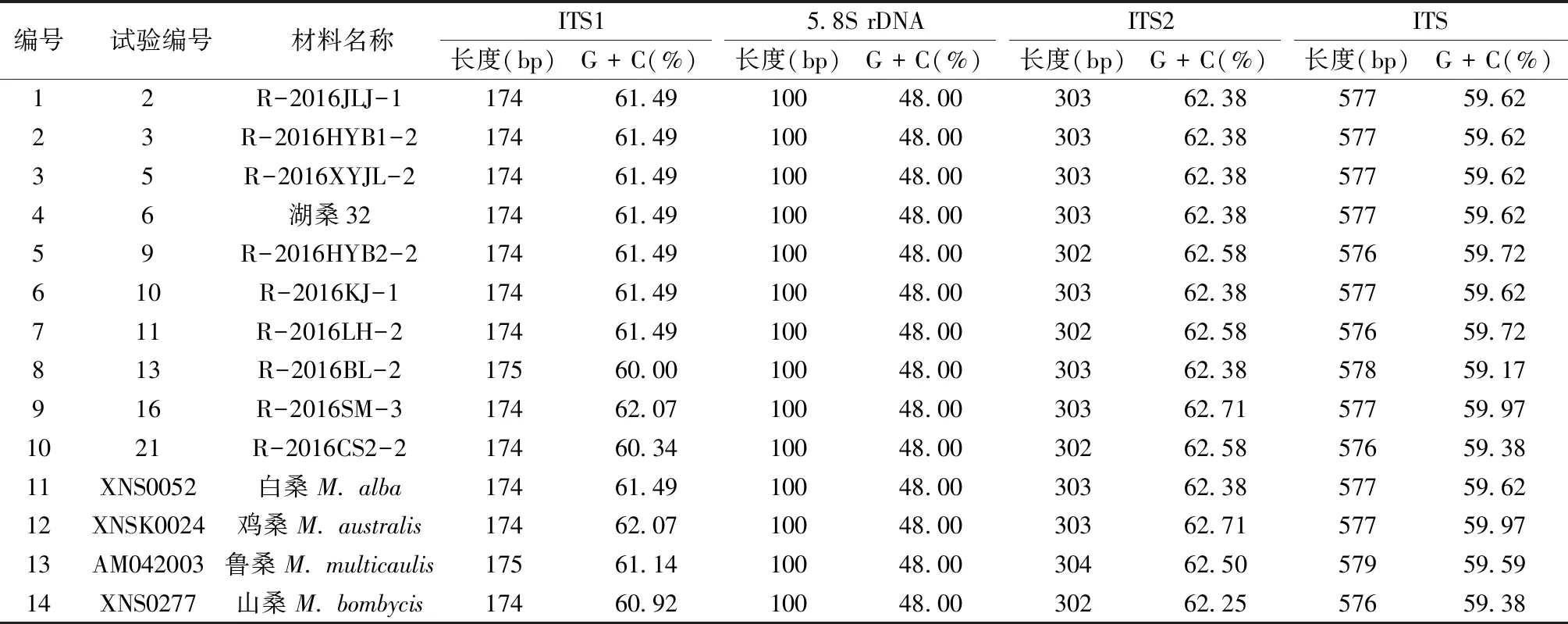
表1 桑属种质资源ITS序列长度、G + C含量变异Table 1 The length of ITS sequences and contents of G + C in Morus
2.2 ITS序列遗传距离及变异位点分析
利用MEGA7.0.14软件采用Kimura 2-parameter model方法分析了10份桑种质材料的ITS序列的遗传距离(Genetic distance)(表2)。10份桑种质材料的遗传距离为0.000~0.102。R-2016JLJ-1、R-2016XYJL-2、湖桑32、R-2016HYB2-2、R-2016KJ-1和R-2016LH-2的遗传距离最近(0.000),表明其亲缘关系最近;R-2016HYB1-2与R-2016BL-2的遗传距离最远(0.102),表明其亲缘关系最远。
通过ITS序列碱基—长度、G+C的含量变化及遗传距离分析,排除相似性高的材料,本研究单独对R-2016HYB1-2、R-2016HYB2-2、R-2016LH-2、R-2016BL-2、R-2016SM-3以及R-2016CS2-2进行ITS序列变异位点(Variable sites)对比分析(表3)。采用王洁等[16]的方法,可以发现这6个材料共有60个变异位点,变异位点集中在ITS1与ITS2区,其中ITS1区最多,R-2016BL-2在ITS1区域变异位点最多(50个),变异类型有A-C、A-G、A-T、T-G、C-T、G-C等。ITS1区有52个变异位点,其中简约信息位点(Parsimony informative site)占21个,分别占ITS1序列平均长度(175 bp)的29.71%和12.00%。ITS2区有8个变异位点,其中简约信息位点占1个,分别占ITS2序列平均长度(303 bp)的2.31%和0.33%,表明ITS1序列所包含的信息含量明显高于ITS2序列。

表2 15份桑属ITS序列遗传距离及相似性Table 2 Genetic distances and percent identities of 15 mulberry germplasm materials based on ITS
2.3 ITS序列亲缘关系分析
加上GenBank上的白桑(M.alba,XNS0052)等9份外源桑属材料,用构树(B.papyrifera,XNS0377)等3份材料作为外类群,最大简约(MP)法聚类分析结果显示,分支图显示树长为378,一致性指数(Consistency index,CI)为0.8862,趋同性指数(Homoplasy index,HI)= 0.1138,保持性指数(Retention index,RI)为0.7529,调整后一致性指数(Rescaled consistency index,RC)为0.6672。对比序列共计580个位点(含Gap),其中有517个不变位点,38个变异非信息位点,22个简约信息位点。

表3 ITS基因序列比较Table 3 Comparison of ITS gene sequences

续表3 ITS基因序列比较Table 3 Comparison of ITS gene sequences
从聚类结果来看,系统发育树首先将柘树、冠毛榕分出,自举检验(Bootstrap)支持率为99%。可以明显看出,在桑科植物的构属、柘属和榕属中,构属和桑属亲缘关系最近。R-2016SM-3与鸡桑单独聚在一起,其自举检验支持率为77%,推测R-2016SM-3属于鸡桑(M.australis)。R-2016BL-2和R-2016CS2-2聚在一起,与蒙桑的自检支持率为96%,推测R-2016BL-2和R-2016CS2-2属于蒙桑(M.mongolica),为蒙桑的一个变种。R-2016HYB1-2与暹罗桑单独聚为一小支,自检支持率为86%,推测R-2016HYB1-2属于暹罗桑(M.rotundiloba)。剩下的R-2016HYB2-2、R-2016KJ-1、R-2016JLJ-1、湖桑32、R-2016LH-2和R-2016XYJL-2与白桑和鲁桑聚在一起,由于鲁桑也是白桑的一个变种,表明它们属于白桑(M.alba)(图2)。
3 结论
中国是桑属植物集中分布和分化中心,又是桑属植物的遗传多样性中心,许多桑种起源于我国,如蒙桑(M.mongolica),鸡桑(M.australis),滇桑(M.yunnanensts),白桑(M.alba),山桑(M.bombycis)等。桑属由林奈[2]建立之后,先后有许多学者在分子学方面对桑属的系统分类进行了研究[17-20]。陈仁芳[21]采用MP法对桑ITS序列进行聚类分析,结果表明桑树进化的顺序依次为:新疆黑桑、北美默里桑→白桑、暹罗桑(AM042005)、瑞穗桑、广东桑、鸡桑、鲁桑(AM041999)、蒙桑、山桑→华桑、奶桑、川桑→利川长穗桑、咸丰长穗桑;73份桑资源只有33份材料有不同程度的变异,同源性高达93.1%~100%。本研究ITS进化分析结果,首先将桑树近缘属植物柘树、冠毛榕和构树分开,同时将黑桑、北美默里桑独立出一支,这一结果与陈仁芳研究结果吻合,表明试验分析结果可靠。吴征镒等[22]研究报道,白桑(M.alba)在早期系统演化上是最大的一个干支,也是现存数量最多一类桑种,其中鲁桑(M.multicaulis)属于白桑的变种[23]。本研究中R-2016HYB2-2、R-2016KJ-1、R-2016 JLJ-1、湖桑32、R-2016LH-2和R-2016XYJL-2与白桑和鲁桑聚在一起,10份桑树资源多以白桑为主,这也证明了吴征镒的观点,同时鉴定出1份鸡桑、2份蒙桑和1份暹罗桑。
为了更准确的评价系统归类结果的可靠性,本研究参考《中国植物志》等资源对收集的10个桑树资源进行了形态特征及相关数量结果统计(表4),结果表明10个桑树资源的形态特征存在差异性和相似性。R-2016BL-2和R-2016CS2-2与蒙桑(M.mongolica)亲缘关系较近,且R-2016BL-2(图3g)和R-2016CS2-2(图3h)的叶形为裂叶形、表面光滑,叶长分别为9.20 cm、12.90 cm,叶宽分别为8.80 cm、10.20 cm,叶柄长分别为2.43 cm、2.63 cm,尖端尾尖,叶缘单锯齿形,形态学特征[11,24]与裂叶蒙桑的相似度高(图3m),该结果表明R-2016BL-2和R-2016CS2-2属于蒙桑(M.mongolica)。R-2016SM-3(图3j)与鸡桑(图3l)单独聚在一起,且叶形态特征符合鸡桑(M.australis)的生物学特征描述[25],因此鉴定R-2016SM-3为鸡桑。据《中国桑树品种志》介绍,四川在1982年桑树品种谱查中还发现蜀雅桑、雅中里、插桑、雅周桑、蜀名桑等扦插易生根的鸡桑[12],这也证实四川地区的确存在鸡桑。

图2 22份桑种质材料基于ITS的系统进化树Fig. 2 A phylogenetic tree of 22 mulberry germplasm materials based on ITS
白桑不仅分布广泛、且遗传背景变异多,这也形成很多变种,如鲁桑(M.multicaulis-俗名女桑、湖桑、白桑)、泰国的暹罗桑(M.rotunbiloba)等[21,26]。R-2016HYB2-2(图3a)、R-2016KJ-1(图3b)、R-2016JLJ-1(图3c)、湖桑32(图3d)、R-2016LH-2(图3e)和R-2016XYJL-2(图3f)的叶长在9.60~14.55 cm,叶宽在6.50~10.00 cm,叶柄长在2.43~4.77 cm,叶均为卵形、表面光滑、鲜绿色,叶形态特征符合鲁桑的生物学特征描述(图3k)。因此,鉴定R-2016HYB2-2、R-2016KJ-1、R-2016JLJ-1、湖桑32、R-2016LH-2和R-2016XYJL-2属于白桑类。R-2016HYB1-2与暹罗桑单独聚为一小支,该品种应该属于国外引进品种。
4 讨论
很多科研工作者对桑属的分类和系统进化工作做了大量的研究。1995年,向仲怀首次采用RAPD技术构建了9个桑品种的DNA指纹图谱[17]。随后,许多子标记技术如ISSR、SSR和ITS等相继应用到桑树系统学分类研究工作中[27]。如Vijayan等[28]利用形态解剖和ISSR 分子标记技术鉴定了17种野生桑树资源的遗传多样性。2006年,印度人完成了首个桑树品种的叶绿体全基因组测序[29],同年,Venkateswarlu等[30]利用ISSR、RAPD和SSR 三种分子标记绘制了印度桑K2的遗传图谱,该研究为桑树近缘种属分类提供了重要的参考。2012年,Nepal首次采用ITS和trnL-trnF将全球的桑属分为13个种,研究发现桑可能不是单源进化,分为北美和亚洲两个亚属[7]。曾其伟等[31]利用ITS序列对桑属做了较为系统的分析,提出白桑是最大的一种且种质资源多,但因白桑资源形态多样,将他们归为一个大种存在争议[32]。在本研究中,也发现超过一半的桑品种属于白桑。因此,下一步将采用ITS与trnL-trnF进行多片段联合分析,同时综合细胞学研究、解剖学等[33],进行桑树品种的亲缘关系分析,并为桑树的资源选择和杂交育种提供依据。

图3 10份种质资源的形态图和标本图Fig. 3 Morphological maps and specimen figures of 10 mulberry 注:a,R-2016HYB2-2;b,R-2016KJ-1;c,R-2016JLJ-1;d,湖桑32;e,R-2016LH-2;f,R-2016XYJL-2;g,R-2016BL-2;h,R-2016CS2-2;i,R-2016HYB1-2;j,R-2016SM-3;k,鲁桑标本,中国植物智条码SZG0Q005128;l,鸡桑标本,中国植物智条码CSH0090591;m,蒙桑标本,中国植物智条码QFNU0018312
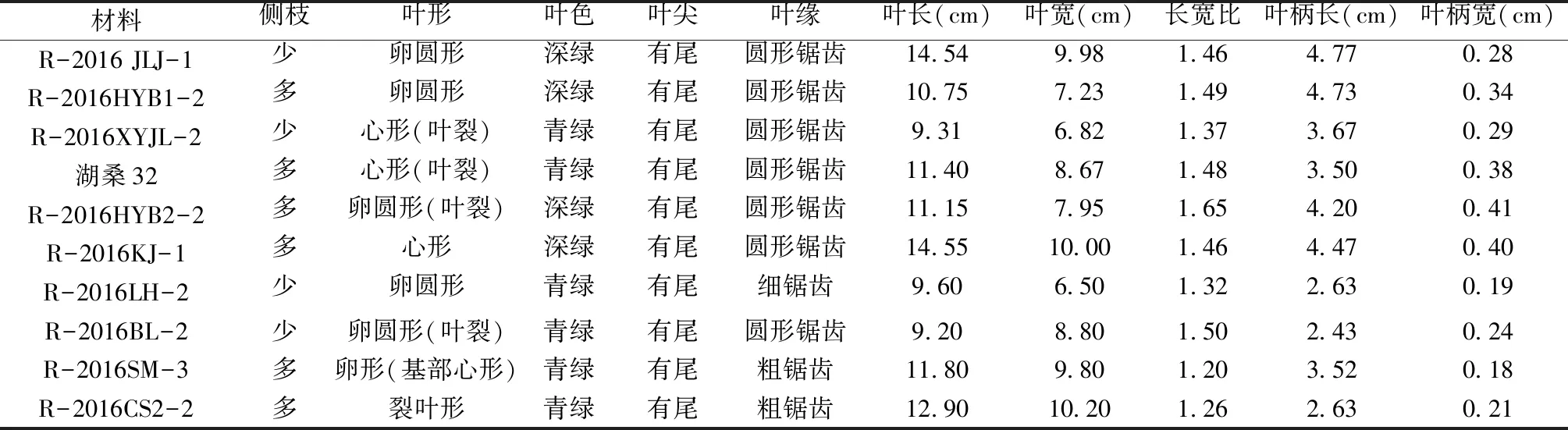
表4 10份桑树种质资源形态数据调查Table 4 Survey of morphological data of 10 mulberry germplasm resources

