环丙沙星在亚高山草甸土和沼泽土中的吸附特性
黄 燕, 白英臣, 王 彬*, 刘 畅, 刘 伟, 梁馨予, 王启铭, 谌 书
1.西南科技大学环境与资源学院, 四川 绵阳 621010 2.中国环境科学研究院, 环境基准与风险评估国家重点实验室, 北京 100012 3.西南科技大学, 固体废物处理与资源化教育部重点实验室, 四川 绵阳 621010
抗菌类药物因其能防治人类及动物由病菌引起的疾病,成为世界上使用最广泛和滥用最严重的药物之一[1]. 每年约70%的抗菌药物用于防治牲畜疾病和加快其生长发育,然而抗菌药物一般不能被牲畜全部吸收,约80%的原药通过尿液和粪便代谢出体外,并通过人类活动进入土壤环境中[2-4]. 邰义萍等[5]在东莞农田土壤中检测出多种抗生素,其中以喹诺酮类抗生素污染最为严重,浓度高达mgkg级. 抗菌药物进入土壤后将对土壤生态系统造成负面影响,从而威胁到人类的健康[6]. 因此,土壤中抗菌药物含量的检测以及其风险评估是当前研究焦点之一.
环丙沙星(Ciprofloxacin, CIP)又名环丙氟哌酸或适普灵,具有抗菌谱广、半衰期长、药物快速发展的特点,是一种广泛应用的第三代喹诺酮类广谱抗生菌药物[7-8]. 而吸附作为CIP进入土壤环境的第一步,对其后的迁移、降解行为有重要的影响[9]. 目前,国内外已经逐步开展了抗菌药物在土壤中吸附机制的探索. 研究发现,CIP在潮土中的吸附过程可分为快速吸附和慢速平衡2个阶段[10],且Freundlich等温吸附模型能够较好地拟合其吸附等温过程. 蒋煜峰等[8]在黄土对CIP的吸附行为研究中发现,其吸附过程是混乱度减少、自发进行的放热反应,主要吸附机制为CIP分子中氨基的阳离子交换作用. 现有研究多为阐明某一初始浓度下CIP在土壤中的吸附机制和影响因素,而忽视了初始浓度也是影响CIP在土壤吸附过程中的重要因素[11];同时,也有研究[12]表明,土壤理化性质与组成的不同将会导致CIP的吸附行为存在较大差异. 川西北高原牧区土壤类型丰富,且牧区养殖规模大,兽药用量高,亚高山草甸土和沼泽土是该地区广泛分布的典型土壤类型,有机质含量差异较大. 然而关于亚高山草甸土和沼泽土对CIP的吸附特性研究较少,尤其是探究两种土壤对CIP吸附特性的差异更是鲜有报道,因而研究CIP在两种土壤上的吸附迁移行为具有重要的意义.
因此,该研究选取CIP为喹诺酮类代表性药物,在实验室条件下以OECD Guideline 106批平衡方法[13]为基础,研究其在亚高山草甸土和沼泽土中的吸附动力学、等温吸附特性和吸附热力学特性,同时探讨了pH以及初始质浓度对CIP吸附行为的影响,初步明确了两种土壤在不同CIP初始浓度下的吸附机制和两种土壤类型对CIP吸附的差异性,以期为控制CIP在两种土壤中的环境风险提供理论依据.
1 材料与方法
1.1 材料和仪器
供试土壤选取若尔盖草地的亚高山草甸土和沼泽土,采样地点位于自四川省阿坝州红原县阿木乡和瓦切镇. 两种土壤样品均为0~20 cm的混合土样,去除土样中的杂草、石子等杂物,避光自然风干,过100目(0.15 mm)筛后避光储存备用. 供试土壤基本理化性质见表1.
主要试剂:环丙沙星(GR,西格玛奥德里奇贸易有限公司);乙腈(色谱纯,德国默克医药公司);三乙胺(色谱纯,西格玛奥德里奇贸易有限公司);叠氮化钠(AR,成都市科隆化学品有限公司);其他化学试剂均为分析纯;试验用水为超纯水(美国Millipore公司).
主要仪器:Agilent1260型高效液相色谱仪(美国Agilent公司);TDL-40B型低速台式离心机(上海安亭科学仪器厂);TSQ-280型水浴恒温振荡器(上海精宏试验设备有限公司);PHS-3C型pH计(上海梅特勒-托利多);KH5200型超声波清洗器(昆山禾创超声仪器有限公司).
1.2 试验方法
1.2.1CIP溶液配制
标准储备液:准确称取一定量的CIP固体粉末,用背景溶液配置浓度为200 mgL的标准储备溶液.
1.2.2吸附动力学试验
试验参照OECD guideline106批平衡方法[13]进行. 将沼泽土、亚高山草甸土分别称取(0.020 0±0.000 5)、(0.150 0±0.000 5)g于15 mL棕色小瓶中,分别加入60、80、100 mgL的CIP背景溶液,在25 ℃下以150 rmin的频率在振荡箱中恒温避光振荡,分别在1 min、5 min、10 min、15 min、30 min、1 h、2 h、4 h、6 h、12 h、18 h、24 h、48 h、72 h、96 h时间点取样,取样后静置20 min,取上清液,过0.45 μm滤膜后,置于液相小瓶中,利用高效液相色谱仪(HPLC)检测CIP的出峰面积,用吸附前后溶液中CIP浓度之差计算得到土壤对CIP的吸附量.
1.2.3等温吸附试验
按照1.2.2节称取一定量的沼泽土和亚高山草甸土样品加到15 mL棕色小瓶中,分别加入含有背景溶液的60、80、100、120、140 mgL CIP溶液15 mL,在25 ℃下振荡48 h,吸附平衡后,取样后按照1.2.2节方法操作.
1.2.4吸附热力学试验
按照1.2.3节的OECD guideline106批量平衡方法[13]进行试验,同样称取一定量的沼泽土和亚高山草甸土样品加到15 mL棕色小瓶中,分别加入含有背景溶液的60、80、100、120 mgL CIP溶液15 mL,在振荡箱温度为15、25、35 ℃下分别振荡48 h,吸附平衡后,取样后静置20 min,取上清液,过0.45 μm滤膜后,置于液相小瓶中,利用HPLC来检测CIP的浓度.
1.2.5背景溶液不同pH对吸附的影响
以上处理均做3个重复,同时设置空白对照(不含土壤的CIP溶液).
1.3 色谱条件
色谱条件:高效液相色谱柱C18反相柱(4.6 mm×150 mm,5 μm);流动相为乙腈与0.3%的三乙胺,体积比为15∶85;柱温为30 ℃;紫外检测波长为273 nm;流速为1.0 mLmin;进样量为50 μL;停留时间2.905 min.
1.4 数据分析方法
为了探讨CIP在亚高山草甸土和沼泽土中的吸附过程,采用准二级动力学方程、Elovich和双常数方程分别对试验数据进行拟合,表达式如(1)~(3)所示.
准二级动力学方程:
(1)
Elovich方程:
qt=a+blnt
(2)
双常数方程:
lnqt=a+blnt
(3)
式中:qt为t时刻土壤对CIP的吸附量,μgg;qe为吸附平衡时的吸附量,μgg;k为二级反应吸附速率常数,g(μg·h);a为吸附常数;b为与吸附能力有关的常数.
为描述亚高山草甸土和沼泽土中CIP的吸附热力学特征,采用Langmuir、Freundlich等温吸附模型和线性模型对试验数据进行拟合,表达式如(4)~(6)所示.
Langmuir等温吸附模型:
(4)
Freundlich等温吸附模型:
(5)
线性模型:
qe=KdCe+C0
(6)
式中:qmax表示吸附剂在平衡时以及土壤理论饱和的吸附量,μgg;KL为吸附表面强度常数,与吸附键能有关,其大小与吸附剂的吸附能力强度成正比;Ce为平衡时溶液中CIP的浓度,mgL;C0为平衡浓度为0 mgL时土壤中吸附质量浓度,mgL;Kf为吸附容量,其值越大,代表土壤对CIP的吸附容量越大,但不能反映最大吸附量;Kd为线性模型的吸附常数;1n表示吸附机制的差异和非线性程度,n≠1时吸附量与吸附质浓度有关.
不同温度条件下CIP在两种土壤中的吸附等温线用Freundlich和Langmuir等温吸附模型进行拟合,热力学方程参数采用Gibbs自由能变公式进行计算〔见式(7)~(9)〕.
Gibbs方程:
ΔGθ=ΔHθ-TΔSθ
(7)
Gibbs-Helm holtz方程:
ΔGθ=-RT×lnK
(8)
(9)
式中:ΔGθ为标准吸附自由能变,kJmol;ΔHθ为标准吸附焓变,kJmol;ΔSθ为标准吸附熵变,J(K·mol);R为气体常数,8.314 J(K·mol);T为绝对温度,K;K为吸附平衡常数.
2 结果与讨论
2.1 CIP在亚高山草甸土和沼泽土中的吸附动力学特性
不同初始浓度的CIP在亚高山草甸土和沼泽土中的吸附曲线如图1所示. 结果表明,CIP在这两种土壤中的吸附趋势相似,吸附过程均包括3个阶段——快吸附阶段、慢吸附阶段和平衡阶段. 其中,0~6 h为快吸附阶段,其吸附量随时间的延长而迅速增加. 初始浓度为60、80、100 mgL的CIP在亚高山草甸土和沼泽土中的吸附量分别占吸附总量的91.68%、96.49%、96.98%和85.09%、87.58%、89.60%;6~48 h为慢速吸附阶段,吸附量增加变得缓慢;当吸附进行到48 h时,吸附量达到平衡,确定此时为吸附平衡时间. 这与蒋煜峰等[8]研究黄土对CIP的吸附过程相似. 在快吸附阶段,由于土壤颗粒表面阻力较小,并因其具有较大的比表面积,为CIP提供了大量的吸附位点,使得CIP分子可在短时间内被吸附到颗粒表面;在慢吸附阶段,颗粒表面大部分吸附位点被占据,CIP受到较大微隙的阻碍,使其吸附速率减慢;吸附达到平衡后,颗粒吸附位点完全被占据,CIP浓度基本保持不变. 根据双模式吸附模型理论[14],在开始阶段溶解相有机质吸附CIP起主导作用,而后期CIP只能被孔隙填充相有机质吸附,这可能是造成后期吸附较慢的主要原因.
通常条件下,污染物吸附过程的控制包括化学反应、质量转移、微粒扩散等[10,15]. 该研究使用Elovich方程、准二级动力学方程、双常数方程对CIP在两种土壤中的吸附动力学过程进行拟合,其相关特征参数如表2所示. 从R2可以看出,准二级动力学方程(拟合曲线如图1所示)R2均大于0.92,比Elovich方程和双常数方程更适合描述CIP在两种土壤上的吸附过程,且对3种模型进行差异性检验后均为差异极显著水平.

图1 25 ℃下不同浓度CIP在亚高山草甸土和沼泽土中的吸附动力学曲线Fig.1 Adsorption kinetics curves of ciprofloxacin on subalpine meadow soil and marsh soil at 25 ℃
准二级动力学模型反映出整个吸附过程包含容积扩散、膜扩散、颗粒内扩散和溶质表面吸附[16]等,且整个过程中化学吸附和物理吸附同时存在. 通过利用Elovich方程和双常数方程对亚高山草甸土和沼泽土的CIP吸附过程进行拟合发现,不同CIP初始浓度下的R2均小于1,吸附过程不呈线性,且不经过原点. 由此可以推断,CIP在两种土壤中的吸附过程非常复杂,颗粒内扩散和膜扩散是吸附过程的主要限速步骤[8,17],这与已有研究中提出的“膜扩散或颗粒内扩散是主要限速步骤”的结论[10]相一致.
准二级动力学模型中k代表吸附速率常数,k越大,说明土壤对CIP的吸附速率也越快. 从表2可以看出,吸附速率常数k随CIP初始浓度的增加而降低,这是因为CIP浓度升高导致溶质分子间的碰撞几率增加,从而延长了CIP与吸附剂活性点位结合的时间[18]. 此外,当CIP初始浓度相同时,亚高山草甸土的k值大于沼泽土,原因可能是,吸附开始时,亚高山草甸土的pH(5.25)比沼泽土(5.55)更接近于吸附最佳pH(5),导致沼泽土中CIP的羧基基团与氢氧根离子结合更多,呈现带负电荷的离子形态(CIP-),与土壤表面的负电荷相互排斥力增大,吸附速率更低[19].

表2 CIP在亚高山草甸土和沼泽土中的吸附动力学模型拟合参数
2.2 CIP在两种土壤上的等温吸附特性
CIP在亚高山草甸土和沼泽土中的吸附等温试验用Langmuir、Freundlich等温吸附模型和线性模型进行拟合,结果如图2、表3所示. 结果表明,Freundlich等温吸附模型和线性模型的R2相近且均高于Langmuir等温吸附模型,但线性模型中C0出现负值,因而采用Freundlich等温吸附模型描述CIP在两种土壤中的吸附过程更为合理. 拟合结果显示,CIP在亚高山草甸土和沼泽土中的吸附均属于非均匀多分子层吸附,其主导机制为表面吸附和分配作用[20],同时吸附过程受吸附剂表面能和CIP异质性的影响. 1n反映吸附的非线性程度以及吸附机制的差异,1n越趋近于1,表示吸附线性程度越强. 1n受吸附剂颗粒表面点位、吸附质与吸附剂间的静电斥力、吸附质与其他分子间竞争吸附位点等因素的影响[21-23]. 由图2和表3可知,CIP吸附的1n接近于1,同时根据1n与等温吸附线的形状关系[24]得出,该研究中吸附等温线属于“L”型. 该线型产生的原因[25]可能是:当CIP浓度较低时,土壤与CIP分子间作用力较强,而当CIP浓度增至一定程度时,水分子与CIP分子间作用力占主导地位,土壤产生的吸附减弱. 这与CIP在两种土壤中的吸附动力学过程一致,即随CIP浓度的增加,k值逐渐减小.
由图2可知,随着CIP初始浓度的逐渐增加,两种土壤中CIP的吸附量也逐渐增加. 原因可能有两个:①溶液中CIP分子比例逐渐增加,推动了吸附反应的进行,降低了液-固两相间的冲击阻力;②CIP分子增多,加大了CIP与颗粒表面吸附位点结合的机会. 该试验中两种土壤的lgKf值在4.00~6.45之间,相比CIP在盐碱土(1.678~1.719)[26]、黄土(0.474~0.529)[8]中的数值要大得多,这可能是由盐碱土与黄土中有机质含量较低所致. 一般情况下,lgKf越大,表明土壤对CIP的吸附能力越强. 由表3可知,沼泽土吸附CIP的lgKf值(5.708)高于亚高山草甸土(4.940),即亚高山草甸土对CIP的吸附能力弱于沼泽土. 较高的有机质含量和阳离子交换量(CEC)促进了CIP在沼泽土中的吸附[27],亚高山草甸土对CIP的吸附能力弱于沼泽土,说明CIP在亚高山草甸土中的迁移能力较沼泽土更强.

图2 CIP在亚高山草甸土和沼泽土两种土壤中的吸附等温线及拟合曲线Fig.2 Adsorption isotherm and fitting curve of CIP on subalpine meadow soil and marsh soil
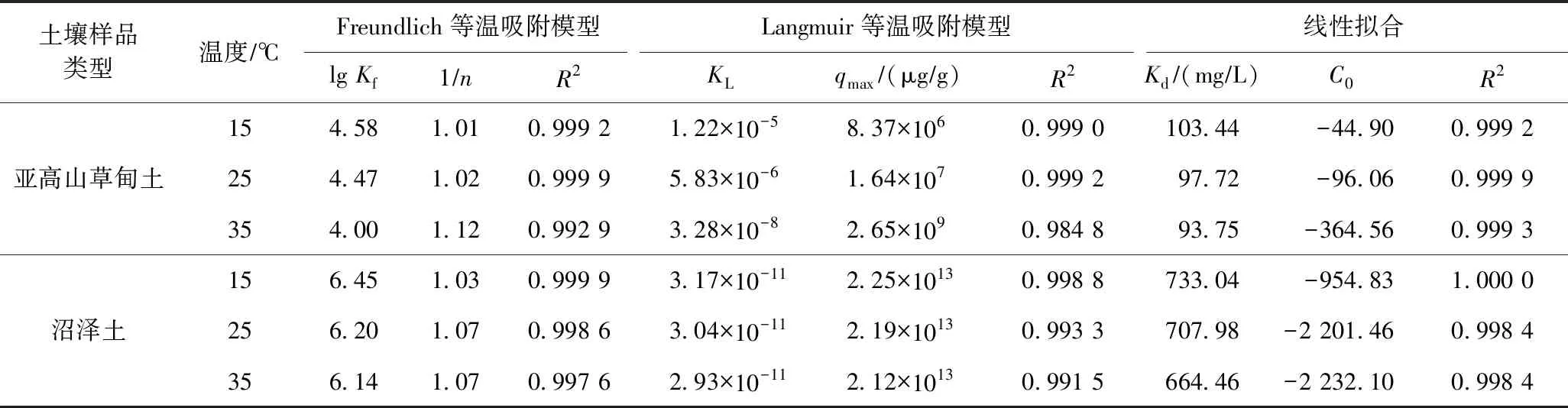
表3 不同温度下的吸附模拟方程参数
2.3 CIP在两种土壤上的热力学特征
根据图3可知,温度对CIP的吸附行为有明显影响. 随着温度的升高,亚高山草甸土和沼泽土对CIP的吸附量逐渐减小,说明温度升高反而不利于吸附. 通过对比25 ℃与35 ℃下的吸附结果发现,亚高山草甸土和沼泽土对CIP的吸附量分别降低了3.9%~6.3%和4.5%~6.8%.

图3 不同温度下CIP在亚高山草甸土和沼泽土中的平衡吸附量Fig.3 Equilibrium adsorption capacity of CIP on subalpine meadow soil and marsh soil at different temperatures
由表3可知,Freundlich等温吸附模型对CIP在亚高山草甸土和沼泽土的吸附拟合效果较好,其R2在 0.992 9~0.999 9 之间. 拟合结果表明,当温度从15 ℃升至35 ℃时,亚高山草甸土和沼泽土的lgKf值分别下降了0.58和0.31,说明温度的升高对CIP在亚高山草甸土和沼泽土中的吸附产生了负影响,影响了CIP在吸附剂上的吸附[28-30].
由拟合结果可知,亚高山草甸土和沼泽土对CIP的吸附等温线更符合Freundlich等温吸附模型,故取吸附平衡常数为Kf,以1T为横坐标、lgKf为纵坐标绘图,线性拟合后得到吉布斯自由能(ΔGθ)、熵变(ΔSθ)和焓变(ΔHθ),结果如表4所示. 结果表明,ΔGθ和ΔHθ均小于0,说明两种土壤对CIP的吸附均是自发进行的放热反应. 根据各种吸附作用力引起的吸附焓变化范围的总结[31]发现,ΔGθ值在-20~0 kJmol之间时,吸附以物理吸附为主,其吸附机理可能包括偶极矩力、范德华力和氢键[6]. 此外,ΔSθ大于0,表明熵增加,吸附过程增加了反应系统的混乱度.
2.4 不同初始pH对吸附的影响
从图4可以看出,随着背景溶液pH的升高,两种土壤对CIP的吸附量均呈现先增加后减小的趋势. 在pH=5、CIP初始浓度为120 mgL时,亚高山草甸土和沼泽土吸附量达到最大,分别为 5 917.03 和 43 113.79 μgg,该结果说明pH对沼泽土对CIP的吸附具有较大的影响.

表4 CIP在亚高山草甸土和沼泽土两种土壤上的 等温吸附热力学参数
对数据进行Freundlich和Langmuir等温吸附模型拟合后发现,Freundlich等温吸附模型对不同pH条件下两种土壤的CIP吸附行为拟合度更高,R2在 0.990 2~0.999 9 之间,lgKf随着pH的升高呈先增后减的趋势,拟合结果见表5. 当pH=5时,亚高山草甸土和沼泽土的lgKf达到最大值,分别为4.725和6.754,这说明强酸性和碱性条件下均不利于土壤对CIP的吸附. 土壤的表面性质对其吸附起决定作用,表面反应性主要与表面电荷有关[12]. 由图5可知,pH不同时,CIP在土壤中以阳离子态、阴离子态和兼性离子态这3种形态存在,CIP分子结构中有—COOH和—NH3,能结合土壤溶液中的H+和OH-[6,32]. 当pH<5时,溶液中过量的H+和溶液中共存的阳离子与CIP分子形成竞争,阻碍两种土壤对CIP的吸附;随着pH逐渐增加,H+浓度下降,H+和溶液中其他阳离子的竞争吸附作用减弱,两种土壤对CIP的吸附量逐渐增大[8];在溶液pH<6的酸性条件下,土壤表面存在大量负电荷,—NH3与H+结合后溶液中CIP以CIPH2+的阳离子态存在,CIPH2+形态容易通过阳离子交换作用、静电引力、阳离子桥、表面络合、π-π键等作用吸附在土壤上[32-33];pH为6~8时,CIP以CIPH±的兼性离子态存在,其中的CIPH2+虽可与其土壤表面负电荷相结合,但吸附效果低于弱酸性环境条件;当pH>8时,CIP中—COOH与OH-结合以CIP-的阴离子态为主,降低了土壤对CIP的吸附行为. 由此说明,两种土壤对CIP的吸附作用均以阳离子交换吸附为主.

图4 CIP在不同初始pH和初始浓度下的平衡吸附量Fig.4 Equilibrium adsorption capacity of CIP at different initial pH values and initial concentrations

表5 不同初始pH下CIP的等温吸附拟合参数
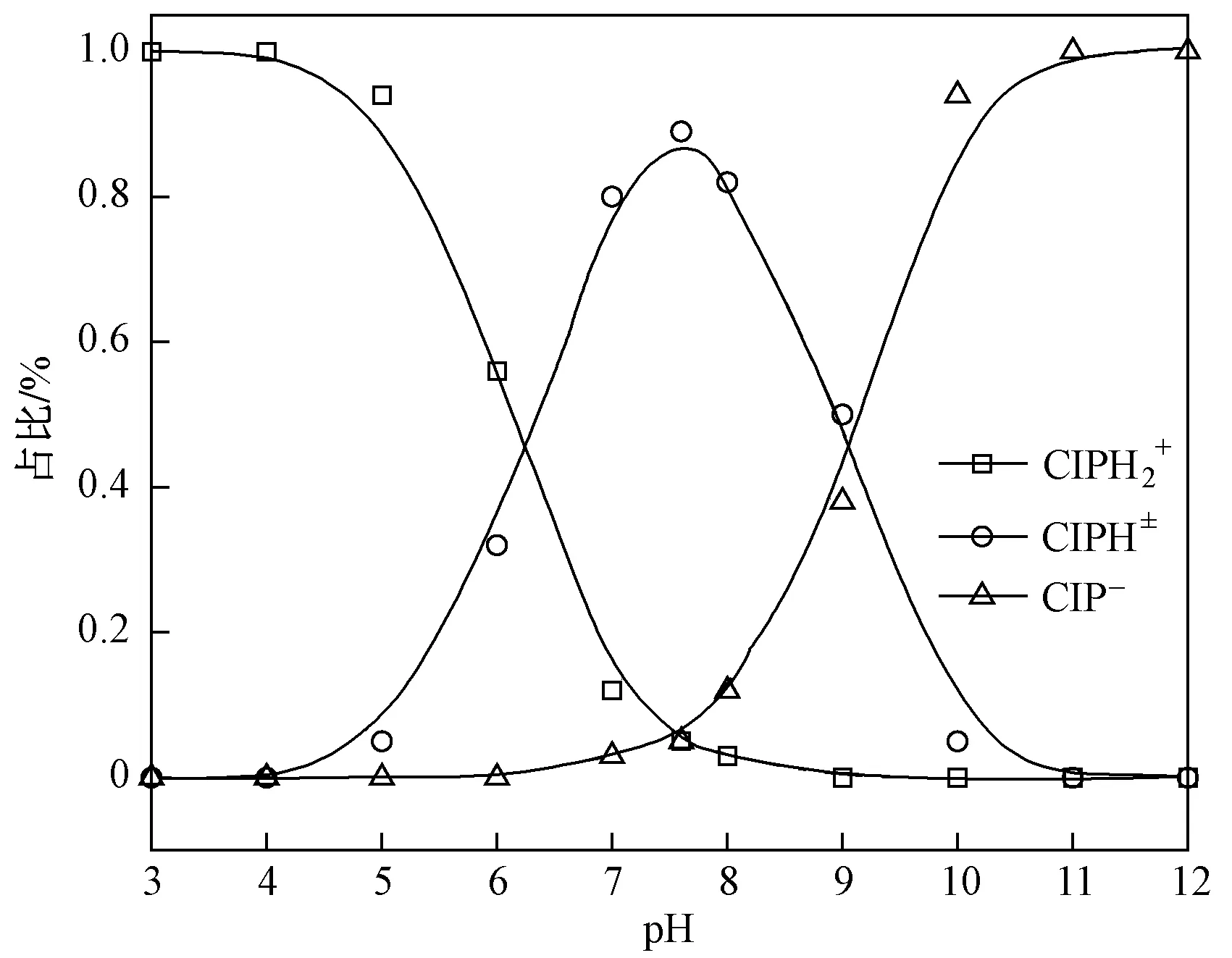
图5 不同pH下CIP的存在形态[8]Fig.5 Existence speciation of CIP at different pH[8]
3 结论
a) 亚高山草甸土和沼泽土对CIP的吸附平衡时间均为48 h,吸附分为快、慢两个阶段,其中,0~6 h为快速吸附,6~48 h为慢速吸附;吸附过程更符合准二级吸附动力学模型,是化学吸附和物理吸附同时存在的复合吸附反应.
b) CIP在两种土壤上的吸附适合采用Freundlich等温吸附模型拟合,该吸附等温线属于“L”型. 温度对CIP在亚高山草甸土和沼泽土中的吸附具有重要影响,随着温度升高,两种土壤对CIP的吸附量逐渐降低. 焓变(ΔHθ)和吉布斯自由能(ΔGθ)均小于0,说明两种土壤对CIP的吸附是自发进行的放热反应,此吸附以物理吸附为主. 此外,ΔSθ大于0,说明吸附过程增加了系统的混乱度.
c) CIP在两种土壤上的吸附量均随pH的增加呈现先增后减的趋势. pH=5时,CIP分子大多以CIPH2+的阳离子态存在,吸附能力最大,强酸和碱性环境均不利于土壤对CIP的吸附.
d) CIP在两种土壤上的吸附容量、吸附强度以及吸附速率存在很大差异,亚高山草甸土对CIP的吸附容量和吸附强度弱于沼泽土,但其吸附速率大于沼泽土.

