磁共振扩散峰度成像对肝移植术后急性排斥反应的诊断价值
李畅 黄丽 杨广奇 孙灿辉
原位肝移植(orthotopic liver transplantation,OLT)作为终末期肝病的有效治疗手段,近年来在手术技术的改进和术后并发症的控制不断取得新进展。作为移植手术的常见并发症,急性排斥反应(acute cellular rejection,ACR)在肝移植患者中的发病率相对较低(10%~40%)[1],然而如不能及时发现、治疗,病人进展为移植肝失功或慢性排斥反应的几率将大大提高,严重影响肝移植患者的预后[2]。目前,临床上对于急性排斥反应的诊断金标准仍为肝穿刺活检[3],但是由于穿刺点选择有取样误差,且穿刺术本身为有创性操作,有发生感染、出血等并发症的风险,且诊断所需要的时间相对较长,因此目前仍有一部分病人被漏诊或延误诊断。磁共振扩散峰度加权成像(diffusion kurtosis imaging,DKI)是今年来逐渐开展的一项新的扩散成像技术,其相较于传统的单指数模型磁共振扩散加权成像(diffusion weighted imaging,DWI)而言,不仅能反应体内水分子的高斯分布运动,而且能同时反应水分子的非高斯分布运动[4,5]。在人体组织内,由于生物膜、大分子物质以及血流灌注等影响,水分子运动往往呈非高斯分布,因此DKI 对于活体生物组织内的水分子运动情况的反映更为接近真实[6,7]。近年来研究也表明,DKI 对于肝肿瘤及纤维化的诊断价值由于DWI[8-10]。由于移植肝急性排斥反应主要体现在门脉周围淋巴细胞浸润、胆管上皮损伤和血管内皮淋巴细胞浸润,肝组织的微观结构更加紊乱,假设DKI 对于急性排斥反应的病理改变更加敏感,为此笔者通过设计回顾性研究初步验证该假设。
资料与方法
1.一般资料
回顾性连续收集2014 年10 月~2018 年4 月肝移植术后于我院行磁共振检查的患者112 例,其中剔除13 例未发现明确病变、9 例肿瘤复发、3 例图像质量不佳的患者,剩余87例患者中,18 例于MR 检查后1 周之内行肝穿刺病理确诊 为ACR,56例经ERC 或MRC 确诊为胆道并发症,11例经DSA 或手术证实为血管并发症,2 例经穿刺活检确诊为药物性肝损伤(drug induced liver injury,DILI),最终将所有入组病人分为ACR 组(18 例)和对照组(87例)。两组间年龄、性别、原发病、实验室检查均无统计学差异。
2.磁共振成像
采用3.0 T 磁共振仪(Siemens,Magnetom Trio)进行扫描,采用轴向单次激发自旋回波-平面回波自由呼吸下进行肝脏DKI 扫描。扫描参数如下:TR 3300 ms,TE 88 ms,矩阵168×105,层厚5.0 mm,层间距1.0 mm,视野380 mm×420 mm,FA 90°,NEX 5,b 值取0、200、500、1000、1500、2000 s/mm2,每个b 值均施加15 个方向的扩散敏感梯度场。
3.图像分析
DKI 图像后处理软件由Siemens 提供(Body Diffusion Toolbox)。所需MR 图像以DICOM 格式存储,根据扩散峰度模型原理:
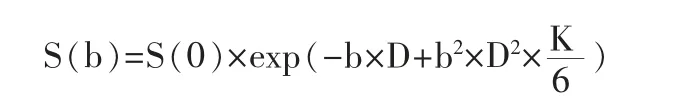
[注:公式中S(b)为相应b 值扩散梯度场下的信号强度,S(0)为扩散梯度场为0 时的信号强度]
可得到K 值代表峰度(excess kurtosis),反应真实水分子扩散位移偏离高斯分布的程度,D 值代表扩散系数(diffusivity),代表经非高斯分布矫正后的表观扩散系数(apparent diffusion coefficient,ADC)值。根据单指数模型:


图1 a)原始DKI 图;b)后处理软件得到的K 值图、c)D 值图和d)拟合曲线
得到ADC 值。将DKI 序列扫描所得DKI 图像导入后处理软件,生成代表扩散信息的D、K、ADC参数图像,经软件分析后得到的拟合曲线所示,DKI 模型得到的拟合曲线相较于单指数模型的拟合线与实际测量得到的曲线更加接近(图1)。在呼吸运动伪影最小的参数图像上划取兴趣区(region of interest,ROI),软件自动将ROI 放置在参数图同一层面、同一位置(图2、3)。ROI 选取避开伪影、邻近血管及胆管,每个ROI 大小约0.55~2.00 cm2。为减少误差,所有ROI 选取分别由两名放射科医师(未告知病理结果)独立操作,每例各放置三次不同位置ROI,同一患者范围选取尽量保持一致。测量并记录三次平均D、K、ADC 值。
4.统计学分析
所有数据采用SPSS 软件包进行分析。采用组间相关系数(interclass correlation coefficient,ICC)检验两名医师扩散参数测量结果的一致性。采用Kolmogorov-Smirnov 检验评估计量资料是否符合正态分布,采用t 检验(正态分布)或Mann-Whitney U 检验(偏态分布)比较两组间各参数的差异,P<0.05 为差异具有统计学意义。采用受试者工作面积特征曲线(receiver operating characteristic,ROC)评估各参数对于诊断ACR 的效能。
结果
1.两名医师各测量参数的组间一致性
两名医师测量各DKI 参数间的ICC 结果见表1,由表中可见,D 值、K 值及ADC 值的ICC 结果均>0.75,提示一致性良好。
2.ACR 组与对照组的D 值、K 值与ADC 值比较
t 检验或Mann-Whitney U 检验结果显示,两组间的D 值与K 值有明显统计学差异,ACR 组的D 值低于对照组(P=0.012),ACR 组的K 值高于对照组(P=0.003),而两组间的ADC 值则无统计学差异(P=0.560)(表2)。
3.D 值与K 值在对于ACR 的诊断效能比较
D 值的ROC 曲线下面积为0.867(95%可信区间0.717~0.955),K 值的ROC 曲线下面积为0.925(95%可信区间0.792~0.985),后者在最大优登指数的诊断敏感度、特异度和准确度分别为0.947、0.789、0.737(图4)。
讨论
肝移植术后急性排斥反应的早期诊断和治疗对于改善患者预后至关重要,可以有效避免疾病进展为慢性排斥或移植肝失功[1]。与传统DWI 相比,DKI 可以反映水分子的非高斯运动特性,对于扩散的不均质性更加敏感,能够提供组织微观结构及病理生理改变更加全面的信息。既往研究显示,DKI 可以有效反映肝脏弥漫性病变(如肝纤维化、非酒精性脂肪性肝炎等)的病变进程[11,12]。
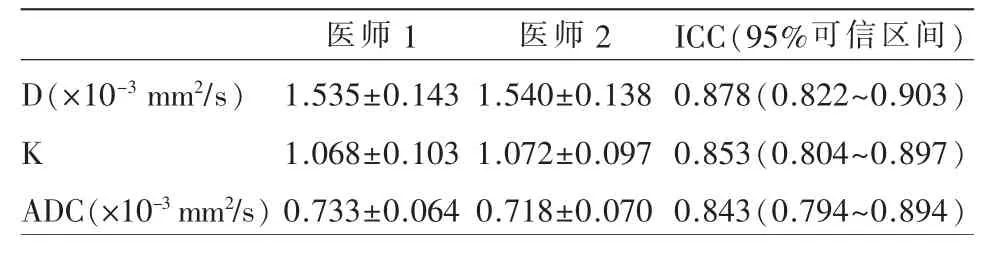
表1 两名医师测量各DKI 参数的组间一致性结果

表2 ACR 组与对照组的磁共振扩散参数

图2 ACR 组扩散参数图。a)~c)分别为D、K 和ADC 图,其数值分别为1.261×10-3 mm2/s、1.143 和0.967×10-3 mm2/s 图3 对照组扩散参数图。a)~c)分别为D、K 和ADC 图,其数值分别为2.498×10-3 mm2/s、1.091 和1.455×10-3 mm2/s
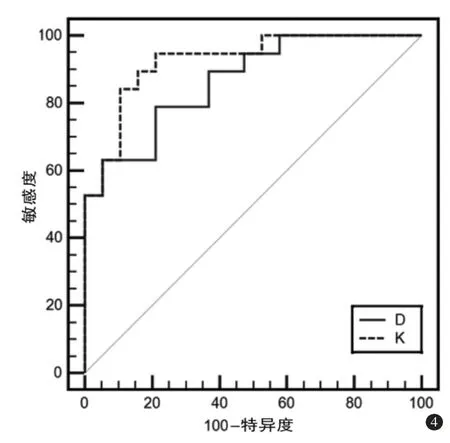
图4 D 值与K 值对ACR 诊断的ROC 曲线
本研究结果显示,DKI 可有效区分肝移植术后ACR 与其他病变。ACR 患者D 值相对更低,K 值相对更高,而ADC 值则与对照组患者无统计学差异。发生急性排斥反应时,肝组织内的微观结构改变,汇管区炎症细胞浸润导致细胞外间隙减少[13],水分子扩散运动受限,从而表现为D 值下降;而胆管上皮损伤变性和血管内皮的炎症浸润导致肝脏组织微观结构复杂性增高,水分子非高斯分布的特征更加明显[14],表现为K 值升高。由于ADC值反应的是水分子高斯分布特性,因此对于体内微观结构复杂性的反映并不全面。进一步对于D值和K 值进行ROC 曲线分析得到,K 值对于ACR的诊断效能高于D 值。
既往有学者研究发现,某些CT 图像特征(如球状肿胀、非吻合口区肝静脉狭窄以及门脉期不均匀强化)可提示急性排斥反应[15],但是笔者在临床阅片过程中发现,这些征象在ACR 患者中出现的概率很低,尤其是早期ACR,因此对于诊断的敏感性并不高,尽管出现上述征象可提示ACR 的发生,但是往往已经错过最佳治疗时期,对于患者的预后改善并不多。另外有学者也曾报道运用超声声脉冲辐射力成像技术(acoustic radiation force impulse,ARFI)辅助诊断儿童急性排斥反应[16],但是敏感性和可重复性仍有待商榷。因此临床需要更敏感、准确的无创性检查手段来早于穿刺活检之前指导下一步治疗。鉴于DKI 优于其他常规序列对于组织微观结构的反映更加准确,研究也证明DKI 的非高斯特征参数对于ACR 的诊断更加准确。
本研究尚存在以下不足:(1)由于本研究设计为回顾性分析,且样本量较少,不可避免存在入组偏倚,后续将继续开展前瞻性队列研究及扩大样本量;(2)本研究为随机选取ROI,尽管取平均值后可以一定程度上减少人为原因造成的偏倚,却无法避免抽样误差,且较为耗费人力,未来设想可以通过开发智能软件自动识别并勾画全肝ROI 并进一步尝试影像组学分析,减少放射科医生的工作量,同时提高诊断符合率。