消瘀泄浊饮介导PI3K/Akt/mTOR信号通路改善糖尿病肾病小鼠肾纤维化*
陈 峰 徐瑜琳 陈红波 项晓骏#
1 湖州南太湖医院 浙江 湖州 313008
2 浙江省中医院 浙江 杭州 310018
组织纤维化可通过PI3K/Akt/mTOR信号通路介导,且糖尿病肾病(DN)肾纤维化进展也与调控该信号通路相关。动物实验表明,对于肾损伤、肾纤维化大鼠,消瘀泄浊饮可通过抑制该信号通路发挥保护肾功能的作用[1-3]。基于此,本研究通过DN模型,分析消瘀泄浊饮对DN小鼠肾纤维化和肾损伤的保护作用,并探讨潜在机制,为临床治疗DN提供参考依据。
1 材料与方法
1.1 实验动物:60只6周龄糖尿病模型(db/db)小鼠购于上海斯莱克实验动物有限责任公司,动物生产许可证号SCXK(沪)2017-0015;饲养于浙江中医药大学动物实验中心,饲养许可证号SYXK(浙)2018-0012。自由饮食饮水。
1.2 主要材料与仪器:消瘀泄浊饮颗粒剂(炙黄芪20g,车前草15g,制大黄、酒地龙、桃仁、川牛膝各10g,江苏天江药业有限公司),完全溶解于600ml灭菌水中煎煮1h,共煎2次,混合于旋转蒸发器浓缩,制备消瘀泄浊饮药液(0.96g/ml),4℃冰箱中贮存。根据人的体重与剂量进行换算,配制高、中、低3个浓度的中药,分别为7.5、15、30g/(kg·d)(60kg成人的消瘀泄浊饮每日剂量为 96g)。Anti-beta Actin、Anti-pan-AKT、Anti-AKT、Anti-TGF beta 1抗体(批号:ab8226、ab8805、ab38449、ab92486)购于Abcam;mTOR、p-mTOR、p-PI3K、PI3K抗体(批号:AF6308、AF3308、AF3242、AF6242)购于Affinity。苏木素染液、DAB kit(批号:MD911467、MD912068)购于MDL。超氧化物歧化酶(SOD)、丙二醛(MDA)试剂盒(批号:IC-SOD-Ra、IC-MDA-Ge)购于IC/IBL。ASP200S全自动脱水机、G1150 H加热石蜡包埋系统(Leica)。
1.3 制备DN肾纤维化模型与分组:适应性喂养1周后,尾静脉采集db/db小鼠血标本,对空腹血糖值进行测量,若出现>11.1mmol/L,则视为造模成功。选取同周龄db/m小鼠12只,设为正常组。阳性对照组给予16mg/(kg·d)厄贝沙坦,消瘀泄浊饮低、中、高剂量组(XXD-L组、XXD-M组、XXD-H组)分别给予7.5、15、30g/(kg·d)消瘀泄浊饮;正常组、DN组利用等体积生理盐水灌胃,各组小鼠每日定时、持续8周灌胃,期间按小鼠体重变化程度调整剂量。
1.4 血糖监测:每周监测各组小鼠体重及血糖波动情况,取尾静脉血测量前,应对各组禁食8 h,血糖试纸测空腹血糖值。
1.5 常规指标检测:给药8周后,处死小鼠前1d将各组小鼠置于单独的代谢笼中以便采集小鼠24h尿液用以测量尿肌酐(Ucr)水平,同时行眼眶取血,收集、离心获取血清,以测定血清中尿素氮(BUN)含量。
1.6 肾脏指数:各组小鼠于给药8周结束后采用颈脱臼法处死,常规解剖摘取肾脏组织并标记,称重,计算肾脏指数(%)=肾脏质量/体重×100%。
1.7 氧化应激指标检测:参照相关试剂盒说明,按步骤检测并记录肾脏组织SOD、MDA水平。
1.8 HE、Masson染色:相应肾脏组织置于4%PFA中,脱水、包埋,切片机上切片,厚为4μm,展平于60℃烘箱内烘烤,二甲苯脱蜡,水化。HE、Masson染色按照试剂盒说明进行处理;常规脱水、透明、封片。显微镜拍照,进行图像采集,并分析肾脏组织病理改变和纤维化程度。
1.9 Western Blot检测:Western Blot检测各组小鼠肾组织转化生长因子 β1(TGF-β1)、p-PI3K、PI3K、p-Akt、Akt、p-mTOR、mTOR表达水平。取肾组织样品,加1ml冷Lysis Buffer,碾碎组织,裂解,提取总蛋白。BCA法测定。SDS-PAGE电泳分离,转PVDF膜,封闭,TBST洗膜,加一抗(TGF-β1、p-PI3K、PI3K、p-Akt、Akt、p-mTOR、mTOR),4℃振荡过夜孵育,加相应二抗,室温孵育1~2h,洗膜。以β-actin为内参,化学发光处理,chemi capture软件拍摄处理图像。
1.10 统计学处理:应用SPSS 19.0统计软件,计量资料用均数±标准差(±s)表示,两组间用t检验比较,P<0.05表示差异有统计学意义。
2 结果
2.1 消瘀泄浊饮对小鼠空腹血糖的影响:与正常组比较,DN组空腹血糖显著升高(P<0.01)。与DN组比较,各给药组可不同程度下降空腹血糖浓度,但XXD-L组变化无统计学意义(P>0.05),阳性对照组、XXD-M组、XXD-H组空腹血糖呈显著性降低(P<0.05或P<0.01)。见图1。
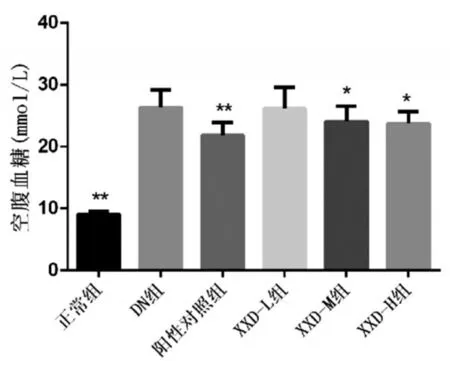
图1 消瘀泄浊饮对小鼠空腹血糖的影响
2.2 消瘀泄浊饮对小鼠Ucr、BUN水平的影响:DN组尿液中Ucr水平较正常组显著降低,而血清中BUN水平显著升高(P<0.01)。各给药组均可在一定程度上改善Ucr、BUN水平,与DN组比较,仅阳性对照组和XXD-H组可显著升高Ucr水平(P<0.01,P<0.05),降低BUN水平(P<0.01,P<0.05),XXD-M组仅Ucr水平显著升高(P<0.05),BUN无显著变化(P>0.05),XXD-L组Ucr、BUN水平无显著变化(P>0.05)。见表1。
表1 消瘀泄浊饮对小鼠Ucr、BUN水平的影响(±s)

表1 消瘀泄浊饮对小鼠Ucr、BUN水平的影响(±s)
注:与DN组比较,*P<0.05,**P<0.01。
组别正常组DN组阳性对照组XXD-L组XXD-M组XXD-H组BUN(mg/dL)5.59±0.56**7.60±0.78 6.42±0.53**7.45±0.79 7.42±0.83 6.85±0.56*例数12 12 12 12 12 12剂量— —16mg/(kg·d)7.5g/(kg·d)15g/(kg·d)30g/(kg·d)Ucr(µmol/L)1997.96±235.58**585.60±84.80 798.13±130.41**614.91±50.93 649.57±45.67*671.72±67.59*
2.3 消瘀泄浊饮对小鼠肾脏指数的影响:与正常组比较,DN组肾脏指数显著升高(P<0.01)。给药处理后,可降低肾脏指数,与DN组比较,XXD-L组、XXD-M组无显著变化(P>0.05);而阳性对照组、XXD-H组肾脏指数显著降低(P<0.01,P<0.05)。见表2。
表2 消瘀泄浊饮对小鼠肾脏指数的影响(±s)

表2 消瘀泄浊饮对小鼠肾脏指数的影响(±s)
注:与DN组比较,*P<0.05,**P<0.01。
组别正常组DN组阳性对照组XXD-L组XXD-M组XXD-H组肾脏指数(%)0.58±0.112**0.76±0.080 0.66±0.095**0.71±0.113 0.69±0.096 0.67±0.097*例数12 12 12 12 12 12剂量——16mg/(kg·d)7.5g/(kg·d)15g/(kg·d)30g/(kg·d)体重(g)27.01±2.16**34.75±2.75 31.95±1.88**34.94±3.18 34.49±2.54 32.65±1.85*肾脏质量(g)0.15±0.019**0.26±0.018 0.21±0.026**0.25±0.031 0.24±0.026 0.22±0.028**
2.4 消瘀泄浊饮对小鼠肾脏组织SOD活性、MDA水平的影响:与正常组比较,DN组SOD活性显著降低(P<0.01),MDA含量显著升高(P<0.01)。给药处理后,SOD活性、MDA水平均有所改善,与DN组比较,XXD-L组无显著变化(P>0.05),阳性对照组、XXD-M组、XXD-H组可显著升高SOD活性(P<0.05),显著降低MDA水平(P<0.01)。见图2。
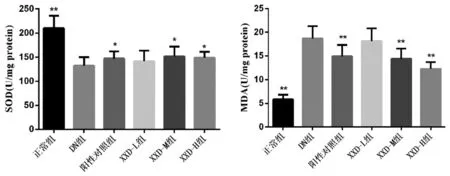
图2 消瘀泄浊饮对小鼠肾脏组织SOD活性、MDA水平的影响
2.5 消瘀泄浊饮对小鼠肾脏组织病理变化的影响:HE染色,正常组肾脏整体结构清晰,且较为完整,基底膜光滑,可见规则形态的肾小球,紧密整齐排列的肾小管,炎性细胞无浸润。DN组可见肾小球体积增大,紊乱结构的肾小管,基底膜增厚,炎性细胞浸润增多。给药处理后,除XXD-L组外均可不同程度恢复肾脏结构,肾小管排列趋于紧密,缩小肾小球体积,基底膜厚度降低,炎性细胞浸润少,其改善程度从高到低依次为阳性对照组、XXD-H组、XXD-M组。见图3。

图3 消瘀泄浊饮对小鼠肾脏组织病理变化的影响(HE染色,200、400倍)
2.6 消瘀泄浊饮对小鼠肾脏纤维化程度的影响:Masson染色。正常组小鼠肾间质及肾小球未见纤维组织增生,无异常改变;而DN组可见大量肾间质纤维化,给药处理后,除XXD-L组外,均可有效减轻纤维组织增生症状,减小肾小球体积,其改善程度从高到低依次为:阳性对照组、XXD-H组、XXD-M组。见图4。
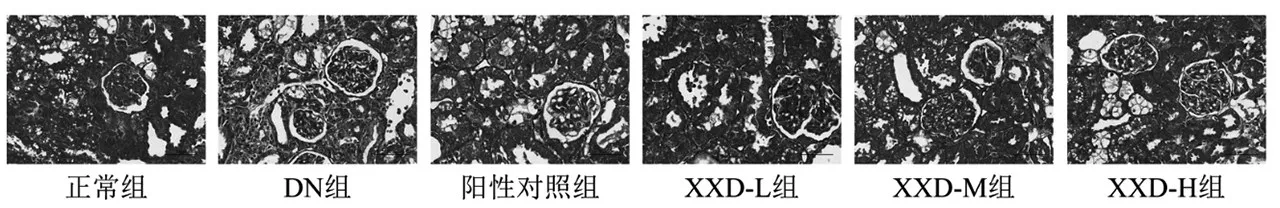
图4 消瘀泄浊饮对小鼠肾脏纤维化程度的影响(Masson染色,400倍)
2.7 消瘀泄浊饮对小鼠肾组织中TGF-β1、p-PI3K、p-Akt和p-mTOR表达的影响:各组小鼠肾组织AKT、PI3K和mTOR蛋白表达无显著性差异(P>0.05),其余蛋白表达均呈上升趋势,DN组与正常组差异显著(P<0.01)。与DN组比较,各给药组均可下调肾脏组织p-Akt/AKT、p-PI3K/PI3K蛋白表达(P<0.05或P<0.01);仅阳性对照组和XXD-H组可显著下调p-mTOR/mTOR蛋白表达(P<0.05,P<0.01);除XXD-L组外,阳性对照组、XXD-M组、XXD-H组均显著下调TGF-β1蛋白表达(P<0.05或P<0.01)。见图5。

图5 消瘀泄浊饮对小鼠肾组织中TGF-β1、p-PI3K、PI3K、p-Akt、Akt、p-mTOR和mTOR表达的影响
3 讨论
DN在中医学属“尿浊”“消渴”“水肿”等范畴,病机复杂,糖尿病是其发病之本,久病伤正,气阴耗伐,加重五脏虚衰,致阴损及阳,阴阳两虚;燥热、瘀血、痰浊等交杂,是以本虚标实、虚实交杂为DN主要病机。脾肾亏虚,肾主藏精,脾主运化,脾虚则不能固摄,湿浊内停,泛溢肌肤,则为水肿;肾气亏虚则精气下泄,致蛋白尿。脾肾亏虚,血运不畅,则经脉瘀阻,致湿、毒、瘀、热产生。DN病程冗长,病情复杂多变,宜以补益脾肾、消瘀泄浊为治疗之根本。
消瘀泄浊饮临床上广泛应用于肾功能不全的治疗,针对气虚夹瘀浊证为主,方中黄芪壮脾胃,益正气,补肾脏之虚,为君药;制大黄逐瘀通经,亦可凉血解毒、荡涤肠胃,引出浊毒之邪,为臣药;川牛膝祛风利湿、通经活血,桃仁活血祛瘀,二者协同可活血化瘀、导浊毒之邪外出,加之地龙搜风剔络、善入经脉,三者相配可加大活血、化瘀通络之效,推陈出新,为佐药;车前草为使,清热利尿、凉血解毒。全方诸药,共奏水行浊泄、气足血行瘀祛之效,切合DN病机。

