MRI-DWI对单纯乳腺导管原位癌、浸润性导管癌的鉴别诊断价值
袁秀华 王 刚 李德维
东莞市人民医院放射科(广东 东莞 523000)
乳腺癌常见于女性患者,是一种死亡及转移率较高的恶性肿瘤[1]。美国每年乳腺癌新发病例约18万,我国乳腺癌新发病例约28万,跃居我国女性恶性肿瘤第二位[2]。浸润性导管癌(invasive ductal carcinoma,IDC)是乳腺癌中最常见的病理类型。乳腺导管内原位癌(ductal carcinoma in situ,DCIS) DCIS是指各种局限于乳腺导管的肿瘤性病变[3]。核磁共振成像(magnetic resonance imaging,MRI)是检查恶性肿瘤的重要方法,其诊断图像不受血流、呼吸、骨骼的影响,能准确反映肿瘤部位、血供与周围组织关系[4]。扩散加权成像(diffusion weighted imaging,DWI)能够检出与组织含量改变有关的形态学及病理学的早期改变,分析表观扩散系数(apparent diffusion coefficient,ADC)可量化分析水分子扩散运动程度,以明确肿瘤良恶性。本研究选取我院2015年1月至2020年4月收治的DCIS、IDC患者作为研究对象,采用MRI-DWI检查,现将研究结果报道如下。
1 资料与方法
1.1 一般资料经医院伦理学会批准随机选取医院2017年1月至2020年4月收治乳腺癌患者80例,其中IDC患者42例,DCIS患者38例。年龄28~64岁,平均年龄(42.98±4.08)岁,病程1~7年,平均病程(3.57±1.28)年,肿瘤内有面积3~17mm2,平均肿瘤内有面积(8.98±2.61)mm2,肿瘤直径2~7cm,平均肿瘤直径(5.98±1.08)cm,TNM分期Ⅰ~Ⅱ期25例、Ⅲ期41例、Ⅴ期14例。诊断标准[5]:符合WHO制定的IDC、DCIS相关诊断标准。
纳入标准:知情同意;成年患者;病理确诊;接受MRI检查的患者。排除标准:妊娠期、哺乳期患者;复发患者;化疗患者;终末期患者;认知功能障碍患者;合并其他恶性肿瘤患者;腹腔积液患者。
1.2 方法MRI常规检查,磁共振选择西门子生产的3.0T超导型核磁共振成像系统,16通道专用乳腺线圈,选取俯卧位,头先进,双侧乳腺自然下垂,双臂前伸置于头上,戴上耳塞。开启常规检查,参数:快速自旋回波序列,T1加权成像,TR 495ms,层厚/层距3.0mm/0.0mm,视野FOV 340mm,矩阵Matrix 272/522r。T2加权成像,TR 4720ms,层厚/层距3.0mm/0.0mm,视野(FOV)340mm。开启DWI程序,采用单次继发自旋回波-平面回波成像序列进行轴状位及矢状位扫描,TR 5000ms,层厚/层距4.0mm/0.0mm,矩阵Matrix121/176r,弥散敏感系数b值0、500、800、1000s/mm。
1.3 观察指标所得图像上传至工作站,由2名工作经验丰富的影像学医师进行审片,不同意见需经讨论得出一致结论。观察肿瘤病变形态(图1A)、有无伴随征象、边缘情况(图1B)。记录加权成像表观扩散系数(apparent diffusion coefficient,ADC)值、相对表观扩散系数(relative apparent diffusion coefficient,rADC)值。对MRI-DWI图像进行评估,包括非肿块样强化区特点、肿块样强化区特点、背景实质强化情况及MRI-DWI病灶信号特征。强化区强化特点包括分布及内部强化特点,分布特点为局灶、线样、段样。
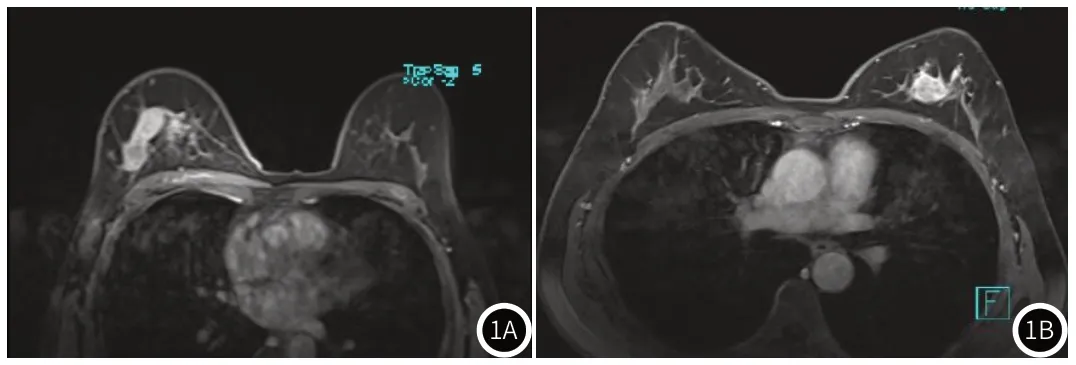
图1 DCIS病变情况。1A:MRI-DWI可见左侧乳腺内肺肿块样强化病灶,边缘清晰,强化均匀;1B:MRI-DWI可见右侧乳腺内不规则肿块,边缘规则,强化不均匀。
1.4 统计学方法所有数据资料使用SPSS 24.00软件分析,计量资料以()形式表示,组间比较采用t检验;计数资料以百分比(%)表示,组间比较采用χ2检验,等级资料采用秩和检验,分析诊断效能。P<0.05表示差异有统计学意义。
2 结 果
2.1 DCIS和IDC内部强化特征比较DCIS和IDC线状强化比较(表1):38例DCIS患者中主要以无线状分布为主,显著多于IDC组,差异具有统计学意义(P<0.05);42例IDC患者主要以分支线状分布为主,显著多于DCIS组,差异具有统计学意义(P<0.05)。

表1 DCIS和IDC线状强化特征
DCIS和IDC簇环状/网格状结构强化特点比较(表2):38例DCIS患者中簇环状/网格状结构清晰者22例,簇环状/网格状结构模糊,但能辨认者10例。42例IDC患者中,10例患者表现为簇环状/网格状结构模糊,病变信号较均匀,23例患者表现为簇环状/网格状结构消失,病变信号均匀。两组患者簇环状/网格状结构强化分布存在显著差异,差异具有统计学意义(P<0.05)。
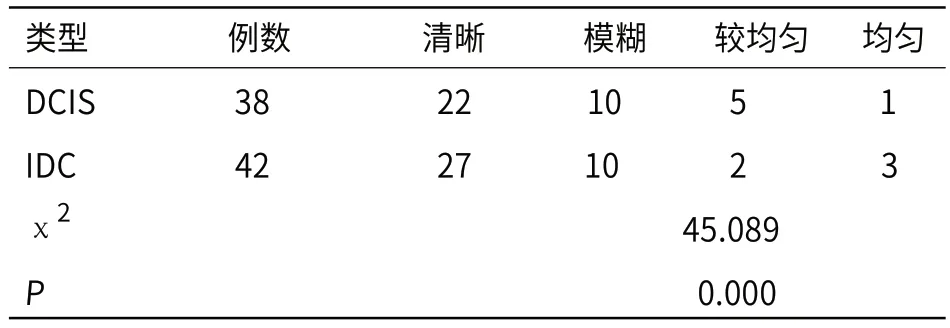
表2 DCIS和IDC簇环状/网格状结构背景强化特点
2.2 MRI-DWI信号特征比较38例DCIS患者中,5例MRI-DWI上未见信号异常,33例MRI-DWI表现为高信号影(图2),T2脂肪抑制序列中8例表现异常,其中3例为片状高信号,3例为高信号结节,2例信号不均匀。42例IDC患者中,2例MRI-DWI上未见信号异常,40例为信号不均匀,T2脂肪抑制序列中,12例为等信号,30例为高信号(图3)。

图2 50岁女性,右乳导管原位癌,MRI-DWI上右乳偏外侧可见偏高信号结节。图3 53岁女性,右乳浸润性导管癌,MRI-DWI上右乳外侧可见高信号结节。
2.3 MRI-DWI病变定量指标比较IDC最大直径、ADCMax低于DCIS(P>0.05),IDC患者ADCMin低于DCIS(P<0.05),表观扩散系数下降率,见表3。
表3 MRI-DWI病变定量指标比较()
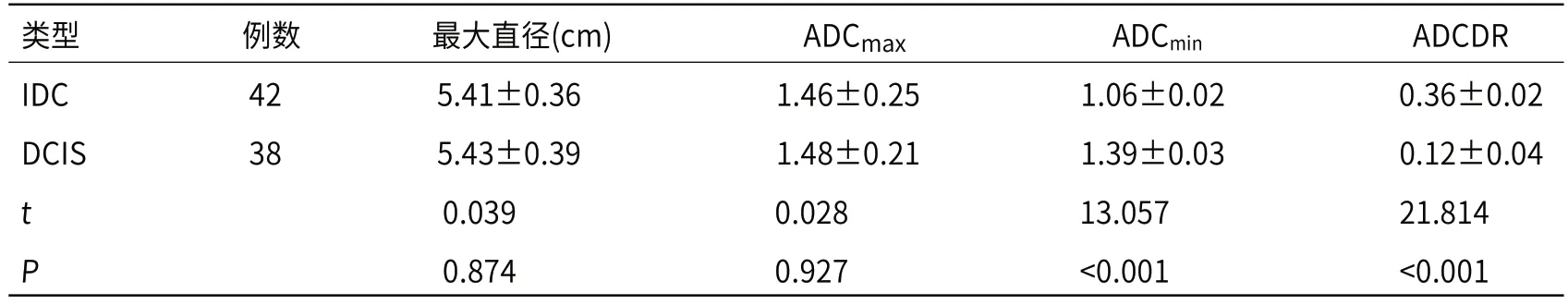
表3 MRI-DWI病变定量指标比较()
2.4 MRI-DWI鉴别IDC、DCIS的ROC曲线分析由表4和图4可知,联合ADCmin、ADCDR诊断AUC0.851,约登指数、敏感度、特异度分别为0.728、89.5、83.3。

表4 MRI-DWI鉴别IDC、DCIS的ROC曲线分析

图4 MRI-DWI鉴别IDC、DCIS的ROC曲线分析
3 讨 论
乳腺疾病女性的常见,其中IDC、DCIS较常见。目前我国IDC、DCIS发生率呈上升趋势,且发病年龄呈年轻化,严重威胁患者生命健康[6]。IDC、DCIS发生机制尚未完全明确,与生活习惯改变、压力增大、内分泌失调等有关[7-9]。MRI是一种无创、无辐射的影像学技术,可作为乳腺癌高危遗传因素的筛查手段。MRI可以评价软组织,具有较高的空间分辨率,能够较清楚地显示病灶形态、边缘轮廓、肿瘤边界[10-11]。良性乳腺组织边界较清楚,形态多为圆形或类圆形。乳腺恶性病变的规则不规则,常见“毛刺征”,边缘较模糊,内部信号不均匀。同时部分患者皮肤增厚,乳头凹陷。有学者认为MRI上肿块边缘毛刺征,呈足状外观。IDC预后较差,其发生及发展与癌细胞自身改变、细胞迁徙能力增粘、基质的趋化作用有关[12]。DCIS是指导管基膜以内无兼职侵袭的癌,病理学分类包括低级、中级、高级,级别越高,分化越差[13]。明确IDC、DCIS病变大小及范围很重要,体积较大的病变可能伴有隐性侵袭,且复发率较高。MRI-DWI能进行空间匹配,形成一致的影像学结果。DWI是乳腺癌核磁共振检查中最重的检查程序,能清晰显示乳腺病变的形态学特征及血流动力学特点。
肿瘤病灶信号特征和内部强化特征有利于恶性肿瘤的诊断价值。本研究结果显示,DCIS和IDC内部强化特征存在明显差异,原因可能在于两种癌症的组织病理结构变化和供血状况引起。DCIS为非侵袭性,癌细胞处于乳腺导管内,其基底膜未浸润,腺体间质在肿瘤刺激下会出现增多,但并不存在癌细胞生长,因此,MRI-DWI表现以线状和簇环状/网格状结构清晰为主。而IDC癌细胞组织广泛浸润,腺体间质内有肿瘤细胞组织和血管,故MRI-DWI表现以分支线状和病变信号均匀为主。有学者认为MRI-DWI早期增强图像上的肿瘤实质强化显示最清晰,适用于查宿测量及分析。非肿块样强化的病灶中DCIS主要表现为线样分布,强化不均或均匀。IDC主要表现为强化均匀[14],这与本研究结果相似。此外,本研究发现,DCIS患者MRI-DWI主要表现为高信号影,IDC患者MRI-DWI主要表现为信号不均匀,原因可能在于肿瘤细胞内和细胞外自由水增多,因此,病变信号强度增高,而IDC肿瘤细胞广泛侵袭,细胞增殖快,微血管丰富,其瘤体中心常发生囊性改变、出血以及坏死,从而导致病变信号不均匀。
肿瘤病变定量指标能反映患者机体肿瘤生长情况,指导临床制定个性化治疗方案[15]。肿瘤直径、ADCmax、ADCmin、ADCDR是MRI最常见的指标。ADC值大小与肿瘤细胞增殖速度、细胞排列密度、细胞外间隙大小有关。DCIS中肿瘤细胞突破基底膜,肿瘤细胞生长开始活跃,水分子扩散受限,导致ADC值降低。本研究结果显示,IDC患者ADCmin值低,ADCDR值高。ADCmin表示病灶中癌细胞密度最高区和癌卵的位置。肿瘤细胞突破基底膜侵犯邻近组织后ADCDR直增加。MRI-DWI通过反映IDC患者肿瘤细胞增殖及密度,判断肿瘤增殖速度及密度。当肿瘤直径增加后肿瘤区域呈现多种不同组织细胞,导致ADCDR值上升。因此分析MRI-DWI的ADC值有利于鉴别IDC、DCIS。
DWI是目前唯一能观察活体水分子的微观扩散运动能力的MRI检查方法[16],通过观察肿瘤病变区ADC值的测量能进行量化分析,从而对乳腺肿瘤病变性质进行评估。乳腺癌恶性肿瘤细胞活跃,生殖旺盛,细胞核增大,细胞密度较高且排列紧密,细胞间隙小,水分子扩散运动受限。目前被临床认可的b值为800~1000s/mm2,以ADC值1.2×10-3mm2/s作为阈值判断肿瘤细胞水分子扩散是否受限。联合ADCmin、ADCDR诊断IDC、DCIS能很好体现MR优越性,实现乳腺疾病多模态、多参数影像学诊断。本研究结果显示,联合ADCmin、ADCDR诊断AUC、约登指数、敏感度、特异度最高,有助于术前正确鉴别,从而帮助临床制定综合性治疗方案。
综上所述,MRI-DWI能提升对单纯乳腺导管原位癌、浸润性导管癌的鉴别于诊断价值,有利于临床制定针对性治疗方案。