耐镉邻苯二甲酸二辛酯降解菌的筛选及特性研究
刘标,喻孟元,王震,杜东霞,陈薇,许丽娟,吴迎奔,吴民熙,刘惠知,尹红梅
(湖南省微生物研究院,长沙 410009)
邻苯二甲酸酯(又称酞酸酯,Phthalic acid ester,PAEs),是塑料制品中常用的增塑剂,被普遍应用于玩具、化妆品、食品包装材料、医疗用具、建筑装饰等行业的数百种产品中[1],据统计,全世界每年的使用量达600 万~800 万t[2]。邻苯二甲酸酯在各种塑料制品中主要依靠氢键、范德华力结合在母体上,连接不牢固,易在塑料制品的生产、使用过程中释放到环境中[3-4]。目前在土壤、水体、水体沉积底泥,甚至动植物中都检测出邻苯二甲酸酯[5-9]。邻苯二甲酸酯是一类内分泌干扰物,在动物体中表现出类似性激素的作用,主要危害动物的呼吸、生殖系统。随着农业规模化的发展,农田土壤中邻苯二甲酸酯含量越来越高,对人类健康存在潜在的风险。目前邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二丁酯(DBP)、邻苯二甲酸二辛酯(DOP)、邻苯二甲酸丁基苄基酯(BBP)和邻苯二甲酸二(2-乙基己基)酯(DEHP)等6 种邻苯二甲酸酯被美国环境保护署、欧盟、中国国家环境监测中心列为优先控制有机污染物[10]。PAEs 在环境中的自然降解速率较慢,而添加PAEs 降解微生物可大幅提高其降解速率[11-12],同时,由于微生物降解技术具有价格低廉、易操作等优点,被认为是较有前景的修复技术之一,成为目前的研究热点。目前,已分离筛选到大量能够降解邻苯二甲酸酯的微生物菌株,如假单胞菌、戈登氏菌、节杆菌、镰刀菌、红球菌等[7,13-17],但大部分微生物菌株主要是以单一的邻苯二甲酸酯为降解对象而筛选获得的,而实际环境中往往存在多种复合污染物,因此,筛选出能够适应复合污染环境且具有PAEs降解功能的微生物菌株具有重要的研究意义和实用价值。
本研究以长侧链的DOP 为降解对象,筛选具有一定重金属镉耐受性的微生物降解菌株,并对菌株的降解特性进行研究,期望为重金属镉和DOP复合污染的农田土壤修复提供微生物资源和理论依据。
1 材料与方法
1.1 化学试剂
DMP、DBP、DEP、DOP、DEHP、PA(邻苯二甲酸)均购自国药试剂有限公司,纯度>99%;试验中其他化学试剂为分析纯,有机溶剂均为色谱级。
1.2 微生物来源及相关培养基
微生物分离样品为湖南省长沙市望城区和浏阳市采取的农田土壤。
含镉无机盐培养基(Mineral salt medium,MSM):K2HPO45.8 g·L-1,KH2PO44.5 g·L-1,(NH4)2SO42.0 g·L-1,NaCl 0.75 g·L-1,MgCl20.16 g·L-1,CaCl20.02 g·L-1,CdCl20.05 g·L-1,FeCl30.002 g·L-1,pH 7.0。
各底物培养基:在液体培养基中加入甲醇溶解的DMP、DBP、DEP、DOP、DEHP、PA母液,水浴加热使甲醇挥发,待甲醇完全挥发后再加入MSM 配制成所需浓度的各种底物培养基。
1.3 耐镉DOP高效降解微生物的分离筛选
称取土壤样品5 g 置于装有100 mL 含镉MSM 培养基的三角瓶中,MSM 培养基中添加终浓度为100 mg·L-1DOP 的甲醇溶液,待甲醇溶液挥发后,在30 ℃、180 r·min-1摇床中遮光振荡培养7 d,然后取1 mL 培养液转移到下一DOP 浓度的MSM 培养基中,在相同条件下继续培养7 d。以此相同步骤进行驯化培养,DOP 浓度分别为200、300、400、500、600 mg·L-1,共驯化6个周期,获取既耐镉又对DOP具有降解能力的菌液。通过稀释涂布平板法在固体MSM 培养基平板上筛选单菌落,并通过四分区划线法进一步纯化单菌落。将分离获得的各菌株在MSM 试管斜面上培养7 d,4 ℃低温保存待用。
1.4 初筛菌株对DOP降解能力的测定
将初筛获取的5 株菌株接种在MSM 培养基(DOP 500 mg·L-1)中,30 ℃、180 r·min-1活化培养24 h,离心收集菌体,MSM 液体培养基重悬各菌体,使菌液浓度OD600约为0.2,即为各菌株的种子液。分别接种1 mL 各菌株的种子液到初始DOP 浓度为500 mg·L-1的MSM 培养基中,30 ℃、180 r·min-1遮光培养,分别在第96、120 h 测定各培养液中剩余的DOP 含量,以不接种的空白培养基为对照,计算各菌株对DOP的降解率。
利用高效液相色谱法测定菌液中的DOP 含量,采用外标法定量,在选定的色谱条件下进样,以峰面积对DOP 浓度构建标准曲线。样品前处理方法:在培养液中加入50 mL 二氯甲烷萃取,收集有机相,重复萃取两次。将两次萃取液合在一起,在旋转蒸发仪上将二氯甲烷蒸发接近干燥,然后加入10 mL 甲醇溶解萃取物,经0.22 µm 有机相过滤器过滤后,用高效液相色谱仪(HPLC,Agilent公司)测定DOP含量。
HPLC 条件:色谱柱为Agilent Eclipse XDB-18(200 mm×4.6 mm,5 µm),流动相甲醇∶水=95∶5,进样量20 µL,柱温35 ℃,流速1 mL·min-1,检测波长228 nm。
1.5 高效降解菌PD-2的菌种鉴定
利用平板划线法在含DOP的MSM 平板上接种菌株PD-2,培养4 d后观察其菌落形态特征和显微形态特征。
菌株16S rDNA 序列分析:用Ezup 柱式细菌基因组DNA 提取试剂盒提取菌株PD-2的基因组DNA,采用通用引物27F 和1492R 进行16S rDNA 序列的扩增。PCR 反应条件:95 ℃预变性4 min;95 ℃,45 s;56 ℃,45 s;72 ℃,90 s,30 个循环;72 ℃延伸10 min,4 ℃终止。PCR 产物经1%琼脂糖凝胶电泳检测后,利用胶回收试剂盒纯化回收,委托上海生物工程有限公司测序。测得的序列在NCBI 数据库中进行Blast比对,通过Mega 5.0软件中Neighbor-joining方法构建系统发育进化树,确定该菌的分类地位。
1.6 菌株PD-2降解特性研究
1.6.1 菌株PD-2的生长曲线及降解动力学曲线
将PD-2 的种子液,按1%接种量(V/V)加至MSM液体培养基中,DOP 初始浓度为500 mg·L-1,30 ℃、180 r·min-1遮光振荡培养,分别在12、24、36、48、72、96、120、144 h 取样测定菌液的OD600和剩余的DOP 含量,每个处理重复3次。
1.6.2 不同初始DOP浓度对菌株PD-2降解能力的影响
在MSM 培养基中加入DOP 溶液,使其初始浓度分别为100、200、300、400、500、600、800、1 000、1 200 mg·L-1,按1%接种量接种PD-2 种子液,30℃、180 r·min-1遮光振荡培养4 d 后测定菌液中剩余的DOP 含量,以不接菌作为空白对照,计算第4 d的降解率。
1.6.3 菌株PD-2镉耐受能力测定
配制含镉浓度分别为100、200、400、600、800、1 000、1 500、2 000 mg·L-1MSM(DOP 初始浓度为500 mg·L-1)培养基,按1%接种量接种PD-2 种子液,30 ℃、180 r·min-1遮光振荡培养4 d 后测定菌液的OD600,每个处理重复3次,探究菌株对镉的耐受能力。
1.6.4 菌株PD-2对不同碳源底物的利用
在MSM 培养基中分别添加DMP、DBP、DEP、DEHP、PA、DOP 作为碳源底物,初始浓度均为500 mg·L-1,接种PD-2 后按相同条件培养4 d,测定各菌液的OD600,每个处理重复3 次,探究菌株对不同碳源的利用能力。
1.7 高效降解菌株在DOP污染土壤中的应用
试验所用土壤为农田水稻土(未检出DOP),参考《土壤农化分析》[18]中的方法测定理化性质:有机质19.8 g·kg-1,全氮0.68 g·kg-1,全磷0.84 g·kg-1,全钾5.78 g·kg-1,镉0.41 mg·kg-1,pH 6.53,土样经自然风干过20目筛后备用。将200 g 土壤置于500 mL 锥形瓶中,添加DOP 溶液,调节终浓度约为100 mg·kg-1,配制成人工污染土壤。接种PD-2 的种子液到土壤中,终浓度约为1.0×108CFU·g-1,以不接种的土壤为空白对照组,将锥形瓶放入30 ℃恒温培养箱避光培养,分别在0、5、10、15、20、25、30 d时取样测定剩余DOP含量。
土壤样品中DOP 含量的检测[19]:取土壤样品1.0 g 放入玻璃离心管中,加入30 mL 丙酮/己烷(V/V,1∶1)混合溶液,超声提取10 min,静置后收集有机相,重复以上步骤3 次,合并有机相,旋转蒸发近干后,加入5 mL 甲醇溶解(加标回收率约为93%)。将提取液过0.22 µm 有机相滤膜,过滤后转移至色谱瓶中,检测方法同1.4节。
1.8 数据分析
采用Excel 2003软件对3次平行实验的数据求平均值和标准差,并进行绘图,利用SPSS 18.0软件进行单因素方差(ANOVA)统计分析。
2 结果与讨论
2.1 耐镉DOP降解菌的筛选
随着化肥、农药和农用塑料地膜等生产物资的大量使用,我国农田土壤表现出越来越明显的复合污染,镉和邻苯二甲酸酯就是其中一种典型代表[20]。本研究通过选择培养基的富集、驯化,分离获得5 株既能耐受一定浓度的重金属镉,又能以DOP 为唯一碳源生长的细菌菌株。在初始DOP 浓度为500 mg·L-1的培养基中培养120 h 后,5 株菌株均对DOP 有较明显的降解作用。其中,菌株PD-2的降解率达到93.1%,显著高于其他菌株(表1),且该菌株在血平板上不产生溶血现象,因此,选择PD-2进行进一步研究。
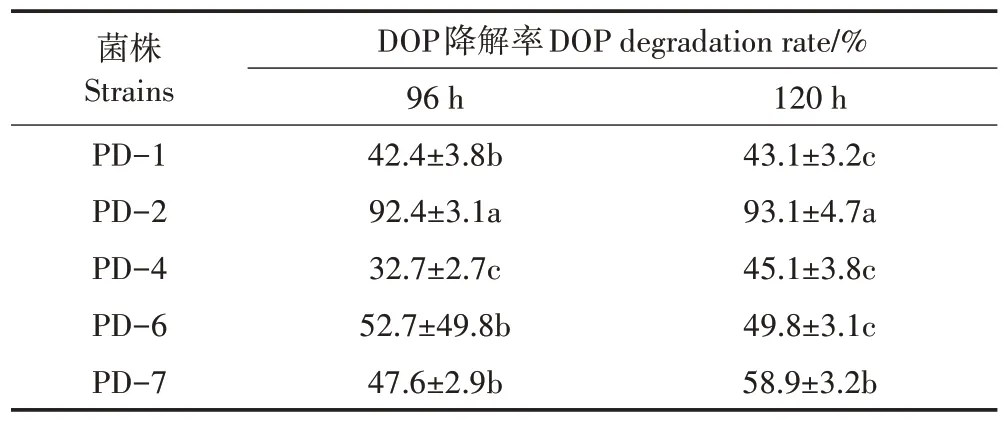
表1 不同菌株对DOP的降解能力Table 1 The ability of different strains on the DOP degradation
2.2 菌株PD-2的鉴定
菌株PD-2在含DOP的MSM固体培养基上形成的菌落较小,表面光滑、湿润,有光泽、不透明,边缘整齐。在油镜下,PD-2的菌体呈不规则的卵球形,单个或多个排列在一起,不形成芽孢,革兰氏染色阴性(图1)。

图1 菌株PD-2菌落形态及显微形态特征Figure 1 Colony morphology and micromorphological characteristics of strain PD-2
PCR 扩增获得PD-2 的16S rDNA 序列长度为1 380 bp(Genbank 登录号:MT071604),将其与NCBI数据库中已有序列进行同源性比对,菌株与Hyphomicrobium facile(NR_027610.1)有很高的相似性(99%),基于其16S rDNA 序列构建的系统发育树如图2 所示。结合菌株形态学特征和16S rDNA 序列分析的结果,初步将菌株PD-2 鉴定为生丝微菌。据报道,生丝微菌(Hyphomicrobiumsp.)主要用于合成吡咯喹啉醌[21]、降解甲胺磷、乙酰甲胺磷、水氨硫磷等农药[22],本研究为首次将生丝微菌应用于DOP 污染土壤修复。
2.3 菌株PD-2的生长曲线及其对DOP的降解效应

图2 菌株PD-2的系统发育树Figure 2 Phylogenetic tree of strain PD-2
如图3 所示,菌株PD-2 在0~36 h 生长较慢,培养基中的DOP 含量下降也较为缓慢,说明该菌株在含DOP 的环境中适应期较长。36~72 h 是菌株PD-2 的对数生长期,DOP的含量在此期间迅速降低。72 h后菌株进入稳定生长期,此时DOP 含量略有下降,第96 h 时DOP 下降至45.3 mg·L-1,降解率达到最大,为90.9%。96 h 以后进入衰退期,DOP 的含量不再有明显变化。结合菌株的生长及降解曲线可知,菌株对DOP的降解依赖于其生物量的增加,可能是因为菌株在DOP 的诱导下通过分泌酯酶、邻苯二甲酸降解相关酶[10]实现对DOP的降解,而酶的分泌与菌株的生长代谢密切相关。
2.4 PD-2对不同初始浓度DOP的降解效果
PD-2 对不同初始浓度DOP 的降解效果(图4)显示,当DOP 初始浓度低于800 mg·L-1时,4 d 内PD-2对DOP 的降解率均超过90%,说明菌株对DOP 具有较强的耐受性。当DOP 浓度继续提高时,降解率有较明显的下降,这一结果与韩蕊等[23]、杨婧等[24]报道的菌株降解PAEs 的特性类似,原因可能是高浓度的DOP会对PD-2的生长繁殖或相关酶的分泌产生不利影响,从而影响菌株对其分解利用。
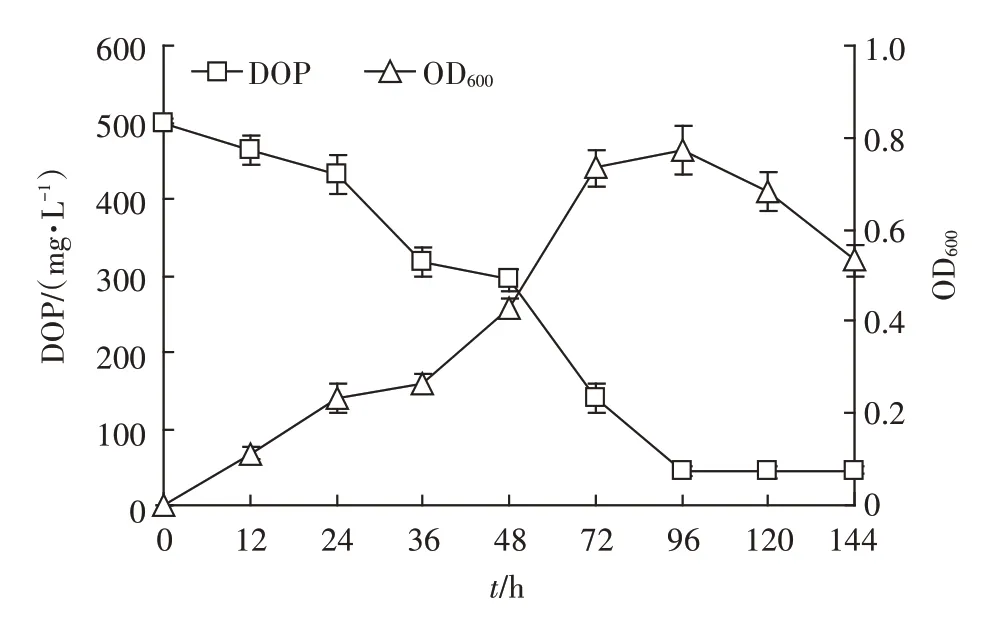
图3 菌株PD-2利用DOP的生长降解曲线Figure 3 The growth curve and DOP degradation curve of strain PD-2

图4 不同初始DOP浓度对PD-2降解能力的影响Figure 4 Effect of different initial DOP concentration on the biodegradation of PD-2
2.5 菌株PD-2的镉耐受性
如图5 所示,在镉浓度为0~600 mg·L-1时,菌株PD-2的生长均较好,且无显著差异,菌株具有相对较强的镉耐受性。随着培养基中镉浓度的增加,PD-2仍能生长,但生物量显著减少,说明高浓度的镉对菌株生长有一定抑制作用,在镉重度污染区菌株PD-2对DOP的修复效率会显著降低。
2.6 菌株PD-2对不同碳源底物的利用
培养4 d 后,菌株PD-2 在6 种底物液体培养基中均能生长,但生长状况不同。其在含短侧链酞酸酯底物(DMP、DEP、DBP)的培养基中生长较好,在长侧链酞酸酯底物(DEHP、DOP)的培养基中生长相对较慢(表2)。这一结果与先前报道的菌株寡养假单胞菌B3[25]、分枝杆菌ASW6D[24]、Gordoniasp.JDC-2[26]特性类似。在实际污染环境中往往是多种邻苯二甲酸酯类化合物并存,菌株PD-2不仅可降解DOP,还可利用其他种类的PAEs(表2),因此,该菌株在实际污染环境修复工程中具有潜在的应用价值。
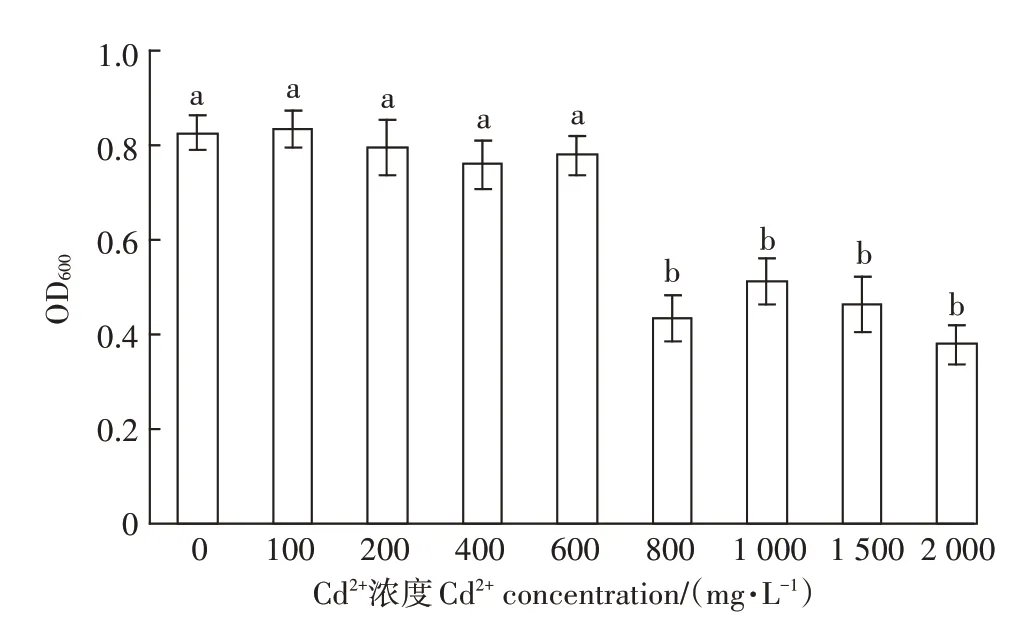
图5 镉浓度对菌株PD-2生长的影响Figure 5 Effect of Cd2+concentration on the growth of strain PD-2
2.7 菌株PD-2对土壤中DOP的降解效果
菌株PD-2在DOP污染土壤中降解效果如图6所示,接种菌剂PD-2 到土壤30 d 后,DOP 的去除率达64%,而未接种的对照组为14.8%,说明菌剂PD-2 可显著提高土壤中DOP 的去除率。添加菌剂PD-2 的处理组DOP 的降解在前5 d 较缓慢,第5~10 d 降解速度显著增加,10 d后降解速率又变得较为缓慢。原因可能是在接种菌剂前期,菌株PD-2 与土壤中土著微生物存在竞争关系,其生长代谢受到一定抑制;第5~10 d降解速率加快是因为PD-2在与土著微生物的竞争中逐渐占据优势;后期降解速率变慢可能是因为DOP在土壤中进入缓慢吸附阶段,其通过分配作用进入土壤微孔内或吸附在高能位点上,与土壤成分结合更加紧密,微生物对其降解也越困难[27]。
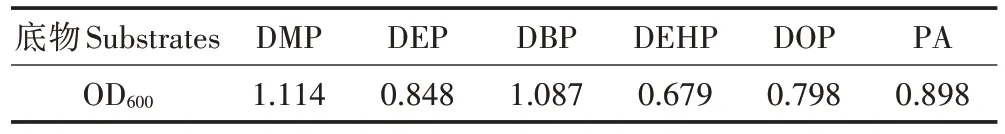
表2 菌株PD-2底物利用试验Table 2 The test of strain PD-2 using the substrates

图6 PD-2对污染土壤中DOP的降解效果Figure 6 Biodegradation of DOP by PD-2 in soil
3 结论
(1)从农田土壤中筛选出一株既耐受重金属镉又可高效降解利用DOP 的菌株PD-2,在DOP 初始浓度为500 mg·L-1的液体培养基中培养120 h 后,其对DOP 的降解率可达93.1%。综合菌株形态特征和16S rDNA 序列,将该菌鉴定为生丝微菌属(Hyphomicrobiumsp.),本研究首次将获得的生丝微菌用于降解土壤中DOP。
(2)菌株PD-2 对液体培养基中DOP 的降解依赖于其生物量的增加,其对DOP 的作用浓度和耐镉浓度范围广,可高效降解100~800 mg·L-1范围的DOP(降解率大于80%),在含镉浓度0~600 mg·L-1的培养基中生长良好。PD-2 可利用其他常见PAEs 和邻苯二甲酸作为底物生长,底物种类范围广。
(3)添加PD-2 到镉和DOP 复合污染土壤中,其对DOP 的降解作用显著,PD-2 在镉和DOP 复合污染土壤的修复方面具有潜在的应用价值。

