非洲猪瘟病毒荧光定量PCR的建立及4种检测试剂盒的比较
肖琦 蒋彩霞 史慧 赵霞玲 钱雯娴 朱家平 张冯禧 温立斌 汪伟 何孔旺


摘要:为评估目前常用商品化非洲猪瘟荧光定量PCR检测试剂盒,参考OIE推荐的非洲猪瘟病毒(ASFV)荧光定量PCR方法合成引物和探针,建立非洲猪瘟病毒qPCR检测方法(OIE-qPCR);并与市面4种ASFV检测试剂盒进行了比较。以人工合成的ASFV p72基因TA克隆重组质粒为阳性标准品,OIE-qPCR可以检测到10~102 copies;而4种ASFV荧光定量PCR检测试剂盒中,进口试剂盒TF-qPCR能检测到10 copies,进口试剂盒ID-qPCR和国产试剂盒QD-qPCR能检测到10~102 copies,而国产试剂盒LY-qPCR能检测到102 copies。对健康猪组织样及临床模拟样品的检测结果显示:OIE-qPCR与4种检测试剂盒之间的符合率为92.60%~99.03%。其中,阳性样品CT值的相关系数为0.988~0.997(Perason法),表明各试剂盒之间相关性良好;但在检测病毒核酸含量较低的样品时,各试剂盒结果之间存在一定差异,其中,TF-qPCR试剂盒显示更高的阳性检出率,ID-qPCR试剂盒和LY-qPCR试剂盒次之。本研究为临床选用非洲猪瘟病毒快速检测试剂盒提供了依据。
关键词:非洲猪瘟病毒;检测;荧光定量PCR;灵敏性;稳定性;敏感性
中图分类号:S852.65+1 文献标志码: A文章编号:1002-1302(2021)02-0119-06
收稿日期:2020-11-13
基金项目:江苏省现代农业(生猪)产业技术体系生物安全创新团队项目(编号:JATS[2019]403)。
作者简介:肖琦(1980—),女,辽宁丹东人,博士,助理研究员,主要从事猪病及人兽共患病防控研究。E-mail:xiaoqi_2122@163.com。
通信作者:何孔旺,研究员,主要从事猪病及人兽共患病防控研究。E-mail:kwh2003@263.net。
非洲猪瘟自从2018年8月在我国首次报道[1]以来,对我国养猪业造成了巨大的经济损失[2]。病原的快速检测在防控非洲猪瘟上发挥着十分重要的作用。实时荧光PCR因其特异性高、敏感性好,是目前应用最为广泛的非洲猪瘟检测技术[3]。市场上主流使用的试剂盒的品牌较多,既有国产品牌,也有进口品牌。在实际使用过程中,各种品牌非洲猪瘟病毒荧光定量PCR检测试剂盒的效果是否存在差异,相关报道较少。为了建立统一的参比方法,本研究参考OIE推荐的非洲猪瘟病毒荧光PCR方法[4]合成引物和探针,建立非洲猪瘟病毒qPCR(简称OIE-qPCR)检测方法,以人工合成的非洲猪瘟病毒p72蛋白基因TA克隆为阳性质粒标准品,以健康猪组织样及临床模拟样品作为检测对象,比较OIE-qPCR和4种临床常用的非洲猪瘟病毒荧光定量PCR检测试剂盒的灵敏性、稳定性、特异性,为临床检测非洲猪瘟病毒时的试剂盒选用提供参考依据。
1材料与方法
1.1仪器与试剂
QuantStudio 6 Flex实时荧光定量PCR系统,购自美国应用生物系统(ABI)公司;美国MP*FastPrep-24样品均质仪,购自美国MP公司。TIANDZ柱式动物DNAout试剂盒、柱式病毒DNAout试剂盒,购自北京天恩泽公司;TaKaRa Premix Ex TaqTM(Probe qPCR)、pMD19-T,购自宝生物工程(大连)有限公司。
1.2病毒株
猪圆环病毒2型p58株、猪伪狂犬病病毒Bartha-K61株、猪细小病毒NADL-2株、猪瘟病毒HCLV株、猪繁殖与呼吸综合征病毒NJGC、猪流行性腹泻病毒AH2012株,均由江苏省农业科学院兽医研究所保存。
1.3商品化非洲猪瘟病毒检测试剂盒
国产和进口的商品化非洲猪瘟病毒检测试剂盒各2种,共4种。国产试剂盒包括A公司非洲猪瘟病毒荧光PCR检测试剂盒(简称QD-qPCR试剂盒)、B公司非洲猪瘟病毒实时荧光PCR检测试剂盒(简称LY-qPCR试剂盒),进口试剂盒有C公司非洲猪瘟(ASF)qPCR检测试剂盒(TF-qPCR试剂盒)和D公司非洲猪瘟病毒DNA实时定量PCR检测试剂盒(ID-qPCR试剂盒)。所有试剂盒均在其有效期内使用。
1.4临床健康猪样品
1.4.1样品来源共33份样品。其中,猪脾脏、肝脏、肾脏、淋巴结等组织样品均来自江苏某菜市场,血清和唾液样品来自江苏某猪场。
1.4.2样品处理
1.4.2.1组织样品取100 mg组织样品(脾脏、肝脏、肾脏、淋巴结)置于无菌破碎管中,加入1 mL无菌PBS(pH值7.2)和3颗钢珠,在样品均质仪上匀浆处理,然后以12 000 r/min离心3 min,吸取上清200 μL,置于1.5 mL无菌离心管中,用于DNA提取。
1.4.2.2血清、唾液样品血清、唾液样品直接取上清200 μL,置于1.5 mL无菌离心管中,用于DNA提取。
1.4.3DNA提取组织样品用TIANDZ柱式动物DNAout试剂盒,按其说明书提取DNA;血清、唾液样品用TIANDZ柱式病毒DNAout試剂盒,按其说明书提取DNA。
1.5非洲猪瘟病毒p72阳性质粒标准品的制备
1.5.1非洲猪瘟病毒p72全长基因合成根据GenBank中已登录的非洲猪瘟病毒安徽株XCGQ(MK128995.1)序列,合成p72蛋白基因全长序列,长度1 941 bp,委托宝生物工程(大连)有限公司合成。置于-20 ℃保存。
1.5.2非洲猪瘟病毒p72全长基因质粒构建将人工合成的p72全长基因克隆至pMD19-T载体中,筛选获得阳性重组质粒,作为非洲猪瘟病毒p72基因核酸检测的阳性标准品。
1.6非洲猪瘟病毒qPCR(OIE-qPCR)检测方法的建立
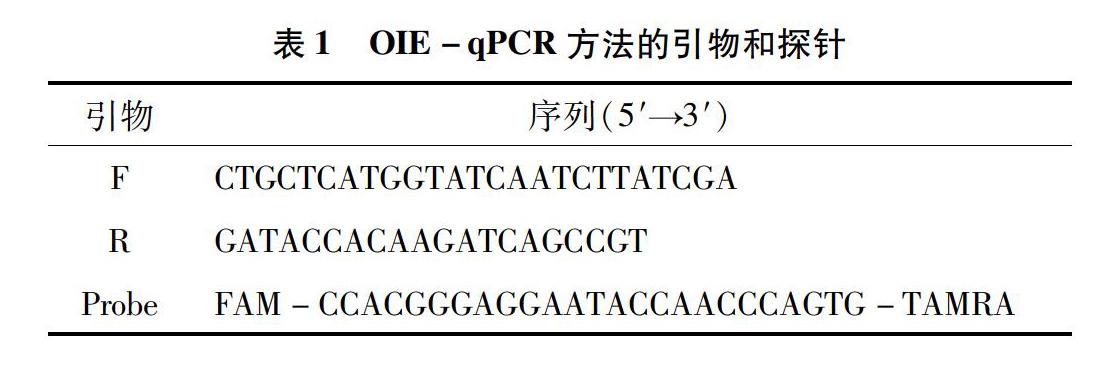
1.6.1引物和探针参照OIE推荐的非洲猪瘟病毒荧光定量PCR方法[4],合成引物和探针。引物和探针序列见表1,由宝生物工程(大连)有限公司合成。
1.6.2反应体系与反应条件参照OIE推荐的方法,OIE-qPCR反应体系为20 μL,其中水5.1 μL、Mix 10 μL、ROXⅡ 0.4 μL、上游引物(10 μmol/L)1 μL、下游引物(10 μmol/L)1 μL、探针(10 μmol/L)0.5 μL、DNA模板2 μL;qPCR反应程序为50 ℃ 120 s;95 ℃ 10 min;95 ℃ 15 s,58 ℃ 60 s,40个循环。
1.6.3结果判定标准阴性对照无CT值或无扩增曲线;阳性对照CT值≤35,并出现典型的扩增曲线,判为试验成立。检测样品CT值≤40,并出现典型的扩增曲线,判为阳性;检测样品无CT值或CT值>40,判为阴性。
1.6.4特异性试验按照“1.4.3”节的方法提取猪圆环病毒2型、猪伪狂犬病病毒、猪细小病毒、猪瘟病毒、猪繁殖与呼吸综合征病毒、猪流行性腹泻病毒核酸进行OIE-qPCR特异性试验。
1.7商品化非洲猪瘟病毒检测试剂盒检测方法
4种商品化非洲猪瘟病毒检测试剂盒均为荧光定量PCR方法,按照各试剂盒说明书的要求进行非洲猪瘟病毒核酸检测。各试剂盒的反应条件、结果判定标准等见表2。
1.8OIE-qPCR与4种商品化检测试剂盒的比较
1.8.1灵敏性试验将“1.5”节获得的非洲猪瘟病毒核酸阳性标准品p72全长基因重组质粒,用无菌ddH2O稀释至103、102、101、100 copies/μL,用于 OIE-qPCR 及各商品化检测试剂盒的灵敏度检验。
1.8.2重复性试验用OIE-qPCR及各商品化检测试剂盒分别检测稀释到103、102、101、100 copies/μL 的p72全长基因重组质粒样品,每个样品设3个重复。
1.8.3组织样品及模拟临床样品的检测比较用OIE-qPCR及4种商品化检测试剂盒检测33份正常猪组织样品和33份模拟临床样品(在阴性组织样品中加入不同浓度的p72全长基因重组质粒),比较各试验盒的检测符合率和相关系数。
2结果与分析
2.1OIE-qPCR检测方法的建立
用建立的OIE-qPCR检测方法,检测不同稀释度的非洲猪瘟病毒p72全长基因重组质粒,能出现典型的扩增曲线(图1);而检测猪圆环病毒2型、猪伪狂犬病病毒、猪细小病毒、猪瘟病毒、猪繁殖与呼吸综合征病毒、猪流行性腹泻病毒等,均没有出现扩增曲线。
2.2OIE-qPCR与4种商品化检测试剂盒灵敏性与稳定性试验
灵敏性试验结果表明:OIE-qPCR的灵敏度可以检测到101~102 copies;4种商品化非洲猪瘟病毒荧光定量PCR检测试剂盒中,有1种试剂盒(TF-qPCR)能检测到101 copies,有2种试剂盒(QD-qPCR和ID-qPCR)能检测到101~102 copies,有1种试剂盒(LY-qPCR)能检测到102 copies。
稳定性试验结果显示:OIE-qPCR与4种商品化检测试验盒,在检测103 copies和102 copies浓度的阳性标准质粒时均能100%检出;在檢测 100 copies 时,所有检测结果均为阴性;检测浓度为101 copies的阳性质粒时,TF-qPCR的阳性检出率为100%,OIE-qPCR与QD-qPCR、ID-qPCR的阳性检出率均只有33.3%,而LY-qPCR的阳性检出率为0%(表3)。
2.3OIE-qPCR与4种商品化检测试剂盒检测组织样品及临床模拟样品
用OIE-qPCR方法及4种商品化检测试剂盒检测33份临床健康猪组织样品及血清、唾液样品,结果均为阴性;检测33份临床模拟样品,结果出现一定差异(表4)。检测结果显示,OIE-qPCR方法检测为阳性的22份样品,4种商品化检测试剂盒的检测结果也均为阳性,且CT值之间均有良好的相关性,相关系数为0.988~0.997(PERASON法)。但用OIE-qPCR方法检测为阴性的样品中,有6份样品用4种商品化检测试剂盒分别检测出1份(QD-qPCR试剂)、3份(LY-qPCR试剂盒)、4份(TF-qPCR试剂盒)和3份(ID-qPCR试剂盒)阳性,提示在检测核酸含量处于临界值的临床样品时,TF-qPCR试剂盒的阳性检出率最高;在这6份检测结果有差异的样品中,仅1份样品被3种试剂盒同时检测为阳性,另有3份样品被2种试剂盒检测为阳性,其他2份样品均只有1种试剂盒检测为阳性,表明当样品中的非洲猪瘟病毒核酸含量较低时,各试剂盒的检测结果存在一定的差异。此外,将用OIE-qPCR方法及4种商品化试剂盒检测的CT值在30以上的14份样品进行相关性比对时,相关系数为0.503~0.952,进一步表明当样品中的非洲猪瘟病毒核酸含量较低时,各试剂盒的检测结果存在一定的差异。统计结果显示,OIE-qPCR方法与4种商品化检测试剂盒之间检测结果的符合率为92.60%~99.03%(表5)。
3讨论
非洲猪瘟最早于1921年在非洲肯尼亚被报告[5-6],属于重大动物疫病,猪一旦发病,死亡率可高达100%,给世界养猪业造成了巨大的经济损失。但迄今为止,全球还没有安全、有效的非洲猪瘟商品化疫苗和药物,非洲猪瘟的防控主要依赖于严格的生物安全措施。
2018年8月我国首次报道非洲猪瘟疫情以来,经过2年多的艰苦努力,我国非洲猪瘟防控工作取得了积极的成效,但是非洲猪瘟病毒已在我国定植,污染面较大,疫情点状发生的态势将在较长时期内存在[7]。因此,迫切需要能够在感染早期快速检测出非洲猪瘟病毒的技术,及时发现非洲猪瘟病毒感染猪,及时扑灭疫情。我国农业农村部在2020年5月印发的2020年第二版《非洲猪瘟疫情应急实施方案》中明确规定:具备良好生物安全防护水平的规模猪场,在出现非洲猪瘟疫情时,可以仅将发病猪舍作为疫点进行处理;猪场在自检时发现非洲猪瘟阳性猪,也只需要扑杀阳性猪及其同群猪,而对其余猪群在隔离观察21 d无异常且检测为阴性的情况下,可以就近屠宰或继续饲养。这一政策的出台和调整,为规模猪场及时筛查和发现非洲猪瘟阳性猪,精准清除非洲猪瘟感染猪,保障猪群安全提供了政策保障,同时也对非洲猪瘟病毒检测及筛查技术提出了更高的要求。
非洲猪瘟病毒常见的检测技术包括检测抗原的ELISA方法[8]、荧光抗体试验[9]和试纸条检测法[10],以及检测非洲猪瘟病毒核酸的PCR方法[11]、实时荧光PCR法[12-16]和等温扩增技术[17]等。2019年6月11日,中国动物疾病预防控制中心公布了通过专家评审的第二批非洲猪瘟现场快速检测试剂名单,其中一共有34种试剂,全部为核酸检测类,包括荧光定量PCR类28种和等温扩增类6种。但从实际应用情况来看,荧光定量PCR检测试剂盒应用最为广泛,但目前,对多种非洲猪瘟病毒荧光定量PCR检测试剂盒的敏感性、特异性及稳定性等尚缺乏较为系统的比较。
由于现有的非洲猪瘟病毒荧光定量PCR检测试剂盒多数参照OIE推荐的以p72基因为靶标的荧光定量PCR(OIE-qPCR)方法研制,所以我们以OIE-qPCR方法为参照,对临床常用的4种商品化非洲猪瘟病毒核酸qPCR检测试剂盒进行评估。结果表明,OIE-qPCR方法与市面上使用较多的4种商品化非洲猪瘟病毒qPCR检测试剂盒的符合率为92.60%~99.03%,在检测临床模拟强阳性样品时,各试剂盒的检测结果之间均具有良好的相关性;因此,在临床检测和诊断中,尤其是在检测已明显表现出非洲猪瘟临床症状的病死猪样品时,由于样品中非洲猪瘟病毒核酸含量较高,所以几种试剂盒均可以达到检测要求。但是,在检测非洲猪瘟病毒核酸含量较低的样品(10~100 copies)時,OIE-qPCR方法与4种商品化试剂盒的检测结果之间存在一定差异,仅进口的TF-qPCR试剂盒能稳定检测到10 copies,进口的ID-qPCR和国产的QD-qPCR以及OIE-qPCR的检出范围为10~102 copies,而另一种国产试剂盒LY-qPCR仅能检测到102 copies。在6份检测结果不一致的临床模拟样品中,进口的TF-qPCR检测出4份阳性样品,ID-qPCR和LY-qPCR各检测出3份阳性样品,而QD-qPCR只检测出1份阳性样品;而且,各试剂盒检出的阳性样品之间,重合率非常低,仅有1份样品同时被3种试剂盒检测为阳性,另有2份样品同时被2种试剂盒检测为阳性,其他3份样品均只有1种试剂盒检测为阳性,表明在非洲猪瘟病毒核酸含量较低时,各试剂盒检测的结果会出现较为明显的差异。提示在临床筛查时,一是尽量选择敏感度高的试剂盒,二是当样品CT值在35或35以上时,以及在没有CT值时,需要慎重判定结果,必要时可用不同的试剂盒重复检测,或对猪群连续采样监测。
上述结果也提示,目前的非洲猪瘟病毒荧光定量PCR方法虽然敏感度较高、特异性强,但用于检测拷贝量低的核酸样品时(如未出现临床症状的猪,或病毒感染早期的猪),还存在一定的局限。由于非洲猪瘟病毒在自然感染后的潜伏期为4~9 d,这也是早期诊断、早期精准清除的关键时期,但由于在潜伏期内,感染猪的排毒量通常比较低,因此,需要进一步提高非洲猪瘟检测试剂盒的敏感度,以便能够尽早筛查出可能感染的猪,实现早期精准清除。
参考文献:
[1]Zhou X,Li N,Luo Y,et al. Emergence of African swine fever in China,2018[J/OL]. Transboundary and Emerging Diseases,2018 Aug 13.doi:10.1111/tbed.12989.[Epub ahead of print]
[2]Woonwong Y,do Tien D,Thanawongnuwech R. The Future Of The Pig Industry After The Introduction of African swine fever into Asia[J]. Animal Frontier,2020,10(4):30-37.
[3]张丽,罗玉子,王涛,等. 非洲猪瘟诊断技术发展现状与需求分析[J]. 中国农业科技导报,2019,21(9):1-11.
[4]于康震,张仲秋,冯忠武,等. OIE陆生动物诊断试验与疫苗手册(哺乳动物、禽类与蜜蜂)下卷[M]. 7版.世界动物卫生组织(OIE),2012:1198.
[5]Beltran A D,Aris M,Gallardo C,et al. 非洲猪瘟:发现与诊断-兽医指导手册[M]. 罗马:联合国粮食及农业组织(FAO),2018:7.
[6]Montgomery R E. On a form of swine fever occurring in British East Africa(Kenya Colony)[J]. Journal of Comparative Pathology and Therapeutics,1921,34:159-191.
[7]农业农村部. 农业农村部回应非洲猪瘟疫情防控情况[J]. 北方牧业,2020(21):16.
[8]Wardley R C,Hamilton F,Wilkinson P J. The replication of virulent and attenuated strains of African swine fever virus in porcine macrophages[J]. Archives of Virology,1979,61(3):217-225.
[9]Bool P,Ordas A,Sachez-Botija C. El diagnostico de la peste porcina African por immunofluorescencia[J]. Bullutin of International Epizoot,1969,72:819-839.
[10]吴海涛,成大荣,吴萌,等. 非洲猪瘟病毒胶体金免疫层析试纸条的研制[J]. 黑龙江畜牧兽医,2018(17):126-128,238.
[11]Agüero M,Fernández J,Romero L,et al. Highly sensitive PCR assay for routine diagnosis of African swine fever virus in clinical samples[J]. Journal of Clinial Microbiology,2003,41(9):4431-4434.
[12]King D P,Reid S M,Hutchings G H,et al.Development of a TaqMan PCR assay with internal amplification control for the detection of African swine fever virus [J]. Journal of Virological Methods,2003,107(1):53-61.
[13]李维彬,蒋正军,王玉炯,等. 非洲猪瘟病毒TaqMan探针实时荧光定量PCR检测方法的建立[J]. 宁夏大学学报(自然科学版),2007,28(1):56-59.
[14]张泉,朱鸿飞,孙怀昌. 非洲猪瘟病毒常规PCR及Real-time PCR检测方法的建立[J]. 中国预防兽医学报,2007,29(6):458-460.
[15]吴亚楠,朱潇静,周博伦,等.非洲猪瘟病毒TaqMan荧光定量PCR检测方法的建立[J]. 中国兽医学报,2020,40(5):888-891,896.
[16]杜楠楠,高飞,姜一峰,等. 非洲猪瘟TaqMan实时荧光定量PCR检测方法的建立与应用[J]. 中国兽医科学,2020,50(4):423-429.
[17]王建昌,王金凤,刘立兵,等.非洲猪瘟病毒RPA等温检测方法的建立[J]. 中国动物检疫,2016,33(7):78-81,94.吕孙建,袁雪梅,张海琪,等. 凡纳滨对虾养殖期间水体及肠道菌群变化研究[J]. 江苏农业科学,2021,49(2):125-131.

