张良姜同源四倍体诱导
姚鹏强 袁轶 程世平


摘要:为解决张良姜繁殖系数低、容易感染病菌的问题,进一步加快张良姜育种进程,以河南省鲁山县张良镇种姜为材料,首先建立张良姜茎尖离体培养再生体系,进一步利用秋水仙碱对其体细胞染色体进行诱导加倍。结果表明,张良姜茎尖不定芽诱导的最适培养基为MS+6-BA 2.0 mg/L+NAA 01 mg/L,不定芽诱导率达83.33%。不定芽生根的最适培养基为1/2 MS+NAA 0.5 mg/L,生根率可达86.67%。张良姜同源四倍体诱导最佳处理组合为100 mg/L秋水仙碱浸泡茎尖72 h再接种培养,四倍体最高诱导率为8.89%。对照组张良姜为二倍体(2n=2x=22),诱导获得的四倍体张良姜染色体为2n=4x=44。共获得7个四倍体植株,继代培养3次后倍性保持稳定,可为张良姜良种选育提供良好的原始材料。
关键词:张良姜;离体培养;染色体加倍;同源四倍体
中图分类号:S632.503 文献标志码: A文章编号:1002-1302(2021)02-0104-04
收稿日期:2020-05-19
基金项目:平顶山学院高层次人才科研启动项目(编号:BXY-BSQD-2018031、PXY-BSQD2016009);河南省科技攻关计划(编号:182102110132、172102110111、)。
作者简介:姚鹏强(1986—),男,云南曲靖人,博士,讲师,主要研究方向为植物多倍体遗传育种。E-mail:yaopengqiang1988@163.com。
张良姜为姜科姜属多年生草本植物[1-4],原产于河南省鲁山县张良镇,距今已有2 200多年的种植历史。2010年5月,张良姜被授予国家农产品地理标志登记保护,是全国首个获得农产品地理标志登记保护的生姜产品,享有姜中之王的美誉[5],其色泽金黄、久煮不烂、辛辣芳香[6],是集调味品、食品加工原料、药用于一体的多用途经济作物[7-9]。
长期以来,张良姜主要利用地下块根进行无性繁殖,伴随一些病毒病菌经常导致产量和品质的下降,并且长期无性繁殖会造成种性退化[10-11]。植物组织培养脱毒技术是提高姜产量和品质最为有效的方法之一[12-14]。因此,有必要通过组织培养技术对现有优良张良姜进行脱毒和复壮,提高品种自身抗逆性和增产潜力。
目前,张良姜育种还处于起步阶段,其雌雄花败育,常规杂交育种难以发挥作用。然而,在组织培养的基础上,利用体细胞染色体加倍技术来获取多倍体具有巨大的育种价值。许多研究表明,多倍体植物在育种方面具有生活能力强以及抗病虫害等特点[15-18]。本研究以张良姜幼嫩芽为外植体,首先建立其离体培养再生体系,之后通过秋水仙碱诱导其体细胞染色体加倍,获得张良姜同源四倍体。此研究旨在推动张良姜产业发展,以期培育张良姜新品种。
1材料与方法
1.1试验材料
选择健壮、无病的张良种姜为材料。试验在河南省平顶山学院化学与环境工程学院低山丘陵重点实验室,于2017年4月至2019年5月份进行。
1.2初代培养基配制
初代培养基配制以MS为基础培养基,分别添加不同浓度的NAA(萘乙酸)、6-BA(6-苄氨基嘌呤),具体激素组合见表1,处理编号依次记为M1~M4。所配制的4个培养基配方处理中蔗糖浓度为3%,琼脂浓度为0.75%,pH值范围为5.6~5.8。每个培养基配制30瓶。
1.3外植体消毒与接种
对张良姜种姜进行催芽处理,将未发芽的姜块放入铁托盘,喷洒适量水,盖上塑料膜,25 ℃下培养催芽。待芽长出1 cm左右,用手术刀切取幼芽,首先用70%乙醇处理1 min,无菌水冲洗2~3次,再用0.1%氯化汞消毒12~15 min,无菌水冲洗3次,去除幼芽外層2~3层幼叶,将茎尖接种于培养基,每瓶接种1个外植体。放入培养室中培养,培养温度为(25±1) ℃,光照度为2 000~3 000 lx,培养 30 d 后观察统计愈伤组织及不定芽数量。
1.4生根培养
选取2~3 cm生长状态相同的单个丛生芽,分别接种于添加不同浓度6-BA(0.5、1.0 mg/L)或NAA(0.5、1.0 mg/L)以及不添加激素的9种生根培养基(K0~K8)中进行生根培养,20 d后统计生根率。每个培养基接种1个芽,每种培养基接种15个丛生芽,重复3次。
1.5秋水仙碱诱导张良姜体细胞染色体加倍
分别配制浓度为50、100、150、200 mg/L的秋水仙碱溶液,用无菌过滤器过滤。选取健壮的组培苗,将其顶芽及带有侧芽的茎段切下,分别放入不同浓度的秋水仙碱溶液中。黑暗环境下,在振荡培养箱中分别培养24、48、72、96 h。之后用无菌水冲洗材料4~5次,用无菌滤纸将材料表面水分吸干,将材料接种到继代培养基上培养。每个处理组合重复3次,每个重复分5瓶,每瓶接种3个材料。20 d 后统计外植体存活率。
1.6倍性鉴定
取第3次继代培养的幼苗嫩叶,利用流式细胞仪(sysmex partec GmbH)进行检测,取幼嫩叶片约 1 cm2 大小放入一次性塑料皿中,加入200 μL细胞裂解液[希森美康生物科技(无锡)有限公司],然后用锋利的刀片迅速将其切碎,30 μm孔径滤网过滤,加入800 μL DAPI染色液[希森美康生物科技(无锡)有限公司],以二倍体材料为内参进行倍性检测。
之后,利用流式细胞仪检测的植株进行染色体压片计数进一步确定倍性水平。以张良姜组培苗幼嫩根尖为材料。饱和对二氯苯中预处理3 h,经蒸馏水冲洗后,置于卡诺固定液(V无水乙醇 ∶V冰醋酸= 3 ∶1),4 ℃固定24 h。之后,将材料转移到1 mol/L盐酸溶液中酸解10~15 min,蒸馏水冲洗并浸泡 10 min。取少量材料置于载玻片上,滴加卡宝品红染色液染色5 min,盖上盖玻片,压片,置于显微镜下观察计数。
2结果与分析
2.1初代培养基的筛选
不同初代培养基诱导张良姜不定芽效果如表2所示,在NAA浓度相同的情况下,添加不同浓度的6-BA进行不定芽的诱导,其中,以M3组合最好,不定芽诱导率达83.3%,即张良姜茎尖再生较适合培养基为MS+6-BA 2.0 mg/L+NAA 0.1 mg/L。
2.2不同培养基对张良姜生根的影响
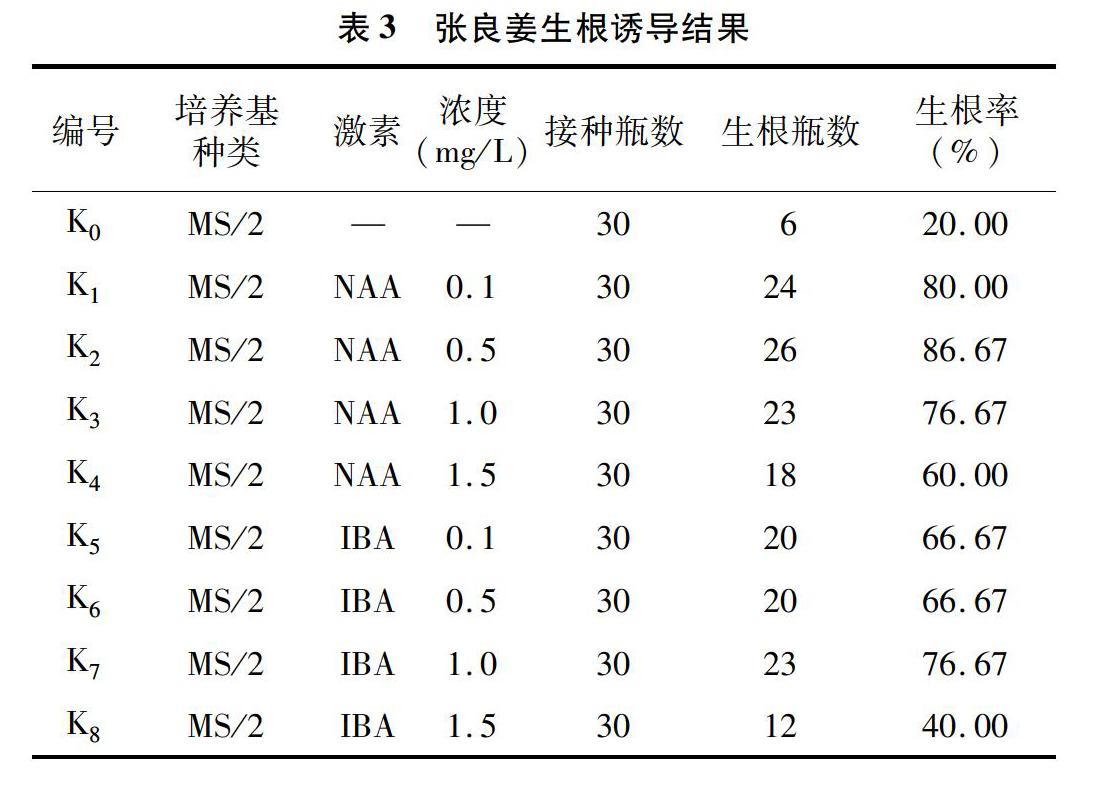
由表3可以看出,在生根培养基中,生根效果最差的培养基为K0,即不添加植物激素的MS/2培养基,在添加NAA或IBA之后,各个处理的生根率都有不同程度的提高。总体来看,NAA和IBA 2种激素在诱导生根效果方面存在一定差异。在相同浓度下,添加NAA比 IBA的生根效果更佳。其中,NAA的浓度为0.5 mg/L最适合丛生芽生根,生根率可达86.67%。因此,MS/2+NAA 0.5 mg/L为诱导张良姜丛生芽生根的最适培养基。
2.3张良姜同源四倍体诱导
对诱导获得的张良姜植株进行倍性鉴定。四倍体张良姜的峰值在横坐标上是内参二倍体的2倍(图1-a)。染色体压片计数结果表明,未经处理的二倍体张良姜染色体数为2n=2=22(图1-b),诱导获得的四倍体染色体数为2n=4x=44(图1-c)。
不同浓度的秋水仙碱以及不同的处理时间对张良姜外植体存活率、不定芽的诱导率以及四倍体诱导率的影响结果如表4所示。结果表明,外植体的存活数随着秋水仙碱浓度的增加以及处理时间的增加而降低,秋水仙碱浓度在50~200 mg/L范围,持续处理时间在96 h内,均有不定芽的产生。当秋水仙碱浓度为100 mg/L、处理72 h时,诱导获得张良姜同源四倍体4个,是本试验筛选的最优处理組合。
3讨论与结论
利用组培技术,可以实现张良姜脱毒种苗的快速繁殖。一些研究表明,NAA和6-BA的组合能够更好地促进生姜幼芽的分化和增殖[19-20]。总的来说,培养基中植物激素的成分和浓度对张良姜快繁有显著的影响。通过试验可以发现,在NAA浓度相同的情况下,当添加的6-BA浓度由0.5 mg/L逐渐增加到2.0 mg/L时,不定芽的分化率增高,但当6-BA浓度增加到3.0 mg/L时,不定芽的分化率开始下降,出现了一定的畸形芽。齐兰等在研究海南小黄姜脱毒快繁技术时也发现,当6-BA的浓度高于3 mg/L时,可能会导致畸形苗及弱苗的增多[21]。由此认为,当6-BA的浓度为2.0 mg/L时,张良姜不定芽的诱导效果较好。
张良姜不定芽生根诱导,其最适宜培养基为 1/2 MS+NAA 0.5 mg/L,本试验中添加外源激素NAA和IBA均可诱导张良姜不定芽生根,其中添加NAA的效果好于添加IBA,与黄姜的根诱导情况[19]类似。在生姜的研究中,同时添加6-BA和NAA可以实现生姜增殖与生根诱导同步进行,其中NAA对生根数和平均根长有较大影响,6-BA对生姜生根数和长度无显著影响[11]。小黄姜的脱毒组培技术研究也表明,同时添加6-BA和NAA可使生根壮苗和继代增殖同步完成[21-22]。而在本研究中,在所使用的初代培养基培养下,有部分不定芽有根的分化,生根率远低于加入NAA的生根培养基。因此,对于张良姜而言,将不定芽的诱导和生根诱导分别进行效果更佳。
秋水仙碱是人工诱导植物多倍体最为常用的化学试剂之一,成功的关键在于秋水仙碱的处理浓度及处理时间[23-25]。在本研究中,以秋水仙碱浓度100 mg/L处理72 h效果最好,其次是150 mg/L处理72 h,较低的秋水仙碱浓度如50 mg/L并未获得多倍体。而郭启高等对生姜进行多倍体诱导结果表明,在培养基中加入30 mg/L秋水仙碱处理5 d可使生姜的诱变率达到65.0%[26]。说明使用较低浓度秋水仙碱处理时须延长处理时间方能发挥作用。另外,有效的药剂浓度与诱导处理方式也有很大关系。利用秋水仙碱对姜芽进行浸泡后再接种所使用的浓度通常比直接在培养基中加入进行接种的浓度要高许多[26-27],如曾杨等对脱毒生姜进行四倍体诱导研究表明,0.2%秋水仙碱浸泡生姜芽12 h的诱导率最高[28]。通过对张良姜顶芽及带有侧芽的茎段进行秋水仙碱处理诱导获得同源四倍体植株,可为张良姜良种的选育提供原始材料,为后续筛选优良品系奠定基础。
参考文献:
[1]周明,李伟,韦玉霞,等. 高光强度下蔗糖浓度对姜试管苗生长及相关生理特性的影响[J]. 西北农业学报,2007,16(5):171-174.
[2]White B. Ginger:an overview[J]. American Family Physician,2007,75(11):1689-1691.
[3]Shukla Y,Singh M. Cancer preventive properties of ginger:a brief review[J]. Food and Chemical Toxicology,2007,45(5):683-690.
[4]Mao Q Q,Xu X Y,Cao S Y,et al. Bioactive compounds and bioactivities of ginger (Zingiber officinale Roscoe)[J]. Foods,2019,8(6):185.
[5]曹霞,谷长兴. 优质高产生姜——张良姜[J]. 农村百事通,2011(9):33.
[6]张伟,尹守恒,马培芳,等. 张良姜无菌组织培养快繁体系建立[J]. 农业科技通讯,2019(8):370-371.
[7]尚小红,周生茂,文俊丽,等. 生姜组织培养的影响因子[J]. 北方园艺,2012(1):173-176.
[8]Choi J G,Kim S Y,Jeong M,et al. Pharmacotherapeutic potential of ginger and its compounds in age-related neurological disorders[J]. Pharmacology & Therapeutics,2018,182:56-69.
[9]徐丝羽,王广期,何琪,等. 植物激素调控姜组织培养的研究进展[J]. 现代农业科技,2019(2):81,86.
[10]Kasilingam T,Raman G,Sundramoorthy N D,et al. A review on in vitro regeneration of ginger:tips and highlights[J]. European Journal of Medicinal Plants,2018,23(3):1-8.
[11]李晓波,贾笑英,李子敏,等. 生姜组培快繁技术研究[J]. 热带农业科学,2018,38(10):42-45.
[12]葛胜娟,平培元,徐美铃,等. 不同苗质及移栽条件对新丰生姜组培苗成活率的影响[J]. 中国农学通报,2003,19(4):54-56.
[13]Mengs B. Control of contamination and explants phenolics in ginger accession (Zingiber officinale Rosc.) in vitro cultures[J]. Journal of Biology,Agriculture and Healthcare,2018,8(9):54-58.
[14]Bamon M,Majumder D,Thakuria D,et al. In vitro efficacy of bacterial endophytes against Pythium sp. causing soft rot of ginger in Meghalaya[J]. Int J Curr Microbiol App Sci,2018,7(8):367-374.
[15]Jackson R C. Evolution and systematic significance of polyploidy[J]. Annual Review of Ecology and Systematics,1976,7(1):209-234.
[16]康向陽,王君. 杨树多倍体诱导技术研究[M]. 北京:科学出版社,2010:2-3.
[17]Dewitte A,van Laere K,Van H J. Use of 2n gametes in plant breeding[M]. Shanghai:Intech Press,2012.
[18]Sattler M C,Carvalho C R,Clarindo W R. The polyploidy and its key role in plant breeding[J]. Planta,2016,243(2):281-296.
[19]黄昌武,刘丰国,王光俊,等. 黄姜组织培养快速繁殖技术研究[J]. 湖北农业科学,2002(2):70-71.
[20]黄明. 贵州小黄姜的脱毒快繁技术的研究[D]. 贵阳:贵州大学,2016.
[21]齐兰,朱红林,陈健晓,等. 海南小黄姜脱毒快繁技术研究[J]. 热带农业科学,2013,33(9):37-40.
[22]杨松宸,赵德刚,赵懿琛. 六盘水小黄姜脱毒快速繁殖技术及遗传变异研究[J]. 分子育种,2017,15(12):5070-5078.
[23]Oliveros-Bastidas A,Chinchilla N,Molinillo J,et al. Qualitative study on the production of the allelochemicals benzoxazinones by inducing polyploidy in gramineae with colchicine[J]. Journal of Agricultural and Food Chemistry,2018,66(14):3666-3674.
[24]Huy N P,Luan V Q,Tung H T,et al. In vitro polyploid induction of Paphiopedilum villosum using colchicine[J]. Scientia Horticulturae,2019,252:283-290.
[25]方庆. 不同秋水仙素处理对石榴种子发芽及幼苗生长的影响[J]. 江苏农业科学,2019,47(19):142-144.
[26]郭启高,张钟灵,周虹,等. 秋水仙碱诱导生姜多倍体的研究[J]. 西南农业大学学报,2000,22(5):400-402.
[27]尚春华,李庆芝,王教义,等. 生姜多倍体诱变技术方法的建立[J]. 中国果菜,2017,37(9):73-75.
[28]曾杨,高山林,王蔚,等. 脱病毒生姜同源四倍体的诱导和鉴定[J]. 药物生物技术,2006,13(5):338-342.里程辉,于辉,吕德国,等. 干湿交替下不同中间砧对岳冠苹果叶片光合特性及叶绿素荧光特性的影响[J]. 江苏农业科学,2021,49(2):108-114.

