大豆蛋白肽-玉米淀粉复合物的制备及其性质研究
赵德厚,郝 帅,朱智杰,杜先锋
大豆蛋白肽-玉米淀粉复合物的制备及其性质研究
赵德厚,郝 帅,朱智杰,杜先锋*
(安徽农业大学茶与食品科技学院,安徽省农产品加工工程实验室,合肥 230036)
以玉米淀粉为原料,采用了压热-酶法并加入一定量的大豆蛋白肽(5%、10%、15%和20%,)制备了大豆蛋白肽-玉米淀粉复合物,研究了复合物的理化性质和体外消化性。结果表明,玉米淀粉颗粒为椭球形或多棱角形,而复合物形貌受到了严重的破坏,为大小不一的片状结构。复合物红外光谱的-OH向低波数处移动,说明和玉米淀粉相比,复合物分子的有序性升高。玉米淀粉的结晶结构为A型,经过压热-酶处理后的复合物结晶结构发生了明显改变,变为B+V型结构。复合物的熔融温度最高为126.81 ℃,说明复合物的崩解温度很高,结晶结构紧密并且热稳定性更高。复合物的体外消化性显著降低,抗性淀粉含量大幅提高,并且随着大豆肽添加量的增加抗酶解性逐渐升高。大豆蛋白肽与淀粉之间主要的相互作用力为氢键,相互作用产生的复合物性质发生了很大的改变,对其特性进行研究可以为在食品领域的应用提供理论依据。
玉米淀粉;大豆蛋白肽;复合物;抗性淀粉;相互作用力
淀粉是一种天然的高分子聚合物,由直链淀粉和支链淀粉组成,广泛存在于谷物、豆类、薯类和块茎等高等植物中[1]。我国产量最大的淀粉种类是玉米淀粉,产量远高于其他淀粉,我国已经成为仅次于美国的全球第二大玉米淀粉生产国家[2]。玉米淀粉近年来被广泛应用于食品、制药、纺织以及化妆品行业[3]。淀粉按其在人体内的消化速率可以分为3类:快消化淀粉(RDS)、慢消化淀粉(SDS)和抗性淀粉(RS)[4]。RS3(回生淀粉)具有很好的抗酶解性、热稳定性和安全性,是目前研究最广泛的一类抗性淀粉[5]。目前制备RS3的主要方法有:压热处理、超声波处理、酸水解、湿热处理、微波辐射、酶解处理等[6]。
近年研究发现,无机盐类、多酚、脂肪酸和多肽可以与淀粉分子之间发生相互作用,两者可以通过静电相互作用、范德华力、疏水相互作用和氢键等分子间作用力发生结合,能够改变淀粉的理化性质和体外消化性[7-8]。Zeng等[9]研究发现,压热-酶法处理可以有效地破坏淀粉的分子结构,减小淀粉分子的分子量,对RS3的形成有很大的促进作用,是一种新型制备RS3的方法。刘成龙等[10]研究发现,蛋白质可以与淀粉之间发生酯化反应,能够改变淀粉的晶型结构,并提高了淀粉的热稳定性,改变了淀粉的糊化和流变性质。蛋白质与多肽还是影响淀粉消化特性的重要因素,Oñate Narciso等[8]研究发现,不同添加量的豌豆蛋白对大米淀粉的消化性影响不同,随着添加量的增加,大米的慢消化淀粉和抗性淀粉的含量均有提高,由于多肽分子量远小于蛋白质,所以更容易与淀粉分子间发生相互作用。付田田等[7]研究了谷物蛋白和谷物蛋白肽对大米淀粉消化性的影响,结果表明谷物蛋白和谷物蛋白肽均能降低大米淀粉的消化性,但谷物蛋白肽的作用明显高于谷物蛋白。
大豆蛋白肽是植物肽中唯一的氨基酸种类搭配均匀的多肽,在人体内很容易被消化吸收,具有非常高的营养价值[11]。作者采用压热-酶法制备大豆蛋白肽-玉米淀粉复合物,并对其性质进行研究,以期丰富淀粉与多肽的相互作用理论,为开发限制碳水化合物的饮食和以蛋白质为基础的功能食品提供基础。
1 材料与方法
1.1 材料
玉米淀粉(食品级),四川友嘉食品有限公司;大豆蛋白肽(食品级),中食都庆生物技术有限公司;冰醋酸,国药集团化学试剂有限公司;普鲁兰酶 (1 000 U·g-1),美国MACKLIN公司;α-淀粉酶 (4 000 U·g-1),美国sigma公司;糖化酶(10万U·g-1),美国sigma公司;尿素,阿拉丁有限公司;氯化钠,国药集团化学试剂有限公司;二硫苏糖醇,安耐吉化学有限公司。
1.2 仪器与设备
手提式压力高压灭菌锅,上海申安有限公司;ZD-85A气浴恒温恒速振荡器,江苏金坛市金城国胜实验仪器厂;UV-2102C 型紫外可见分光光度计,尤尼柯(上海)仪器有限公司;Christ Gamma冷冻干燥机,北京博劢行仪器有限公司S-4800扫描电子显微镜,日本Hitachi公司;DSC8000差式扫描量热仪,美国PE公司;TTR-Ⅲ X射线衍射仪,日本理学公司;Nicoletteis50傅里叶红外光谱仪,美国赛默尔飞世尔公司;DHR-3 旋转流变仪,美国TA有限公司。
1.3 方法
1.3.1 大豆蛋白肽-玉米淀粉复合物的制备 称取5 g玉米淀粉(CS),加入到配制好的100 mL pH 5.7的醋酸盐缓冲液中,配制成5%浓度的淀粉乳液,并按照不同的添加量0%、5%、10%、15%和20%(基于淀粉质量,)加入大豆蛋白肽(SPP);混合后,在100 ℃沸水浴糊化30 min,然后再转移至高压灭菌锅中130 ℃高温糊化30 min,取出待降至58 ℃后,加入普鲁兰酶,酶用量6 U·g-1,在气浴恒温振荡器中58 ℃保温6 h,接着将酶脱支处理后的样品在沸水浴中进行灭酶处理(20 min),待冷却至室温后放入4 ℃冰箱中回生7 d;将回生后的样品冷冻干燥,研磨后过200目筛,得到大豆蛋白肽-玉米淀粉复合物(SPP/RS)。按照大豆肽不同添加量分别命名为0%SPP-RS、5%SPP-RS、10%SPP-RS、15%SPP-RS和20%SPP-RS。
1.3.2 大豆蛋白肽-玉米淀粉复合物形态的观察 用棉签取少量样品涂抹至带有导电胶的样品座上,在真空条件下进行镀金处理,进行扫描电镜观察。
1.3.3 红外光谱测定 采用KBr压片法测定样品在400 ~ 4 000 cm-1波长范围内的吸收光谱,分辨率4 cm-1,扫描次数16次。
1.3.4 X-射线衍射测定 通过X-射线衍射(XRD)测定样品的结晶结构,在电压40 kV和电流200 mA下,衍射角(2θ)范围设定为3 ~ 50。
1.3.5 热力学性质测定(DSC) 使用差式扫描量热仪(DSC)测量样品的热力学性质。设定条件为:以10 ℃·min-1的速率从25 ℃升温到150 ℃,利用仪器上的分析软件对大豆蛋白肽-玉米淀粉复合物的相转变温度(To、Tp和Tc)和焓变(ΔH)进行了分析计算。
1.3.6 体外消化性能的测定 体外消化的测定参考Englyst等[12]的方法进行测定,称取100 mg样品粉末放入100 mL锥形瓶中,加入pH为5.2的醋酸盐缓冲液15 mL,在沸水中糊化30 min后冷却至室温,然后加入10 mL α-淀粉酶与糖化酶的混合酶液(α-淀粉酶浓度为290 U·mL-1, 糖化酶浓度为15 U·mL-1),在37 ℃气浴恒温振荡摇床中振荡2 h,分别在第20 min和第120 min取1 mL酶解液,加入4 mL无水乙醇灭酶,反应液在4 000 r·min-1下离心20 min后,吸取1 mL上清液用DNS法测定葡萄糖的含量,通过公式计算出淀粉水解率,快消化淀粉(RDS)、慢消化淀粉(SDS)和抗性淀粉(RS)的含量。
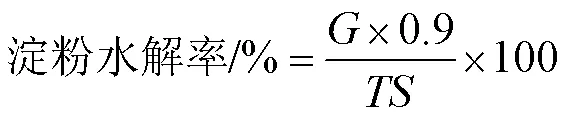

式中:20为淀粉经酶水解后第20 min产生的葡萄糖含量(mg);120为淀粉经酶水解后第120 min产生的葡萄糖含量(mg);为样品中总淀粉含量(mg)。
1.3.7 淀粉与多肽相互作用力的测定 相互作用力的测定参考Joshi等[13]方法,按1∶0.3的比例称取玉米淀粉和大豆蛋白肽,加入纯水后配制成淀粉浓度占比为6%的溶液,分别加入5%的0.1、0.2和0.3 mol·L-1的NaCl溶液与尿素溶液和5%浓度为5、10和50 mmol·L-1的二硫苏糖醇(DTT)溶液;将混合溶液在沸水浴加热30 min后放在50 ℃水中保温。然后进行应变扫描寻找线性粘弹区,程序为:频率1 Hz,应变扫描范围0.1% ~10%,选取合适的应变再进行频率扫描,记录混合物储能模量G′和损耗模量G″的变化。
1.4 数据分析
试验数据采用 SPSS 25软件对数据进行显著性分析(< 0.05),利用Origin Pro 2018 软件进行绘图。数据结果表示为平均值±标准差,所有试验至少重复3次。
2 结果与分析
2.1 大豆蛋白肽-玉米淀粉复合物形貌的观察
从图1可以看出,玉米原淀粉颗粒的表面较为光滑,外观大多为椭球形或多棱角形,经过压热糊化-酶脱支-老化处理制成复合物后,颗粒形貌受到了严重的破坏,复合物不再像原淀粉颗粒那样有比较规则的形貌。复合物的形貌主要为大小不一的碎片,片层结构十分明显,表面不再像之前一样光滑,而是出现了较多的皱褶和沟壑,变得十分粗糙并且坍塌结构十分明显。随着大豆蛋白肽添加量的增加,复合物碎片的尺寸逐渐缩小,成团结构不再明显。这是由于原淀粉经过高温高压糊化处理后,淀粉颗粒迅速吸水膨胀并导致颗粒破裂,直链淀粉溶出,当温度上升时,淀粉分子加剧振动,分子之间氢键被破坏,淀粉分子有更多的结合位点能与水分子形成氢键;当温度继续上升至糊化温度时,水分子进入了微晶束结构,导致了结晶区的大小和数目均减小,最后双折射以及结晶结构消失,变为无序的状态,形态遭到了严重破坏再经过酶脱支和冷却老化处理后,直链淀粉分子链通过氢键结合,相互平行靠拢及重排形成了高度致密的、结晶化的分子微束,使其具有十分坚硬且稳定的结构并具有了很强的抗酶解功能[14]。大豆蛋白肽的加入影响了直链淀粉的回生老化,阻碍了淀粉分子之间的聚集,使重结晶后形成的复合物尺寸减小,结构不紧密[15]。
2.2 红外光谱分析大豆蛋白肽-玉米淀粉复合物
傅里叶红外光谱(FT-IR)是现代一种常用的测试分子内基团变化的检测手段,也可以通过羟基伸缩振动峰的改变分析出分子间氢键的结合强弱的变化。常见的红外吸收区域主要有:-OH 3 700~3 200 cm-1、C-H 3 100~2 800 cm-1、C=O 2 000~1 500 cm-1、伯醇羟基C-O伸缩振动1 200~1 100 cm-1、伯羟吡喃糖环C-O伸缩振动1 090~1 050 cm-1、吡喃环的非对称伸缩振动950~900 cm-1、吡喃环的对称伸缩振动800~750 cm-1[16]。如图2所示,玉米原淀粉在3 423.77 cm-1处出现了羟基伸缩振动峰,在2 930.82 cm-1处出现了饱和C-H的伸缩振动峰,1 651.71 cm-1处为C=O的吸收峰,1 158.33、1 081.10和1 016.21 cm-1处分别为伯仲、醇羟基连接的C-O的吸收峰与吡喃糖环的C-O吸收峰[16],929.46 cm-1处为吡喃环的非对称伸缩振动峰(D-吡喃葡萄糖的Ⅰ型吸收带),763.89 cm-1处为吡喃葡萄糖的对称伸缩振动峰(D-吡喃葡萄糖的Ⅲ型吸收带)[17]。大豆蛋白肽-玉米淀粉复合物都具有以上的特征伸缩振动吸收峰,并且在1 574 cm-1附近出现了新的特征峰,此处为大豆蛋白肽的酰胺键。玉米淀粉的羟基伸缩振动峰在3 423.77 cm-1处,而加入20%的大豆蛋白肽后的复合物向低波数处移动,降低到3 416.47 cm-1处,说明体系的氢键作用增强,这与杨翠红[18]使用傅里叶红外光谱法研究乳清分离蛋白对淀粉作用机制的影响结果类似。
表1中显示了1 047/1 022 cm-1与1 022/995 cm-1的峰强度比值。峰强度的比值代表了淀粉双螺旋结构的有序程度和淀粉分子的有序性,1 047/1 022 cm-1峰强度比值越高并且1 022/995 cm-1峰强度比值越低,分子有序性越高[19]。从表1中可以看出,与原淀粉相比,大豆蛋白肽-玉米淀粉复合物1 047/1 022 cm-1峰强度的比值出现了先升高后降低的趋势,并且1 022/995 cm-1的峰强度比值出现了先降低后升高的趋势,这说明玉米淀粉经过高温糊化-脱支-回生处理后的抗性淀粉分子的有序程度先提高后降低,这归因于普鲁兰酶脱支处理后淀粉的支链被脱去形成了大量短的线性直链淀粉分子,这些直链淀粉分子在回生老化的过程中,直链淀粉重排形成了有序的双螺旋结构;但大豆蛋白肽的加入阻碍了直链淀粉分子相互靠拢形成有序结构,所以随着多肽的加入,抗性淀粉有序性逐渐降低[20]。

A.CS;B.0%SPP-RS;C.5%SPP-RS; D.10%SPP-RS;E.15%SPP-RS; F.20%SPP-RS。
Figure 1 SEM images of corn starch (CS) and soybean protein peptide-corn starch compound (SPP-RS)
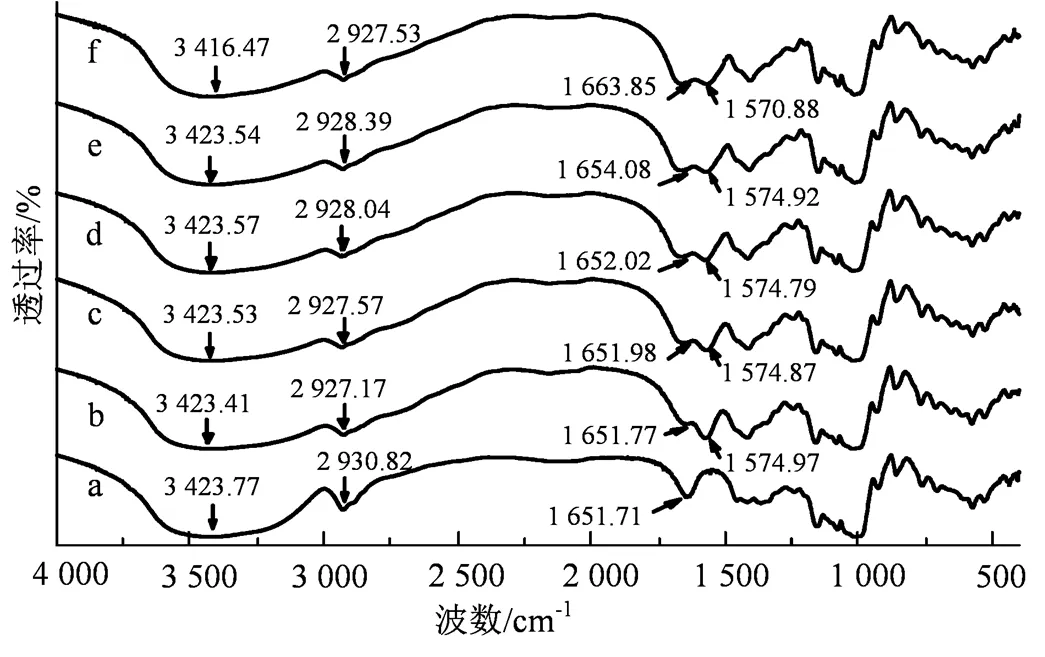
a.CS;b. 0%SPP-RS;c. 5%SPP-RS;d. 10%SPP-RS; e. 15%SPP-RS;f. 20%SPP-RS。
Figure 2 Infrared spectra of corn starch (CS) and soybean protein peptide-corn starch compound (SPP-RS)
2.3 大豆蛋白肽-玉米淀粉复合物结晶结构分析
从图3中可以看出,玉米淀粉在衍射角2= 15.3°、17.1°、18.1°和23.6°处出现了4个很强的衍射峰,说明玉米淀粉的结晶结构是典型的A型结构,在19.6°附近的衍射峰主要是淀粉分子与少量脂质形成的复合物所产生的[21];经过高温糊化-脱支-回生处理后的大豆蛋白肽-玉米淀粉复合物衍射峰位置发生了明显的变化,在15.3°和18.1°处的特征衍射峰消失,在24.0°处出现了新的衍射峰,为B型结晶结构的主要特征峰,并且还在13.2°处出现了新的衍射峰。这是V型结构的特征峰,说明了玉米原淀粉在高温糊化中失去了其原有的A型结构,并且在脱支后回生老化的过程中形成了新的B+V型结晶结构,B+V型结构有更强的稳定性[22]。
由表1可知,玉米淀粉的结晶度为20.62%,复合物的结晶度明显大于原淀粉,这是由于淀粉经过高温糊化和酶脱支后形成了大量的短的线性直链淀粉分子,这些直链淀粉在回生老化时分子链通过氢键缔合相互作用形成了紧密的双螺旋结构,双螺旋结构形成了有序的晶体,分子间缔合强度增加;且随着大豆蛋白肽添加量的增加,复合物的结晶度呈现出逐渐升高的趋势,这主要归因于V型络合物的形成。由于大豆蛋白肽的加入,使直链淀粉分子在回生时与多肽相互作用形成了络合物,直链淀粉-多肽络合物越多,相对结晶度也越高,V型复合物具有很强的抗酶解功能,说明大豆蛋白肽的加入增强了复合物的抗酶解性[23]。

表1 去卷积化图谱1 047/1 022 cm-1与1 022/995 cm-1的比值与样品的相对结晶度
注:同一列中不同字母表示有显著性差异(< 0.05)。下同。
2.4 大豆蛋白肽-玉米淀粉复合物热特性分析
如图4和表2所示,玉米淀粉的To、Tp和Tc分别为69.71、73.81和77.16 ℃,而复合物熔融温度显著提高,说明了复合物的结晶结构紧密并且热稳定性很高,需要很高的温度才能使其结晶区破坏熔融,ΔH与淀粉的双螺旋结构和晶体的结晶形状有关,复合物的ΔH最低为18.53 J·g-1,破坏其双螺旋结构与结晶区所需要的能量很大,淀粉分子在高温糊化和酶脱支后在老化时大量直链淀粉分子相互缔合形成了更为紧密的双螺旋分子结构,结晶结构完整并且结晶类型发生的改变,不易被破坏[24]。并且随着大豆蛋白肽添加量的增加,复合物的To、Tp、Tc和ΔH出现了逐渐升高的趋势,这说明大豆蛋白肽的加入使得其结晶结构变得更紧密,需要破坏其结晶区所需要的能量增加,可能是大豆肽的加入在直链淀粉分子回生老化时与淀粉分子链发生了相互作用,形成了络合物,结构变得更紧密,提高了淀粉的热稳定性[24],这与之前的XRD结果一致。
2.5 大豆蛋白肽-玉米淀粉复合物消化性分析
根据淀粉在人体内消化率和消化程度,可以分为3类:快消化淀粉(RDS),即在前20 min内被人体消化的淀粉;慢消化淀粉(SDS),即在20~120 min内消化的淀粉;抗性淀粉(RS),在120 min内不能被人体消化的淀粉;并且淀粉的体外消化性与血糖生成指数有相关性,RS和SDS含量越高,高血糖指数也就越低[25]。

a.CS;b.0%SPP-RS;c. 5%SPP-RS;d. 10%SPP-RS;e. 15%SPP-RS;f. 20%SPP-RS。
Figure 3 XRD images of corn starch (CS) and soybean protein peptide-corn starch compound (SPP-RS)
由表3可知,天然玉米淀粉的RDS、SDS和RS的含量分别为68.28%、9.43%和22.29%,与文献报道相似[25]。经过高温糊化-酶脱支-老化后的复合物中RDS含量降低,RS含量提高,这是由于高温糊化后大量直链淀粉溶出,普鲁兰酶的加入脱去淀粉分子的支链形成了大量的线性直链淀粉分子,随后在老化过程中直链淀粉重新排列,相互靠近,通过氢键结合形成了紧密的双螺旋结构,重新形成了坚硬的晶体结构,这种结构使得其抗酶解性大幅提高,使其不易被ɑ-淀粉酶和糖化酶水解[26]。从表3中还可以看出,随着大豆蛋白肽添加量的增加,RDS含量出现了降低,RS含量出现了升高,大豆蛋白肽的加入降低了淀粉的消化性,强化了其抗酶解功能[27]。由此可以推测,大豆蛋白肽的加入在淀粉老化的过程中,直链淀粉形成双螺旋结构时包裹住了部分大豆蛋白肽,而这些肽在淀粉酶解时阻碍了酶与淀粉分子的结合位点,使淀粉酶与淀粉分子结合成的活性复合物不易形成,使其不易被消化;或者是大豆蛋白肽附着在淀粉分子的表面,降低了淀粉酶与淀粉分子的接触面积,从而降低了淀粉的消化性[20]。并且复合物中含有经过高温改性的大豆蛋白肽,可以消除原蛋白中的一些营养抑制因子,一定程度上增加了多肽的利用率,增强了其营养特性。另外,大豆蛋白肽是由蛋白酶水解的产物,这种小分子肽具有活化细胞免疫的功能以及改善心血管的功能,将其加入玉米淀粉中可以改善人体免疫功能[28]。
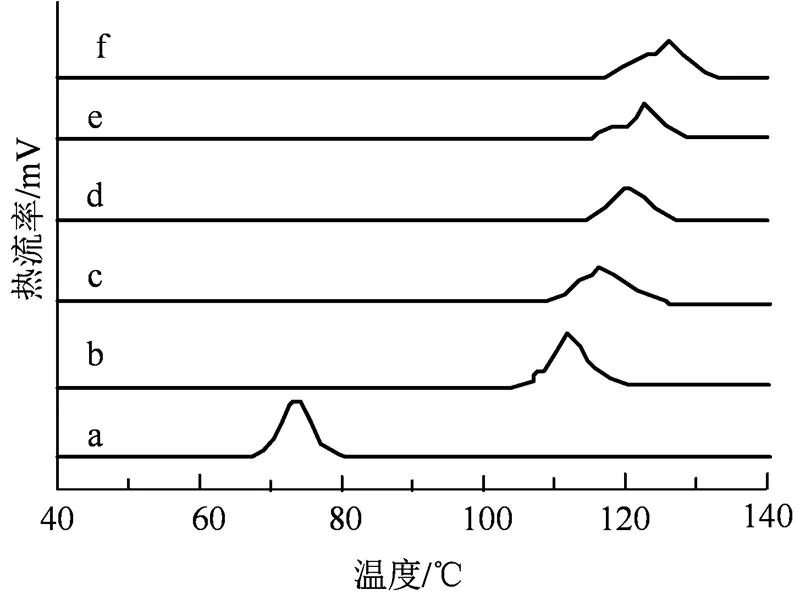
a.CS; b. 0%SPP-RS;c. 5%SPP-RS;d. 10%SPP-RS;e. 15%SPP-RS;f. 20%SPP-RS。
Figure 4 DSC thermal analysis diagram of corn starch (CS) and soybean protein peptide-corn starch compound
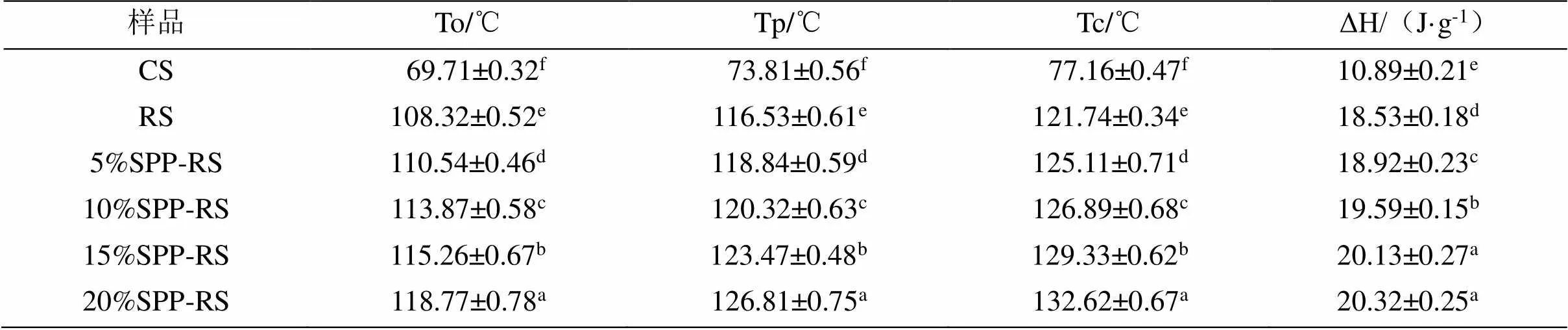
表2 玉米淀粉及大豆蛋白肽-玉米淀粉复合物热力学性质
2.6 大豆蛋白肽与玉米淀粉间相互作用力分析
淀粉与多肽共混体系存在着一定的相互作用力,二者相互作用后能够显著降低淀粉的消化性;氢键、范德华力和静电相互作用是多肽分子与淀粉之间的主要作用力[7]。因此,本试验通过NaCl、二硫苏糖醇和尿素作为静电干扰剂、共价键破坏剂和氢键阻断剂探究了淀粉与大豆蛋白肽之间的相互作用力。通过加入特定试剂后的储能模量G′和损耗模量G″的变化结果(图5)显示,随着NaCl浓度的升高,大豆蛋白肽与淀粉的混合体系的储能模量G'和损耗模量G″只有略微降低,说明了NaCl对混合体系的相互作用力削弱作用很小;二硫苏糖醇主要破坏混合体系的共价键作用,可以看到随着二硫苏糖醇浓度的增加,混合体系的储能模量G'和损耗模量G″无明显变化,说明二硫苏糖醇的加入对体系的相互作用力无影响,大豆蛋白肽与淀粉之间没有共价键作用;尿素主要破坏了体系之间的氢键,随着尿素浓度的增加,混合体系的储能模量G'和损耗模量G″发生了显著下降,说明尿素的加入很大程度上削弱了混合体系的相互作用[18]。因此,大豆蛋白肽与淀粉之间主要相互作用力为氢键[18]。

表3 大豆蛋白肽对玉米淀粉体外消化特性的影响
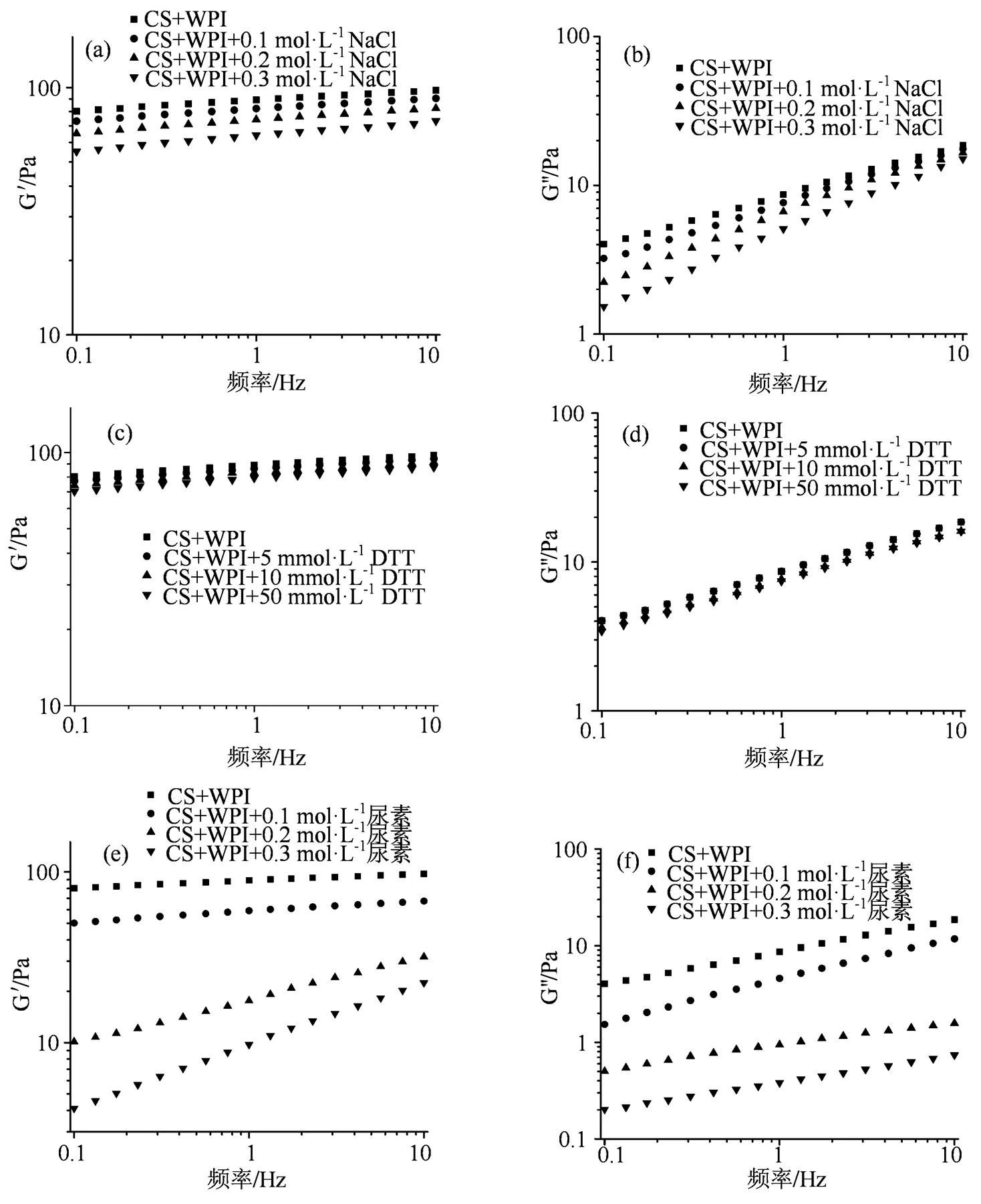
(a)和(b):NaCl;(c)和(d):二硫苏糖醇(DTT);(e)和(f):尿素。
Figure 5 The effects of different reagents on the storage modulus G′ (a, c and e) and loss modulus G″ (b, d and f) of the samples
3 结论
通过压热-酶法制备了大豆蛋白肽-玉米淀粉复合物,并对其性质进行研究。结果显示,压热-酶法破坏了玉米淀粉颗粒的原有形貌,形成了片层结构;大豆蛋白肽和玉米淀粉的特征伸缩振动峰均出现在复合物中,并且复合物比玉米淀粉的分子有序性升高;经过处理后复合物的结晶类型由玉米淀粉的A型转变为B+V型,相对结晶度明显提高。DSC分析表明,复合物的结晶结构紧密并且热稳定性很高;从体外消化性和相互作用力结果可以看出,复合物相比玉米淀粉大幅降低,多肽与淀粉分子间发生了氢键缔合作用,并且随着大豆蛋白肽的加入,复合物的抗酶解能力增强,使其不易被消化。
[1] XU Y, CHEN X, XU X N, et al. Investigation on morphological structure and crystal transition of maize starch gelatinized in pure glycerol[J]. J Cereal Sci, 2020, 92: 102924.
[2] 岳保军. 玉米淀粉产品生产线工艺及发展优势分析[J]. 农民致富之友, 2013(6): 66.
[3] LI L Y, YUAN T Z, AI Y F. Development, structure and in vitro digestibility of type 3 resistant starch from acid-thinned and debranched pea and normal maize starches[J]. Food Chem, 2020, 318: 126485.
[4] MIAO T T, XIONG K, JI N, et al. Resistant starch nanoparticles prepared from debranched starch by medium-temperature recrystallization[J]. Int J Biol Macromol, 2020, 155: 598-604.
[5] 问燕梅. 小麦RS3型抗性淀粉的制备、性质及其应用的研究[D]. 西安: 陕西科技大学, 2014.
[6] 余世锋, 于淼, 孙天颖, 等. 大米RS3型抗性淀粉的物化性质研究[J]. 食品科技, 2013, 38(4): 154-159.
[7] 付田田, 靳凤芳, 牛丽亚, 等. 大豆肽和豌豆肽对大米淀粉理化性质的影响[J]. 中国粮油学报, 2019, 34(6): 53-58, 67.
[8] OÑATE NARCISO J, BRENNAN C. Whey and pea protein fortification of rice starches: effects on protein and starch digestibility and starch pasting properties[J]. Starch- Stärke, 2018, 70(9/10): 1700315.
[9] ZENG F, MA F, GAO Q, et al. Debranching and temperature-cycled crystallization of waxy rice starch and their digestibility[J]. Carbohydr Polym, 2014, 113: 91-96.
[10] 刘成龙, 史彩燕, 武乔乔, 等. 蛋白质对玉米淀粉理化特性的影响[J]. 齐鲁工业大学学报, 2018, 32(6): 29-33.
[11] 柴晓杰, 李栋才, 王淑萍. 浅谈大豆蛋白(肽)的价值优势[J]. 大豆通报, 1999(6): 22-23.
[12] ENGLYST H N, KINGMAN S M, CUMMINGS J H. Classification and measurement of nutritionally important starch fractions[J]. Eur J Clin Nutr, 1992, 46(Suppl 2): S33-S50.
[13] JOSHI M, ALDRED P, PANOZZO J F, et al. Rheological and microstructural characteristics of lentil starch-lentil protein composite pastes and gels[J]. Food Hydrocoll, 2014, 35: 226-237.
[14] ZOU J, XU M, TANG W, et al. Modification of structural, physicochemical and digestive properties of normal maize starch by thermal treatment[J]. Food Chem, 2020, 309: 125733.
[15] DONG D, CUI B. Fabrication, characterization and emulsifying properties of potato starch/soy protein complexes in acidic conditions[J]. Food Hydrocoll, 2021, 115: 106600.
[16] 赵力超, 于荣, 刘欣, 等. 大米抗性淀粉制备工艺优化及特性分析[J]. 农业工程学报, 2013, 29(12): 277-285.
[17] CHÁVEZ-MURILLO C E, VEYNA-TORRES J I, CAVAZOS-TAMEZ L M, et al. Physicochemical characteristics, ATR-FTIR molecular interactions and in vitro starch and protein digestion of thermally-treated whole pulse flours[J]. Food Res Int, 2018, 105: 371-383.
[18] 杨翠红. 乳清分离蛋白对淀粉消化特性的影响及其作用机制研究[D]. 无锡: 江南大学, 2019.
[19] 满建民, 蔡灿辉, 严秋香, 等. 红外光谱技术在淀粉粒有序结构分析中的应用[J]. 作物学报, 2012, 38(3): 505-513.
[20] KORKUT A, KAHRAMAN K. Production of cross- linked resistant starch from tapioca starch and effect of reaction conditions on the functional properties, morphology, X ray pattern, FT-IR spectra and digestibility[J]. J Food Meas Charact, 2021, 15(2): 1693-1702.
[21] POZO C, RODRÍGUEZ-LLAMAZARES S, BOUZA R, et al. Study of the structural order of native starch granules using combined FTIR and XRD analysis[J]. J Polym Res, 2018, 25(12): 1-8.
[22] 蹇华丽, 高群玉, 梁世中. 抗性淀粉结晶性质的研究[J]. 食品科学, 2003, 24(7): 44-47.
[23] 杜先锋, 许时婴, 王璋. 食品成分对淀粉凝胶力学性能的影响[J]. 中国粮油学报, 2002, 17(2): 6-8,17.
[24] LIU X Y, CHEN M X, LI F, et al. Optimisation of the preparation of sweet potato resistant starch by dry heating with pectin[J]. Food Sci Technol Res, 2020, 26(1): 39-46.
[25] 肖瑀. 酶法制备改性玉米淀粉及其物理与消化特性研究[D]. 合肥: 安徽农业大学, 2019.
[26] OGBO F C, NWOZOR N C. Effect of pullulanase debranching and retrogradation on resistant starch yield and glycemic index of garri[J]. J Adv Microbiol, 2020: 67-75.
[27] 付田田, 舒蓝萍, 徐理宏, 等. 谷物蛋白肽对大米淀粉理化特性和体外消化特性的影响[J]. 现代食品科技, 2019, 35(10): 76-84.
[28] 梁敏, 彭凯. 大豆多肽的功能性与功能食品开发[J]. 农产品加工(学刊), 2006(11): 24-26, 30.
Preparation of soybean protein peptide-corn starch compound and analysis of its properties
ZHAO Dehou, HAO Shuai, ZHU Zhijie, DU Xianfeng
(Anhui Engineering Laboratory for Agro-Products Processing, School of Tea and Food Science & Technology, Anhui Agricultural University, Hefei 230036)
In this paper, corn starch was used as raw material to prepare soybean protein peptide corn starch complex by autoclave enzymatic method and adding a certain amount of soybean protein peptide (5%, 10%, 15% and 20%,) to study the physicochemical properties anddigestibility of the compound. The experimental results showed that the morphology of corn starch granule was ellipsoidal or polyangular, while the morphology of compound was seriously damaged, and the lamellar structure of compound was different in size. The -OH of the infrared spectrum of the compound moved towards the low wave number, indicating that the molecular order of resistant starch increased in comparison of corn starch. The crystalline structure of corn starch was of A type, and the crystalline structure of resistant starch changed to B+V type after pressure-heat and enzyme treatment. The highest melting temperature of the compound was 126.81 ℃, which indicated that the compound has high disintegration temperature, compact crystal structure and higher thermal stability. Thedigestibility of the compound decreased significantly, the content of resistant starch increased significantly, and the resistance to enzymatic hydrolysis increased with the increase of soybean peptide. The main interaction between soybean protein peptide and starch was hydrogen bond, and the properties of the compound produced by the interaction between soybean protein peptide and starch changed greatly. The study of the properties of the compound can provide a theoretical basis for its application in the field of food.
corn starch; soybean protein peptide; compound; resistant starch; interaction force
TS235.9
A
1672-352X (2021)06-0989-08
10.13610/j.cnki.1672-352x.20220106.023
2022-1-6 17:07:20
[URL] https://kns.cnki.net/kcms/detail/34.1162.S.20220106.1254.046.html
2021-02-03
国家自然科学基金(31471700)资助。
赵德厚,硕士研究生。E-mail:1967380046@qq.com
通信作者:杜先锋,博士,教授,博士生导师。E-mail:dxf@ahau.edu.cn

