微RNA-29 家族降解PTEN mRNA 促进非小细胞肺癌细胞存活与淋巴结侵袭
陈 晨,尹姗姗,郭佳慧,高丰厚
(上海交通大学医学院附属第九人民医院肿瘤科,上海 201900)
肺癌是目前发病率和死亡率均居首位的恶性肿瘤,主要为非小细胞肺癌(non-small cell lung cancer,NSCLC)(80%~85%),NSCLC 主要分为鳞状细胞癌(25%)、肺腺癌(40%)和大细胞癌[1-2]。由于早期诊断的困难和转移的高风险以及治疗的耐药性,NSCLC 治愈率仍然很低[2]。其中淋巴结转移是NSCLC 最常见和最主要的转移途径,也是影响分期和预后的最重要因素,但目前并不完全清楚NSCLC 淋巴结转移的分子基础[3]。因此,探索NSCLC 淋巴结转移生物学标志物及其相应的机制仍然是NSCLC 淋巴结转移的基础性工作。
磷酸酶和张力蛋白同源物 (phosphatase and tension homology deleted from chromosome 10,PTEN)也称为多种晚期癌症突变1 (mutated in multiple advanced cancers 1,MMAC1),参与调节细胞生长、迁移和凋亡的过程[4]。在多种癌症中发现PTEN 表达下调[4]。既往研究表明,NSCLC 中PTEN 表达缺乏的患者淋巴结受累较多,即PTEN 表达与NSCLC 淋巴结转移负相关[5]。所以探讨NSCLC 细胞中PTEN表达的调控及其分子机制,可阐释NSCLC 低表达PTEN 或功能缺失时肿瘤细胞侵袭淋巴结的分子基础,也可为靶向PTEN 抑制肿瘤细胞淋巴结侵袭提供分子靶标。调节PTEN 表达的表观机制包括甲基化、微RNA(microRNA,miRNA/miR)或假基因表达,以及蛋白质磷酸化[4]。其中miRNA 调控PTEN的表达越来越受到关注。miRNA 是一类长度为19~25 个核苷酸的内源性非编码单链RNA,通过结合mRNA 的3’ 非翻译区(untranslated region,UTR)导致mRNA 的降解或翻译抑制而调节靶基因的表达,人类基因组中约有1/3 的基因可被其调控[6]。miRNA 参与调节许多肿瘤中的PTEN 表达,已证明miR-21 直接靶向并下调特定肿瘤中的PTEN[7-8];miR-25 抑制肝癌中的PTEN 表达促进肿瘤发生以及miR-19 可下调肾透明细胞癌中的PTEN[9-10]。近年来,miR-29 已成为各种癌症中的关键miRNA,并且已显示出其可以调节多种致癌过程,包括表观遗传学、蛋白稳态、代谢、增殖、凋亡、转移、纤维化、血管生成和免疫调节[11]。该家族是否参与下调NSCLC中PTEN 表达、介导肿瘤细胞淋巴结侵袭值得进一步探索。
本研究通过生物信息学预测miR-29 可能通过PTEN 在NSCLC 淋巴结侵袭中发挥作用,并验证miR-29 家族在淋巴结侵袭性NSCLC 细胞中通过下调PTEN 促进存活蛋白 (survivin) 表达从而促进NSCLC 的增殖以及侵袭。
材料与方法
一、细胞培养
人NSCLC 细胞株A549、H1299 以及293T 细胞购自中国科学院分子细胞科学卓越创新中心细胞库,293T 细胞与A549 细胞用含有10%胎牛血清(fetal bovine serum,FBS)的高糖DMEM 培养基培养,H1299 细胞用含有10% FBS 的RPMI-1640 培养基培养。细胞放置在37℃,含有5% CO2的培养箱内培养。
二、生物信息学分析
下载TCGA 数据库中NSCLC 的mRNA 数据,分析无淋巴结转移323 例(对照组)与有淋巴结转移158 例癌组织中PTEN mRNA 水平。采用Targetscan、miRanda 和Pictar 在线分析软件预测能与PTEN 3’-UTR 区(-2 000~0)结合的miRNA(选入标准为Targetscan:Pct >0.1,miRanda:miRSVR <-0.6862)。
三、miR-29a/b/c 类似物(mimics)和miR-29a/b/c抑制子(inhibitor)转染
将A549 和H1299 细胞接种于24 孔板中,37℃5%CO2培养箱中培养24 h。按照lipo3000(美国Invitrogen)试剂说明书在A549 细胞中转染60 pmol 阴性对照(negative control,NC)或miR-29a/b/c类似物,H1299 细胞中转染60 pmol 的NC 序列或miR-29a/b/c 抑制子,培养箱中继续培养。36 h 后收集细胞沉淀,蛋白质印迹检测目的蛋白的表达。
四、载体构建
1.psiCHECK2-PTEN 3’-UTR 系列质粒构建:用psiCHECK2 为载体构建含野生型 (wild type,WT)PTEN 3’-UTR 的psiCHECK2-PTEN 3’-UTR WT 质粒和 miR-29 结合位点突变的序列psiCHECK-PTEN 3’-UTR MT1、psiCHECK-PTEN 3’-UTR MT2、psiCHECK-PTEN 3’-UTR MT1+2 质粒。psiCHECK2-PTEN 3’-UTR WT 质粒构建以A549细 胞cDNA 为模板,PTEN-UTR-F:5’-CGC GCG CTC GAG ATT TTT TTT TAT CAA GAG GG-3’,PTEN-UTR-R:5’-ATC GGC GGC CGC TGA CAA GAA TGA GAC TTT AA-3’ 引物进行扩增,通过XhoI 和NotI 酶切位点插入载体psiCHECK2。psiCHECK-PTEN 3’-UTR MT1,PTEN 3’-UTR MT2以psiCHECK2-PTEN 3’-UTR WT 为模板扩增,引物序列如下。PTEN-UTR MT1-F:5’-TAA AGC ATG TCA ACA TCA GAA AAG GCA GCT AAA GGA AGT GAA T-3’,PTEN-UTR MT1-R:5’-TTC TGA TGT TGA CAT GCT TTA AAA AAA AAT GCG CAA ACA AC-3’;PTEN-UTR MT2-F:5’-ATA ACT TGT CAA CAT CGA AAT TGT TCA CTA GCT GTG GTC TG-3’,PTEN-UTR MT2-R:5’-ATT TCG ATG TTG ACA AGT TAT TGA AAA ATG GAA TTT TAT ACC-3’。psiCHECK2-PTEN 3’-UTR MT1+2以psiCHECK2-PTEN 3’-UTR MT1 为模板,PTENUTR MT2-F 与PTEN-UTR MT2-R 为引物进行扩增。
2.LentiCRISPRv2-29 KD 质粒构建:29a-F:5’-CAC CGG GAA ATG TAT TGG TGA CCG T-3’,29a-R:5’-AAA CAC GGT CAC CAA TAC ATT TCC-3’;由于成熟的miR-29b 来源于7q32.3 和1q32.2,故设计2 个敲低 (knock down) 片段,即29b1-F:5’-CAC CGG ATG AAG CTG AAC CTT TGT C-3’,29b1-R:5’-AAA CGA CAA AGG TTC AGC TTC ATC-3’;29b2-F:5’-CAC CGG ATA TGA CAC AGT GCT CCA T-3’,29b2-R:5’-AAA CAC GGT CAC CAA TAC ATT TCC-3’;29c-F:5’-CAC CGG AAA TCG GTT ATG ATG TAG G-3’,29c-R:5’-AAA CCC TAC ATC ATA ACC GAT TTC-3’退火后通过BsmBI 插入质粒LentiCRISPRv2 分别构建LentiCRISPRv2-29a/29b1/29b2/29c 质粒;再通过PCR 分别将LentiCRISPRv2-29b1/29b2/29c 中 的U6-29b1/29b2/29c 序列通过EcoRI 酶切位点插入LentiCRISPRv2-29a 质粒中,构建LentiCRISPRv2-29 KD 质粒(即敲低miR-29a、29b1、29b2 及29c 片段构建入该质粒中),目的是在H1299 细胞中同时敲低miR-29 家族。
五、荧光素酶报告基因试验
构建的 psiCHECK2-PTEN 3’-UTR WT 和psiCHECK2-PTEN 3’-UTR MT1,psiCHECK2-PTEN 3’-UTR MT2 和psiCHECK2-PTEN 3’-UTR MT1+2荧光素酶报告载体,与NC 序列或miRNA 类似物分别同时转染293T 细胞。以上4 种质粒分别与miR-29a/b/c 类似物或NC 共同转染293T 细胞,24 h 后用双荧光素酶报告检测试剂盒(上海碧云天生物技术有限公司)收集细胞裂解液,Tecan Infinite M200 检测萤火虫(F)与海肾(R)荧光素酶活性,计算R/F 比值。
六、miR-29a/b/c 敲低稳转细胞株构建
将293T 细胞接种于6 孔板中,37℃5%CO2培养箱中培养24 h,按照lipo3000 试剂说明书,包装质粒PMD2.G,VSVG 与LentiCRISPRv2/Lenti-CRISPRv2-29 KD 质粒共同转染,48 h 后收集病毒液感染H1299 细胞,48 h 后用嘌呤霉素(puromycin)筛选细胞,构建稳转细胞株H1299-NC/H1299-29 KD 细胞。
七、蛋白质印迹
收集细胞,加入适当体积的1×十二烷基硫酸钠(sodium dodecyl sulfate,SDS)裂解液[50 mmol/L三羟甲基氨基甲烷盐酸盐(Tris-HCl)(pH6.8),100 mmol/L 二硫苏糖 醇 (dithiothreitol,DTT),2%SDS,10%甘油和无菌水],冰上-100℃金属浴各5 min反复裂解后依次进行SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE),转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,5%脱脂奶粉封闭,一抗孵育,包括抗PTEN(1∶1 000),抗甘油醛-3-磷酸脱氢酶 (glyceraldehyde-3-phosphate dehydrogenase,GAPDH)(1∶5 000),抗Akt、抗磷酸化Akt(phosphorylated Akt,p-Akt)、抗存活蛋白、抗黏着斑激酶(focal adhesion kinase,FAK)、抗p-FAK (均为1 ∶1 000),相应辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗(1∶5 000)孵育,电化学发光(electro-chemi-luminescence,ECL)显影液显影。
八、实时荧光定量反转录PCR(quantitative reverse transcriptase-mediated PCR,qRT-PCR)
用Trizol 试剂根据说明提取细胞中总RNA,用Mir-X miRNA 第一链合成系统或者PrimeScript RT reagent kit with gDNA eraser 将RNA 反转录 成cDNA,用SYBR Green qPCR Master Mix 在荧光定量PCR 仪器进行qRT-PCR,检测细胞中miR-29a/b/c、PTEN 和存活蛋白mRNA 水平,miRNA 以U6为内参,PTEN 和存活蛋白以β-肌动蛋白为内参,用2-ΔΔCt法计算各目的基因相对表达水平。引物序列如下。PTEN-F:5’-GTT TAC CGG CAG CAT CAA AT-3’,PTEN-R:5’-CCC CCA CTT TAG TGC ACA GT-3’; β-肌动蛋白-F:5’-TCG TGC GTG ACA TTA AGG AG-3’,β-肌动蛋 白-R:5’-GTC AGG CAG CTC GTA GCT CT-3’;存活蛋白-F:5’-AGG ACC ACC GCA TCT CTA CAT-3’,存活蛋白-R:5’-AAG TCT GGC TCG TTC TCA GTG-3’;U6-F:5’-GGA ACG ATA CAG AGA AGA TTA GC-3’,U6-R:5’-TGG AAC GCT TCA CGA ATT TGC G-3’;miR-29a-F:5’-CGG TAG CAC CAT CTG AAA TCG GTT-3’,miR-29b-F:5’-CGG TAG CAC CAT TTG AAA TCA GTG TT-3’,miR-29c-F:5’-GCG GTA GCA CCA TTT GAA ATC GGT-3’。
九、细胞增殖活性检测
将H1299-NC/H1299-29 KD 细胞消化后制备单细胞悬液,用含有10%FBS 的RPMI-1640 培养基稀释细胞接种至96 孔板,2 000 个/孔,37℃5%CO2培养箱中培养,分别于接种后0、24、48、72 和96 h采用细胞活力检测试剂盒(cell counting kit-8,CCK-8)法检测细胞活性。
十、Trans-well 侵袭实验
将基质胶与无血清培养基按照1∶4 的比例稀释后,每个小室中加入50 μL,培养箱过夜,小室内接种50 μL 含80 000 个H1299-NC/H1299-29 KD细胞的悬液,下室加入含20%FBS 的培养基,培养箱中培养36 h 后取出,40%甲醛固定后用0.1%的结晶紫染色,拍照并计数。
十一、统计学方法
所有分析在Graphpad Prism 8 中完成。实验中组间差异采用Student t 检验或Mann-Whitney U 检验进行统计分析,P<0.05 为差异有统计学意义。
结 果
一、淋巴结侵袭性NSCLC 细胞中PTEN 和miR-29 表达情况
与无淋巴结转移患者组织相比,伴有淋巴结转移的NSCLC 患者组织中PTEN mRNA 表达水平较低(7.916 比7.242,P=0.026 8)(见图1A)。蛋白质印迹法检测PTEN 蛋白,结果显示PTEN蛋白在A549细胞中表达是H1299 细胞的3.1 倍(见图1B)。通过Targetscan、Pictar 和miRanda 软件预 测靶向PTEN mRNA 的miRNA,显示只有miR-29 家族可靶向PTEN mRNA(见图1C)。miR-29a/b/c 在H1299细胞中(4.05±0.03、4.36±0.15 和4.12±0.10)的表达分别是A549 细胞中(1.00±0.03、1.00±0.02 和1.00±0.03)的4.0、4.4 和4.1 倍(P<0.01)(见图1D)。
二、miR-29 家族直 接靶向PTEN mRNA 3’-UTR
生物信息分析预测PTEN mRNA 3’-UTR 中的676~682 和1741~1747 可能为miR-29 的结合 位点,为验证这一预测,构建了PTEN mRNA 3’-UTR、676~682 位点突变的MT1、1 741~1 747 位点突变的MT2 以及双位点突变的MT1+2 的双荧光素酶报告质粒,即psiCHECK2-PTEN 3’-UTR WT、psiCHECK2-PTEN 3’-UTR MT1、psiCHECK2-PTEN 3’-UTR MT2和psiCHECK2-PTEN 3’-UTR MT1+2 (见图2A 和B)。发现miR-29a/b/c 类似物可以显著降低转入psiCHECK2-PTEN 3’-UTR WT 质粒的293T 细 胞R/F 比值(P<0.01),而676~682 位点、1 741~1 747位点突变后,R/F 比值变化并不显著 (见表1、图2B)。在PTEN 高表达的A549 细胞中转染miR-29a/b/c 类似物,蛋白质印迹结果显示miR-29a/b/c 类似物可降低PTEN 蛋白表达水平的31%、33%和43%(NC 100%、miR-29a 69%、miR-29b 67%、miR-29c 57%)(见图2C、D 和E)。反之,在PTEN 低表达H1299 细胞中转染miR-29a/b/c 抑制子,蛋白质印迹结果显示miR-29a/b/c 抑制子可不同程度增加PTEN 蛋白表达水平的25%、21%和62%(NC 100%、miR-29a 125%、miR-29b、121%、miR-29c 162%)(见图2F、G 和H)。
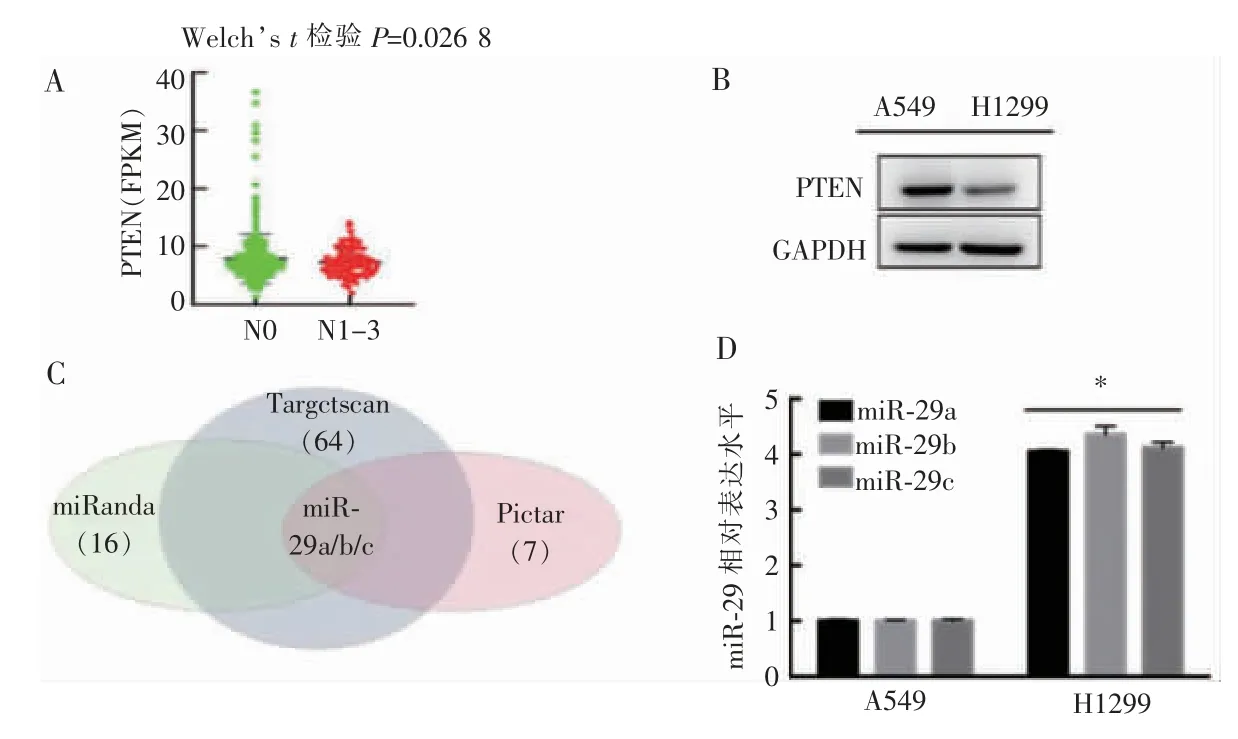
图1 非淋巴结侵袭性与淋巴结侵袭性NSCLC 细胞中PTEN 及miR-29 表达情况
表1 miR-29 与PTEN mRNA 3’-UTR 相互作用情况(均n=3, )

表1 miR-29 与PTEN mRNA 3’-UTR 相互作用情况(均n=3, )
1):与对照组比较,P<0.01
三、NSCLC 细胞中miR-29 家族对PTEN 磷酸酶活性的影响
qRT-PCR 验证miR-29a/b/c 联合敲低效果,结果显示,与对照组(分别为1.00±0.00、1.00±0.06 和1.00±0.01) 相比,miR-29a/b/c 敲低了86%(分别为0.14±0.01、0.14±0.00 和0.14±0.00)(见图3A)。同时miR-29 家族敲低后PTEN mRNA 的相对表达水平升高(1.58±0.07 比1.00±0.15)(见图3B),蛋白质印迹结果显示PTEN 蛋白水平显著增加 (269%比100%)(见图3C),miR-29 家族敲低H1299 细胞中p-Akt 水平降低(27%比100%)(见图3D)。PTEN 的靶蛋白p-FAK 的水平检测结果显示,miR-29 家族敲低后p-FAK 的水平也相应下调 (20%比100%)(见图3E)。PTEN 的磷酸酶活性与存活蛋白的表达负相关,抑制miR-29 家族后存活蛋白mRNA 相对表达水平下降35%(0.64±0.01 比1.00±0.02)(见图3F),同时其对应的蛋白也显著下调70%(30% 比100%)(见图3G)。
四、miR-29 家族对淋巴结侵袭性NSCLC 细胞增殖与侵袭的影响
通过CCK-8 法检测miR-29 家族对淋巴结侵袭性NSCLC 增殖的作用结果显示,与对照组(0.45±0.02、0.52±0.05、0.66±0.02、1.25±0.04 和2.25±0.03)相比,0、24、48、72 和96 h 时miR-29 家族敲低后细胞增殖能力明显降低 (0.42±0.01、0.47±0.01、0.54±0.03、0.80±0.03 和1.43±0.02,P<0.01)(见图4A)。用Transwell 侵袭实验结果显示miR-29 家族敲低后细胞侵袭能力降低75%(86±16 比361±24,P<0.05)(见图4B、C)。
讨 论
肿瘤细胞淋巴结侵袭是实体肿瘤恶性进展的重要标志之一,淋巴结转移的生物学过程涉及肿瘤抑制基因的缺乏和突变[12]。研究表明PTEN 的缺乏和突变参与了胃癌、结直肠癌、胰腺癌的淋巴结转移[13-15]。但PTEN 突变在NSCLC 和SCLC 中的发生频率较低,在24%~44%的NSCLC 中检测到PTEN蛋白表达缺失[16]。本研究发现NSCLC 中无淋巴结转移肿瘤细胞中的PTEN 水平高于有淋巴结转移的患者,提示PTEN 表达缺失可能参与了NSCLC 细胞的淋巴结转移。

图2 miR-29 与PTEN mRNA 3’-UTR 相互作用情况
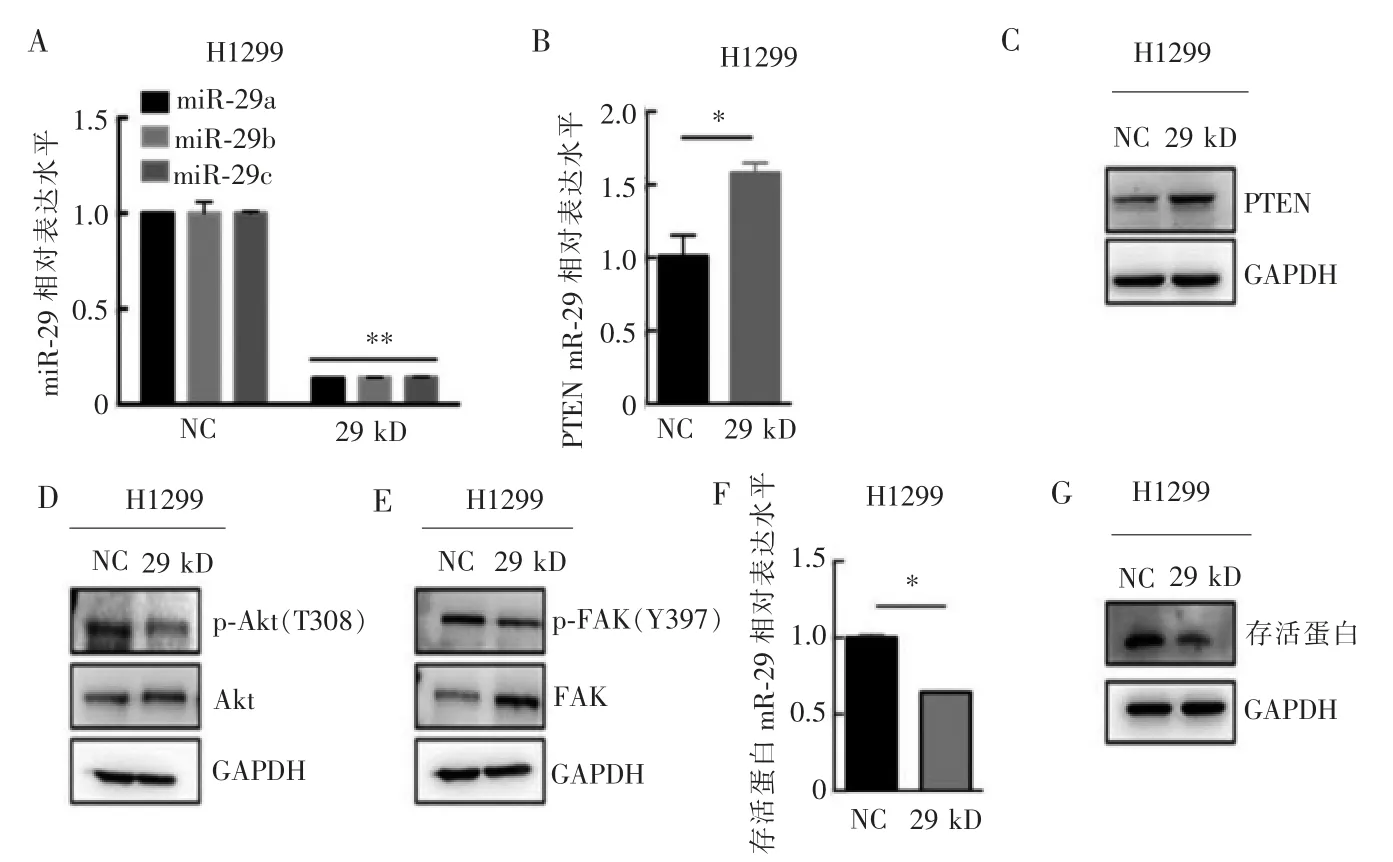
图3 敲低侵袭性H1299 细胞中miR-29 后对PTEN 磷酸酶活性的影响

图4 miR-29 对淋巴结侵袭性H1299 细胞增殖和侵袭的影响
在许多类型的癌症中已经观察到PTEN 被表观遗传沉默[16]。研究表明在多种肿瘤中PTEN 启动子中存在甲基化过高[17-18]。锌指转录因子sal 样蛋白4(sal-like protein 4,SALL4)通过募集表观遗传阻遏物复合物来抑制PTEN 转录(Mi-2/NuRD)[19],而组蛋白脱乙酰基酶抑制剂能够增加成纤维细胞中的PTEN 转录[20]。miRNA 和长链非编码RNA 通过RNA-RNA 相互作用调节PTEN 的表达[21]。研究表明miRNA,包括miR-205、miR-21 等在肿瘤细胞中升高与PTEN mRNA 的3’-UTR 结合导致PTEN mRNA 的降低[22-23]。因此,本研究通过Targetscan、miRanda 和Pictar 在线分析软件预测能与PTEN 3’-UTR 区域结合的miRNA,并通过实验验证了PTEN mRNA 是miR-29 家族的靶基因。同时用CRISPR Cas9 技术在淋巴结侵袭性NSCLC 细胞H1299 中敲低miR-29a/b/c,结果显示miR-29 家族敲低后,能恢复PTEN 的表达。
PTEN 是位于10 号染色体10q23 区的经典抑癌基因,编码403 个氨基酸的多功能蛋白,具有脂质和蛋白磷酸酶活性[4]。脂质磷酸酶活性体现在细胞质中,PTEN 将磷脂酰肌醇3 磷酸(phosphatidylinositol 3 phosphate,PIP3)去磷酸化为PIP2,从而逆转PI3K 的作用并阻碍Akt/哺乳动物西罗莫司靶蛋白(mammalian target of rapamycin,mTOR)轴控制的所有下游功能;蛋白磷酸酶活性主要是针对FAK的磷酸酶活性,逆转其磷酸化,抑制其控制的功能分子[4]。所以本研究检测了敲低miR-29 的H1299细胞中PTEN 的脂质和蛋白磷酸酶活性,发现抑制miR-29 后Akt 和FAK 的磷酸化程度都相应下调,且其共同下游分子存活蛋白的mRNA 及蛋白也显著下调。
miR-29 由miR-29a、miR-29b 和miR-29c 3 个成员组成[24],miR-29a 和miR-29b-1 在人类染色体7q32.3 上编码,称为miR-29a/b1 簇,而miR-29b2 和miR-29c 在1q32.2 染色体上,称为miR-29c/b2 群集[11]。miR-29 家族成员共享一个共同的7-nt 种子序列,但是每个miR-29 家族成员都有独特的序列功能特征[11]。尽管有研究显示miR-29 是一种抑癌基因,但也有关于miR-29 作为癌基因的报道[25]。miR-29a、miR-29b 和miR-29c 与PTEN 3’-UTR 区域结合的位点相同,提示在淋巴结侵袭性NSCLC 细胞下调家族中仅能部分恢复PTEN 的表达。因此,只有在淋巴结侵袭性NSCLC 细胞中将其都敲低,才能准确观察miR-29 对淋巴结侵袭性NSCLC 细胞功能及PTEN 下游分子的影响。在本研究中,同时干预三者能观察到PTEN 明显被恢复,且细胞的增殖与侵袭性被显著抑制。
总之,本研究发现淋巴结侵袭性NSCLC 细胞中miR-29 家族可直接下调PTEN 的表达,如干预miR-29 家族的表达不仅可恢复PTEN 的水平及活性,下调存活蛋白表达,也可逆转淋巴结侵袭性NSCLC 细胞的增殖和侵袭性(见图4D)。这些发现为通过靶向miR-29 家族恢复抑癌基因PTEN 的表达及活化,进而抑制NSCLC 细胞增殖和侵袭提供了有益的线索。

