体质量指数对系统性红斑狼疮患者心肌累及的影响
冯泽豪,柴烨子,苏 璇,孙宝航行,刘启明,姜 萌,卜 军
上海交通大学医学院附属仁济医院心内科,上海200127
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种常见于女性的自身免疫性疾病,可造成身体内多个脏器损伤,其中心肌纤维化是SLE 患者常见的心脏损伤,与快速性心律失常、猝死等心血管不良事件密切相关[1-2]。心脏累及导致的心源性死亡也是SLE 患者的主要死因之一[3]。体质量指数(body mass index,BMI)是衡量体质量状态的指标。肥胖(BMI≥30.00 kg/m2)与冠状动脉粥样硬化性心脏病、心力衰竭等的发生密切相关[4-6]。其他研究[7]也发现了BMI 与肿瘤、代谢性疾病等预后的相关性。除了心脏超声[8],近年来心脏磁共振(cardiac magnetic resonance,CMR)逐渐用于诊断多种类型的心肌病。由于CMR 的敏感度高并且可以通过结合多种序列分析组织特征,因此对发现SLE 患者的早期心脏累及非常重要[2]。既往研究[9]认为BMI升高并非SLE 致病的主要危险因素,但肥胖及腰围增加在国外人群的长病程SLE 患者中十分普遍,并与动脉粥样硬化密切相关[9-11]。结合CMR 技术研究不同BMI 水平的SLE 患者的心脏受累情况目前尚无报道。本研究旨在用CMR 技术探索不同BMI 水平的SLE 患者心脏累及程度,尤其是心肌纤维化水平的差异。
1 对象与方法
1.1 研究对象
纳入2014 年7 月—2016 年11 月于上海交通大学医学院附属仁济医院心内科收治的SLE 患者61 例(观察组),招募的健康志愿者24 例(对照组)。纳入标准:符合2012 年系统性红斑狼疮国际临床协作组(Systemic Lupus International Collaborating Clinics,SLICC)制定的临床分类标准[12]。排除标准:①年龄小于18 周岁或大于75 周岁。②合并有其他心脏疾病,如肥厚型心肌病、冠状动脉粥样硬化性心脏病等。③美国纽约心脏病学会(New York Heart Association,NYHA)心力衰竭程度分级大于Ⅳ级。④CMR 检查禁忌证:严重肝肾功能不全、幽闭恐惧、妊娠等。对照组纳入标准:①年龄18~75岁。②经心脏超声及实验室检查未发现心血管相关疾病。③CMR 增强检查未见明显异常。研究获上海交通大学医学院附属仁济医院伦理委员会批准(审批号:仁济伦审[2015]015K 号),并于临床试验数据库注册(注册号:NCT04297371)。所有受试者均签署知情同意书。
1.2 临床资料收集
入组后收集所有受试者的基线资料,包括身高、体质量等。参考Gallagher 等[13]的研究,BMI≤18.50 kg/m2为低体质量,18.51~24.99 kg/m2为正常,≥25.00 kg/m2为超重,≥30.00 kg/m2为肥胖。采用系统性红斑狼疮疾病活动 指 数2000 (Systemic Lupus Erythematosus Disease Activity Index,SLEDAI-2000)[14]对SLE 组患者的疾病活动性进行评分:≥5 分为狼疮活动期,<4 分为狼疮非活动期。抽取受试者血液,检查血常规、肝肾功能、心肌受损指标肌钙蛋白I(troponin I,TnI)、心力衰竭指标脑利钠肽(brain natriuretic peptide,BNP)。
1.3 仪器与方法
1.3.1 CMR 检查 使用Ingenia 3.0T MR (Philips,荷兰)完成所有受试者的CMR 检查。图像采集使用心电门控及呼吸门控。
(1)电影序列。评估受试者的心脏运动功能和形态,采集受试者的两腔、三腔、四腔长轴及覆盖心底至心尖的多层面短轴图像。序列参数:视野300 mm×300 mm,体 素0.875 mm×0.875 mm×7 mm,重复时间(time of repetition,TR)=3.0 ms,回波时间(time of echo,TE)=1.5 ms,翻转角45°。
(2)T2 加权图像。心电门控触发的短时间反转恢复T2 加权多层自旋回波序列(T2 short inversion-time inversion recovery,T2-STIR)。序列参数:TR=2×RR 间期;TE=83 ms,翻转角160°,层厚7 mm。
(3)延迟钆增强序列。局灶性心肌纤维化评估,在静脉内注入0.15 mmol/kg 马根维显(Bayer Healthcare,加拿大)后10~15 min,在短轴层面下进行扫描。采用舒张中期IR 的二维梯度回波序列。序列参数:视野300 mm×300 mm,体素0.875 mm×0.875 mm×7 mm,TE=1.13 ms,TR=3.3 ms,翻转角25°。
1.3.2 CMR 图像后期处理 所有图像采集均由3 位具有3 年以上CMR 工作经验的心内科及放射科医师完成,信息经过脱敏处理后由2名经过培训的医师处理。采用专业CMR 图像后期处理软件(Circle Cardiovascular Imaging®5.5.6.1,美国)进行分析。左室容积测量使用短轴电影序列,选取心底至心尖多层面的收缩末期及舒张末期,勾画心内膜及心外膜,乳头肌纳入心肌中计算心肌质量。右室厚度测量在短轴电影序列中完成,测量方法为选取右室游离壁最厚处并选取最长垂直距离,右室肥厚定义与超声心动图一致[15],心肌厚度≥4 mm 诊断为右室心肌肥厚(right ventricular hypertrophy,RVH)。
1.3.3 二维经胸超声心动图 超声心动图在CMR 开始前1~2 d 完成,使用彩色多普勒超声诊断仪(LOGIQ E9;GE Healthcare,美国)采集和定量分析患者左室、右室功能以及肺动脉压。 测量肺动脉平均压(mean pulmonary artery pressure,PAPm),在胸骨旁大动脉短轴切面使用连续多普勒取样肺动脉返流频谱,测量舒张早期肺动脉瓣最大返流压差。静息状态下PAPm≥25 mmHg(1 mmHg=0.133 kPa) 时定义为肺高血压(pulmonary hypertension,PH)。
1.4 统计学方法
采用SPSS 22.0及R 3.4.1 软件进行数据处理和统计学分析。使用Shapiro-Wilk test 进行正态性检验。符合正态分布的定量资料用x±s表示,不符合正态分布的定量资料用M(Q1,Q3)表示。使用One-way ANOVA 方差分析、Kruskal-Wallis 非参数秩和检验和Nemenyi 检验比较多组间差异。使用协方差分析校正基线指标(年龄、疾病病程)对不同BMI 组间心脏指标差异的影响。定性资料用n(%)表示,使用χ2检验。T2-STIR 阳性率、RVH、PH发生率的BMI 分布特征,使用秩和检验及线性趋势χ2检验。变量间相关性检验使用Pearson 相关分析。使用分段线性回归及逐步回归对影响细胞外容积分数(extracellular volume fraction,ECV)升高的指标进行单因素及多因素分析。为明确活动及非活动期SLE 患者与正常人群的基线差异,以及进一步探究不同BMI 时SLE的心脏累积程度,采用以下分组进行研究:①健康对照组与SLE组。②SLE组内疾病活动组与非活动组。③SLE组内以BMI 的25%(18.72 kg/m2)、75%(23.00 kg/m2)百分位数为界分为3 组。④SLE 组内以BMI的25%、50%(20.20 kg/m2)及75%百分位数为界分为4 组。所有假设检验使用双尾检验,P<0.05表示差异有统计学意义。
2 结果
2.1 基线资料及临床指标比较
2 组情况如表1 所示。SLE 组61 例,对照组54 例,2组人群的年龄、性别比较差异无统计学意义,但对照组的BMI 中位数大于SLE 组患者,且差异有统计学意义(P=0.000)。SLE 组患者的TnI(P=0.000)及BNP(P=0.018)明显高于对照组,临床特征如吸烟、高血压及心功能分级与对照组相比,差异无统计学意义。61 例SLE患者中,27例为新发患者未用药,其余34例用药。
2.2 心脏影像学指标比较
2 组的心脏影像学指标比较见表2。与对照组比较,SLE 组左室射血分数(left ventricular ejection fraction,LVEF) 及 右 室 射 血 分 数(right ventricular ejection fraction,RVEF)明显降低(P=0.006,P=0.000),同时左室ECV 明显升高(P=0.000)。SLE 组左室心肌质量比对照组大,且差异有统计学意义(P=0.000),其他左室形态指标差异无统计学意义。SLE 组的右室形态指标与对照组相比有较大差异,主要为右室收缩末期容积增加,且差异有统计学意义(P=0.000)。
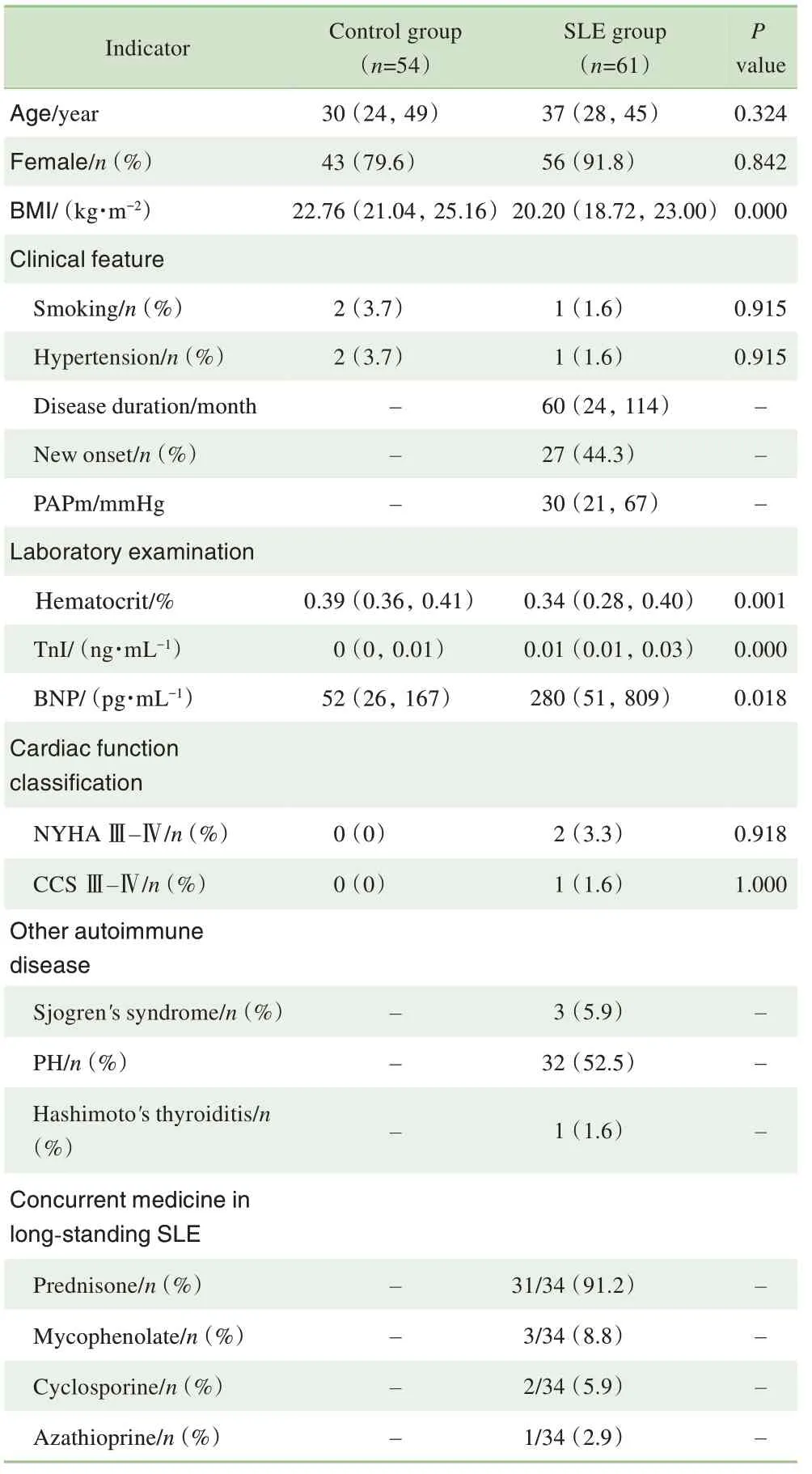
表1 SLE组及对照组人口学资料及临床指标比较Tab 1 Comparison of demographic data and clinical indicators between SLE group and control group
2.3 SLE患者疾病活动状态与心肌损伤的关系
SLE 组中,长病程患者与新发患者不同疾病活动状态下各指标的比较结果见表3。处于疾病活动期及非活动期的临床与心脏影像指标差异无统计学意义。新发SLE患者,活动期的肌酸激酶同工酶(creatine kinase-MB,CK-MB) 及BNP 比非活动期明显升高(P=0.023,P=0.043),活动期的右室心肌整体径向应变比非活动期明显降低(P=0.027),提示亚临床状态右心功能受损。
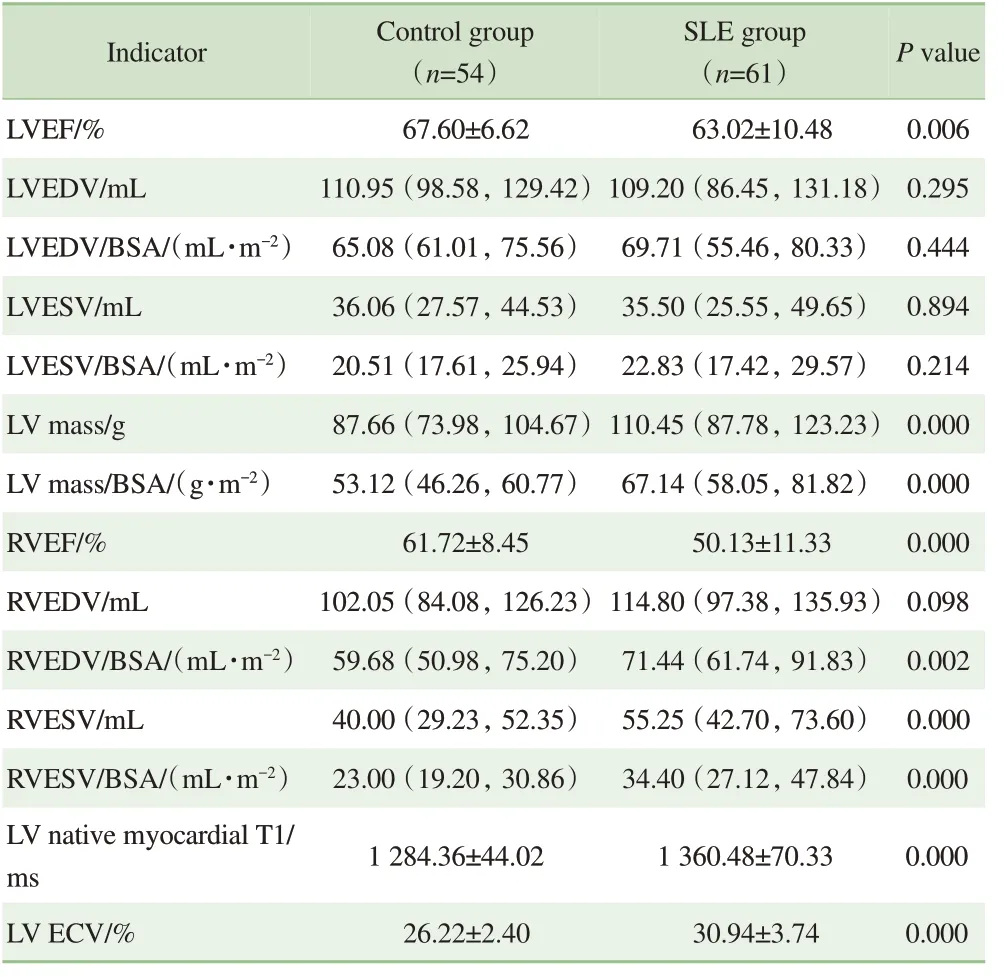
表2 SLE组及对照组的心脏影像学指标比较Tab 2 Comparison of cardiac imaging indexes between SLE group and control group
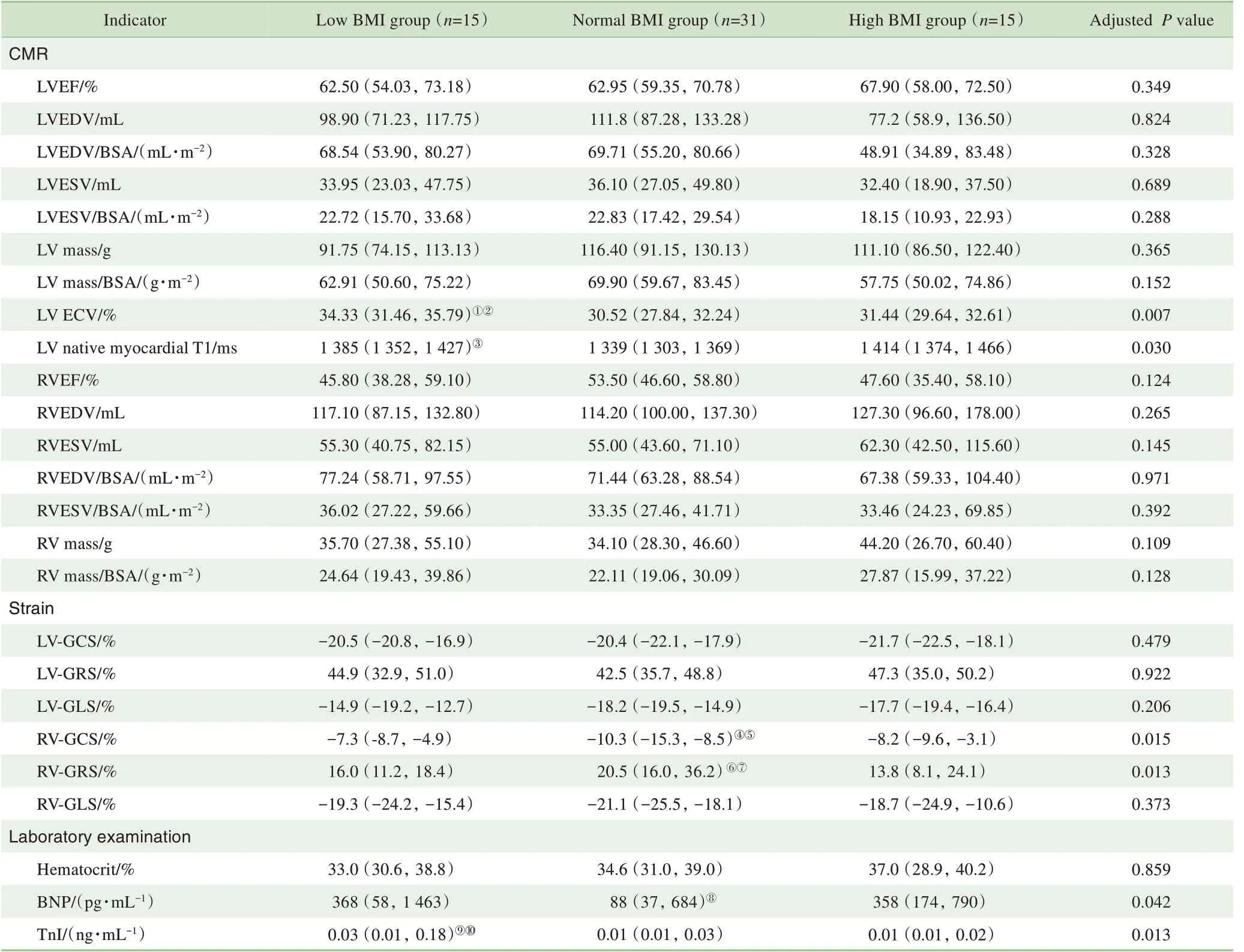
2.4 不同BMI的SLE患者CMR及实验室指标比较
将61例SLE患者以BMI的百分位数25%(18.72 kg/m2)和75%(23.00 kg/m2)为界分为3 组:≤18.72 kg/m2为低BMI 组(low BMI group,n=15),18.73~23.00 kg/m2为正常BMI组(normal BMI group,n=31),>23.00 kg/m2为高BMI 组(high BMI group,n=15),进行组间比较,结果见表4。高BMI 组中BMI≥25.00 kg/m2的超重及肥胖患者7 例。校正年龄及疾病病程因素后,组间的新发病例数、左室增强前心肌T1 值和BNP 比较,差异有统计学意义(P=0.021,P=0.030,P=0.042)。在心肌应变指标中,3组SLE 患者的差异在右室,其中正常BMI 组的右室心肌应变最佳(P=0.015),而左室心肌应变3组间比较差异无统计学意义。
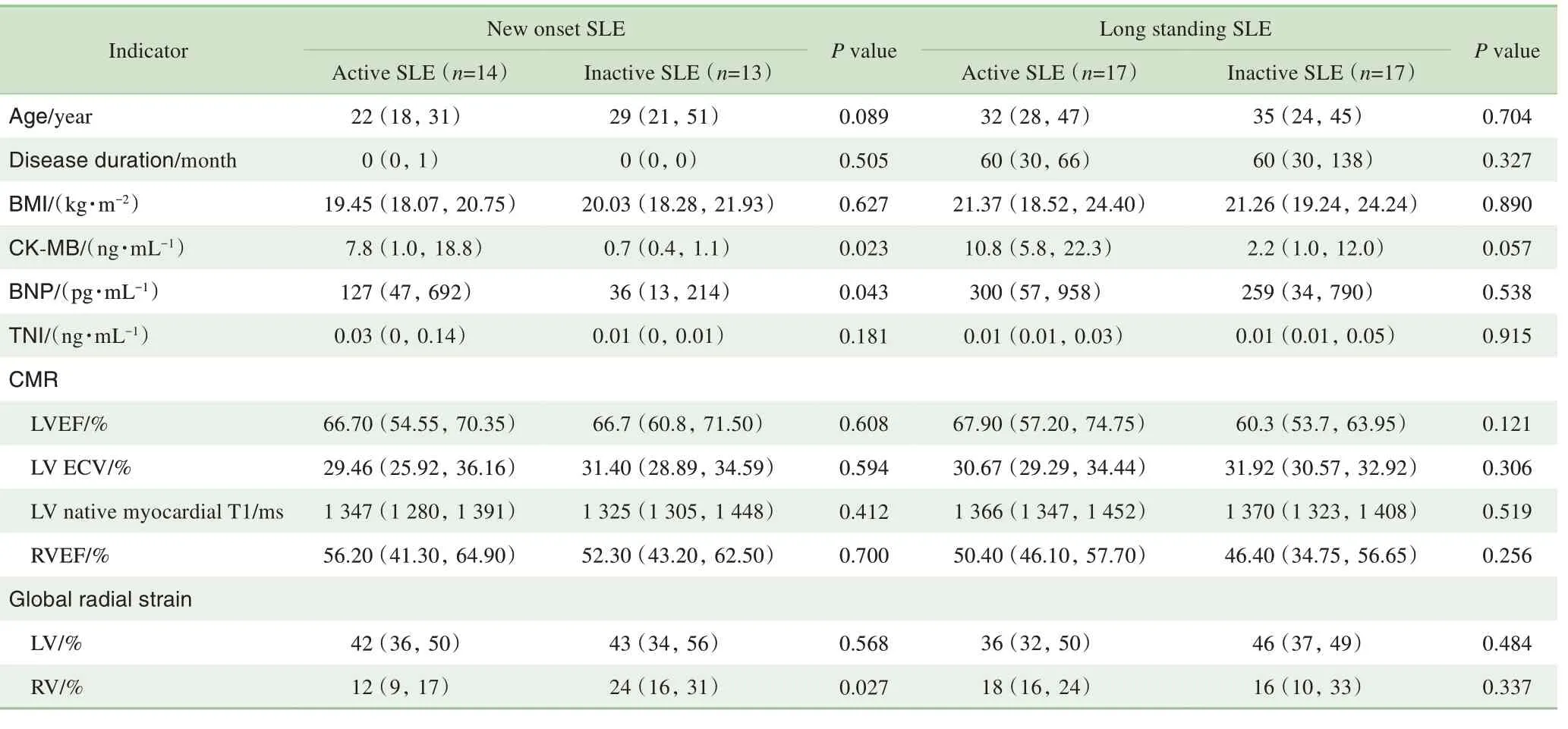
表3 SLE患者疾病不同活动状态的临床及影像指标比较Tab 3 Comparison of clinical and imaging parameters in different SLE disease activities
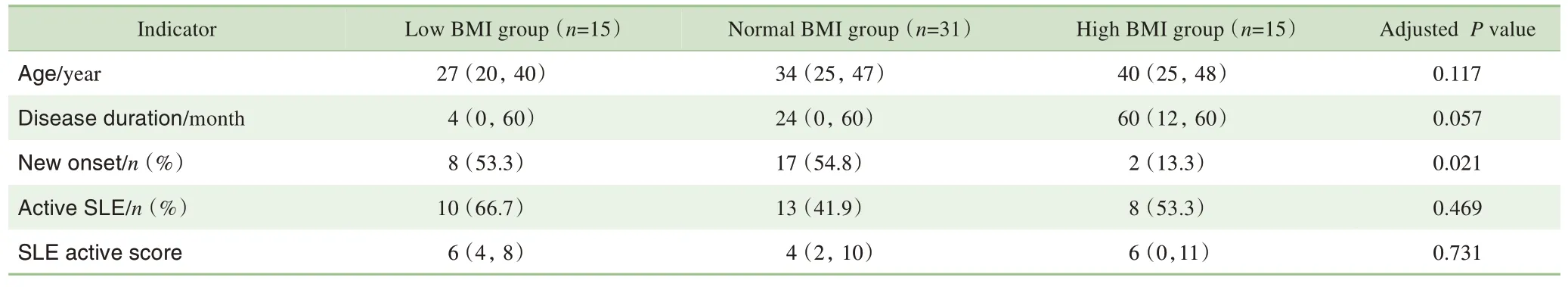
表4 3组不同BMI水平的SLE患者CMR指标比较Tab 4 Clinical and CMR characteristics of patients with SLE in the three BMI groups
Continued Tab
2.5 不同BMI 的SLE 患者PH、RVH 及心肌水肿发生率的比较
将61 例SLE 患者以BMI 的百分位数25%、50%(20.20 kg/m2)、75%为界分为4 组:≤18.72 kg/m2为低BMI 组(low BMI group,n=15),18.73~20.20 kg/m2为正 常 低 值BMI 组(low normal BMI group, n=15),20.21~23.00 kg/m2为正常高值BMI 组(high normal BMI group,n=16),>23.00 kg/m2为 高BMI 组(high BMI group,n=15),组间比较结果见图1。RVH 的发生率比较差异有统计学意义(P=0.013);随着BMI 的升高,RVH 的发生率逐渐升高(P=0.014);4 组SLE 患者的PH发生率比较差异无统计学意义,但在BMI>18.72 kg/m2的3 组患者中PH 发生率随着BMI 的升高而逐渐升高,且差异有统计学意义(P=0.011);心肌水肿发生率在4 组中的差异无统计学意义,且心肌水肿的发生率未随着BMI 的升高而升高。
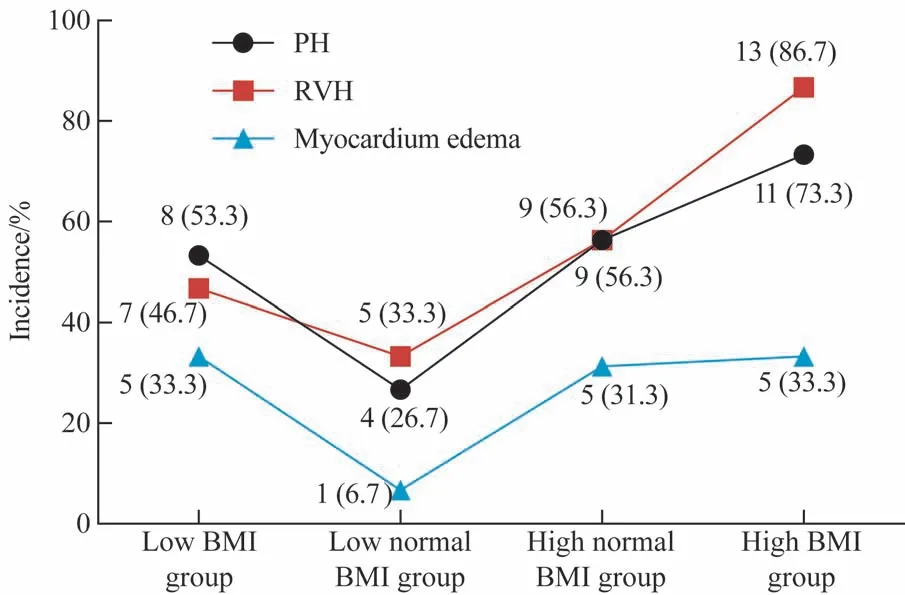
图1 不同BMI的SLE患者组间肺高血压、右室心肌肥厚及心肌水肿发生率比较Fig 1 Comparison of incidence of PH, RVH and myocardium edema of SLE patients in different BMI groups
2.6 SLE患者BMI与ECV的相关性
健康对照组的BMI 与LVEF、LVESV 及ECV 未见明显的线性关系,只与LVEDV 存在弱线性相关关系(r=0.366,P=0.007),结果见图2A。在SLE 患者中,长病程SLE 患者及新发SLE 患者的BMI 与ECV 分布差异:在长病程SLE 患者中,BMI≤23.00 kg/m2时,BMI与ECV 存在强负线性相关关系(r=−0.597,P=0.009);BMI>23.00 kg/m2时,BMI 与ECV 存在强正线性相关关系(r=0.739,P=0.023)。在新发SLE 患者中未发现ECV 与BMI 的线性相关关系,结果见图2B。

图2 健康对照组及SLE组BMI与ECV的相关性Fig 2 Correlation between BMI and ECV in control and SLE group
2.7 影响SLE患者左室ECV改变的单因素及多因素线性回归分析
使用分段回归以BMI=23.00 kg/m2为界值将SLE 组分为2 组。对于BMI≤23.00 kg/m2的患者,在多因素线性回归分析中,将ECV 作为因变量,校正年龄、性别、疾病病程、免疫抑制剂使用及肺动脉压后,发现BMI 是ECV升高的独立预测因素(β=-0.457,P=0.006),随着BMI升高ECV逐渐降低。对于BMI>23.00 kg/m2的患者,随着BMI 升高ECV 也逐渐升高(β=0.766,P=0.001)。同时免疫抑制剂的使用在BMI>23.00 kg/m2的患者中与ECV 升高密切相关(β=0.534,P=0.004),结果见表5。
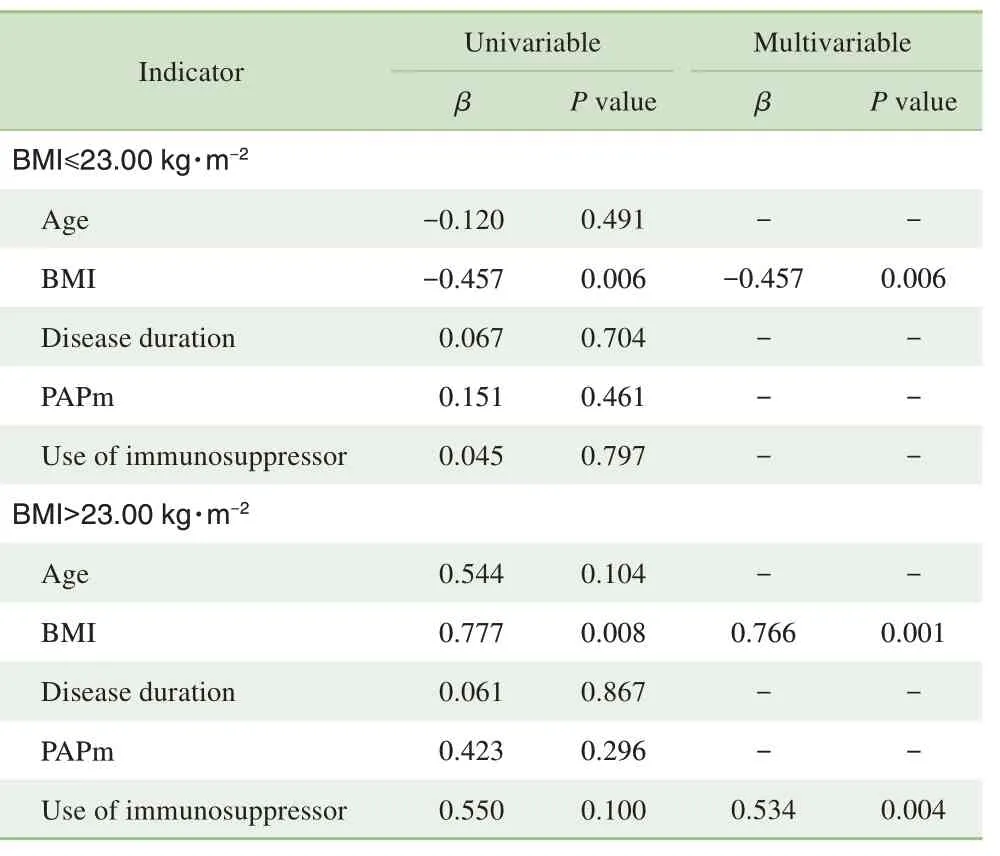
表5 SLE组各指标与左室ECV的单因素及多因素线性回归分析Tab 5 Univariable and multivariable linear regression analysis of clinical features and ECV
3 讨论
本研究结果提示,低体质量SLE 患者ECV、增强前心肌T1 值及实验室指标高于正常及超重SLE 患者。不同BMI 水平的SLE 患者PH、RVH 及心肌水肿发生率不同,发生率整体随BMI 升高而升高;当BMI 介于18.73~20.20 kg/m2时,SLE 患者3 种常见心血管疾病及损伤发生率最低。长病程SLE 患者的ECV 与BMI 指数存在强相关性,但在新发患者中未观察到相关性。在校正混杂因素后,BMI≤23.00 kg/m2时SLE 患者的ECV 随BMI 升高而降低,BMI>23.00 kg/m2时SLE患者的ECV随BMI升高而升高。
从目前结果可知低体质量相比于超重及肥胖在SLE患者中更为常见。虽然目前BMI 与心血管相关风险的研究多集中于Ⅰ~Ⅱ级肥胖[5,11,16],但在自身免疫性疾病患者中低体质量的危害同超重及肥胖一样值得重视。本研究中低体质量SLE 患者的PH、RVH 及心肌水肿的发生率都明显高于正常体质量患者。而BMI为18.73~20.20 kg/m2患者的RVH发生率最低,虽然PH及心肌水肿发生率差异无统计学意义,但仍可以看到存在明显的升高趋势,考虑可能与样本量较小有关。进一步分析可以发现BMI≤18.72 kg/m2组的多是新发患者,BMI>18.72 kg/m2组的多为经过治疗的长病程患者;新发患者大多处于SLE活动期,较差的机体指标及营养水平可表现为较低的BMI 水平。然而随着治疗尤其是激素的使用,患者病情趋于稳定,BMI逐步回升,在一定程度上有益于心脏影像学指标的好转。然而疾病的转归以及药物的使用都在不断损伤包括心脏在内的多个靶器官,因此BMI 升高成为了宏观的心肌纤维化危险因素。但是,本研究针对ECV 这一常见的心肌纤维化指标在校正了年龄、疾病病程等混杂因素后,在长病程SLE 患者中仍可见到不同BMI 组间的ECV 差异,提示心肌纤维化与疾病是否新发及病程长短无关,存在着一种与BMI 相关的独立心肌损伤机制,同时心肌纤维化损伤和BMI并不是简单的线性关系。SLE患者中BMI对不同心血管累及(如心肌纤维化、心肌肥厚等)从保护因素到危险因素的转变受到了多种协变量的影响。干预BMI 是否会逆转或者延缓心肌损伤还需要进一步探究。
在心衰患者中也存在类似的“肥胖矛盾”改变[16],即在已经发生心血管事件的患者中,BMI的升高是心力衰竭的保护因素。Powell-Wiley 等[17]的研究发现,在射血分数保留的患者中,当BMI逐步升高到30 kg/m2时对患者30 d 内全因死亡是一种保护性因素(HR=0.96),超过30 kg/m2时则成为小的危险因素(HR=1.01),而在射血分数降低的患者中则没有这种U型增长趋势。既往对于SLE的心脏累及研究[11]大多集中于吸烟、肥胖等对SLE 患者的影响,忽视了对极低BMI、BMI变化趋势以及是否为新发病例的进一步讨论。但是近期已有研究者[2]发现未用药的SLE新发患者的BMI水平较低且出现了早期心脏改变。
本研究的局限:①样本量过小。②缺少对于SLE 合并Ⅱ~Ⅲ级肥胖症的患者的心脏累及的进一步分析。③新发病例数较少,缺少对新发病例及BMI 关系的进一步探究。④缺少SLE中不同BMI的预后结果。
综上所述,低BMI SLE 患者的心脏损伤需要被倍加关注,积极的体质量管理将BMI 维持于正常水平并避免超重能有助于患者的心肌保护,但其与预后的关系需要进一步研究。

