木醋液对辣椒种子萌发及其抑菌作用的影响研究
杜佳燕,武菊平,王婧瑶,耿丽平,李博文,刘文菊
(河北农业大学 资源与环境科学学院/河北省农田生态环境重点实验室,河北 保定 071000)
木醋液是由不同种类的炭材(农林废弃物)在一定温度下热解得到的棕褐色液体,pH 在2 ~4 之间,包括500 多种组分,如有机酸、酮、酚、醇和微量元素等[1-2]。作为活性炭制备的副产品,为实现废弃物资源再利用,木醋液被广泛应用于农业、林业、畜牧业、化工、食品加工与医药卫生,尤其是在农业方面应用,木醋液可作为植物生长调节剂促进种子发芽和幼苗生长、植物源农药可防治病虫害、土壤改良剂可修复盐渍化土壤[3-7]。在植物种子萌发阶段以及植物体生长期间,使用适宜浓度的木醋液可以促进植物的生长发育[8-14]。同时,木醋液中含有的多种酚酸类物质会对微生物的生长产生抑制作用,其杀菌性具有广谱性。研究表明木醋液对多种细菌和真菌均有抑制效果[15-18]。但是,不同原料产生的木醋液的组分存在差异,其促生效应和抑菌作用也不尽相同。此外,木醋液组成成分复杂多样,含有的木焦油等有害物质可能会对植物生长产生不利影响。本研究采用的木醋液是河北承德华净活性炭有限公司生产杏核活性炭的副产品,为了将此副产品应用于农业,以实现废弃物的资源化利用,因此,急需探索该类型木醋液的农业可利用性及合理 使用方法。
基于此,本试验主要通过炭吸附过滤[18-19]和稀释2 种方式,研究木醋液对辣椒种子的发芽率和幼苗生长的影响,确定木醋液浸种的适宜浓度。然后,将促生效果最佳浓度的木醋液加入培养基中,探究该浓度的木醋液对有益菌:枯草芽孢杆菌和巨大芽孢杆菌生长的影响,以及对辣椒枯萎病病原菌:尖孢镰刀菌专化型Ⅰ、尖孢镰刀菌专化型Ⅱ、尖孢镰刀菌专化型Ⅲ和尖孢镰刀菌专化型Ⅳ4 种病原真菌的抑菌作用,为木醋液的农用可行性提供数据支撑。
1 材料与方法
1.1 供试材料
1.1.1 木醋液对辣椒种子的影响
(1)供试辣椒品种:‘中樱一顶三’,购于河北省保定市农资市场。
(2)木醋液和生物炭:由河北承德华净活性炭有限公司提供。
(3)活性炭:购于福晨化学试剂厂。
1.1.2 木醋液的抑菌作用
(1)供试菌种:有益细菌:枯草芽孢杆菌、巨大芽孢杆菌;病原真菌:选用辣椒枯萎病的转化病原菌,包括尖孢镰刀菌的辣椒专化型Ⅰ、专化型Ⅱ、专化型Ⅲ、专化型Ⅳ。
(2)供试培养基:巨大芽孢杆菌液体培养基:蔗糖10. 0 g,KCl 0.3 g,NaCl 0.3 g,MgSO4·7H2O 0.3 g,(NH4)2SO40.5 g,FeSO4·7H2O 0.03 g,MnSO4·4H2O 0.03 g,酵母粉1.0 g,CaCO32.0 g,蒸馏水1 000 mL,pH 7.0 ~7.5;枯草芽孢杆菌液体培养基:胰蛋白胨 10.0 g,酵母粉5.0 g,NaCl 10.0 g,蒸馏水1 000 mL,pH 7.0 ~7.5;巨大芽孢杆菌和枯草芽孢杆菌固体培养基:牛肉膏5.0 g,蛋白胨 10.0 g,NaCl 5.0 g,琼脂15 ~20.0 g,水1 000 mL,pH 7.0 ~7.2;病原真菌的培养基:PDA 培养基。
1.2 试验设计
1.2.1 木醋液对辣椒种子萌发的影响
(1)木醋液原液处理:木醋液原液经滤纸过滤后再用0.22 μm 滤膜过滤(标记为W);木醋液原液加入5%生物炭(木醋液和生物炭同为华净公司生产活性炭的副产品),振荡10 min 后静置2 h,滤纸过滤后再用0.22 μm 滤膜过滤(标记为BW);木醋液原液加入5%活性炭后与BW 进行相同操作(标记为AW)。然后,将以上3 种木醋液用无菌水分别稀释0、100、250、500 倍,并以无菌水作为发芽率的对照(CK)。
(2)辣椒种子的处理:将辣椒种子浸在55 ℃左右的热水中消毒15 min,然后将其放入上述经过处理的木醋液中浸泡2 h,并以无菌水作对照,然后取出冲洗干净备用[19]。取2 层滤纸平放入培养皿中加入2 mL 无菌水将滤纸湿润,将浸种处理后的辣椒种子均匀放在滤纸上,每皿40 粒,每个处理设4 次重复,将培养皿放入培养箱中30 ℃培养14 d。
自种子发芽的第1 天起每天记录发芽数,以第7 天发芽的种子数计算发芽率、发芽指数。发芽率(%) = 发芽种子数/ 供试种子总数×100%;发芽指数(GI)=∑Gt/Dt,式中,Dt 表示相应的发芽天数; Gt 表示第 t 天发芽的种子数。培养至第14 天时用精度为 1 mm 的直尺直接测量幼苗的根长和芽长,计算相对幼苗高度(RSH)和根耐性指数(RTI)。相对幼苗高度(RSH,%)= 处理芽长/ 对照芽长×100,根耐性指数(RTI,%)= 处理根长/ 对照根长×100[20-21]。
1.2.2 木醋液的抑菌作用
(1)有益细菌:从活化后2 d 的固体平板上挑1 环细菌于100 mL 液体培养基中,180 r/min,30 ℃摇瓶培养48 h 得到菌悬液,用无菌水稀释106倍。设置5 个处理:培养基+菌(CK),培养基+木醋液(T1),培养基+木醋液+菌(T2),培养基+灭菌木醋液(T3),培养基+灭菌木醋液+菌(T4),每个处理6 个重复。在培养基上分别接入200 μL的枯草芽孢杆菌、巨大芽孢杆菌的菌悬液(稀释至10-6倍)均匀涂布后于30 ℃恒温培养箱中倒置培养48 h,记录每个培养皿中菌落的个数。
(2)病原真菌:配制含0.4%木醋液的PDA 培养基(即用培养基将木醋液稀释250 倍),分别设置3 个处理:培养基+菌(CK),培养基+木醋液+菌(T1),培养基+灭菌木醋液+菌(T2),每个处理6 个重复。分别在活化后的4 种尖孢镰刀菌菌落打取直径8 mm 的菌饼,反接入上述培养基平板,于30 ℃恒温培养箱中培养5 ~7 d,待其菌落直径生长至平板直径三分之二时用十字交叉法取菌落直径(cm)。
1.3 数据处理
试验数据用Microsoft Excel 2016 进行整理,SPSS 22.0 进行方差分析。
2 结果与分析
2.1 木醋液对辣椒种子萌发和幼苗生长的影响
2.1.1 木醋液对辣椒种子萌发的影响 辣椒种子用经过处理的木醋液浸种培养后种子发芽率的变化如图1 所示。结果显示,无菌水浸种的对照辣椒种子发芽率为88.33%,未经任何处理的木醋液原液浸种后辣椒发芽率显著降低了14.15%,这说明木醋液原液直接浸种会降低辣椒种子的发芽率;木醋液原液经生物炭和活性炭处理后辣椒种子发芽率与对照相比差异不显著,但是与木醋液原液浸种相比分别增加了8.80%和19.78%,说明生物炭和活性炭处理可除去木醋液中对辣椒种子发芽有抑制作用的成分。
对于未经处理的木醋液和经生物炭处理的木醋液来说,稀释100、250、500 倍浸种均可显著提高辣椒种子的发芽率,分别比未稀释木醋液浸种后发芽率提高21.98%~28.58%和13.13%~15.15%;稀释100、250、500 倍的经活性炭处理的木醋液浸种后辣椒种子发芽率也均高于未稀释处理,但仅有稀释250 倍时差异达到显著性水平,增幅为6.43%,说明稀释后的木醋液浸种可以促进辣椒种子萌发。
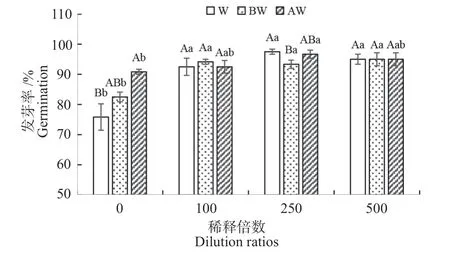
图1 木醋液对辣椒种子发芽率的影响Fig.1 Effects of wood vinegar on germination rates of chili pepper seeds
表征种子萌发的另外一个指标是发芽指数。从表1 可以看出经生物炭和活性炭处理的木醋液原液浸种后辣椒种子发芽指数显著高于未处理原液,分别比未稀释的木醋液原液高85.80%和112.93%,但无菌水浸种的发芽指数为62.79,未稀释时仅有经活性炭处理的木醋液浸种后的发芽指数高于对照。无论是木醋液原液还是经生物炭和活性炭处理的木醋液稀释100、250、500 倍浸种后辣椒种子的发芽指数均高于对照,增加幅度为2.44%~13.06%,且稀释250 倍的木醋液原液浸种时发芽指数达到最大。

表1 木醋液对辣椒种子发芽指数的影响Table 1 Effects of wood vinegar on germination index of chili pepper seeds
2.1.2 木醋液对辣椒幼苗生长的影响 植株幼苗地上部的生长情况一般情况下采用相对幼苗高度(RSH)来表示[20],可以表征木醋液浸种后对辣椒幼苗芽长生长的影响,从图2 可以看出随着稀释倍数的增加,相对幼苗高度随之增加。采用未稀释的木醋液原液(无论是炭处理还是未经炭处理)浸种对辣椒幼苗高度产生了抑制作用,但稀释100 倍、250 倍和500 倍均的木醋液浸种后均可提高相对幼苗高度。此外,稀释100 倍时生物炭和活性炭处理的木醋液与未处理的木醋液相比促进了幼苗生长 (P <0.05),增加幅度为19.47%和16.81%;因此,无论是否经炭处理的木醋液原液都不宜直接使用,对辣椒幼苗生长有抑制作用,稀释100、250、500 倍的木醋液均可促进幼苗生长。
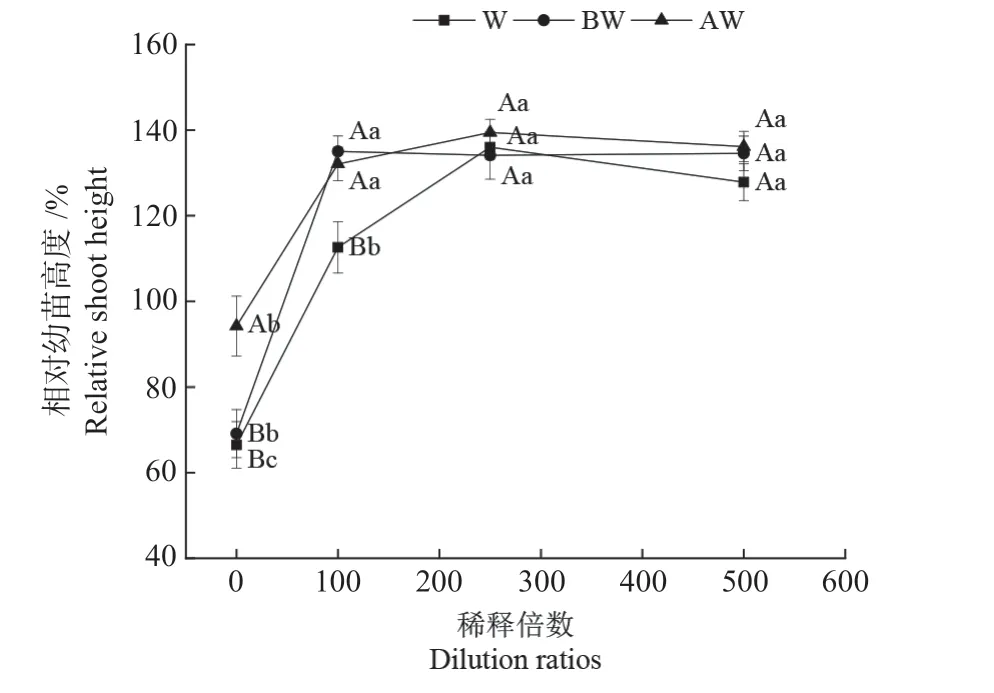
图2 木醋液对辣椒相对幼苗高度的影响Fig.2 Effects of wood vinegar on relative shoot height of chili pepper
植株幼苗地下部的生长情况一般情况下采用根耐性指数(RTI)来表示[21],可以表征不同木醋液浸种后对辣椒幼苗根系伸长的影响。由图3 可以看出,随着木醋液稀释倍数的增加,辣椒幼苗根耐性指数呈现增加的趋势,在250 倍后趋于稳定。采用未稀释的木醋液原液和经生物炭处理的木醋液原液浸种对辣椒根耐性指数产生了抑制作用,经活性炭处理的木醋液原液和稀释100 倍、250 倍和500倍的木醋液(无论是否经炭处理)浸种后均可提高幼苗根耐性指数。稀释250 倍时未处理的木醋液比经生物炭和活性炭处理的木醋液浸种促进了辣椒根系的伸长(P <0.05),增加幅度为15.60% 和46.98%;因此未稀释的经活性炭处理的木醋液和稀释100、250、500 倍的木醋液(无论是否经炭处理)浸种均可促进辣椒幼苗根系伸长,但稀释250 倍的木醋液原液促进根系生长的效果最好。
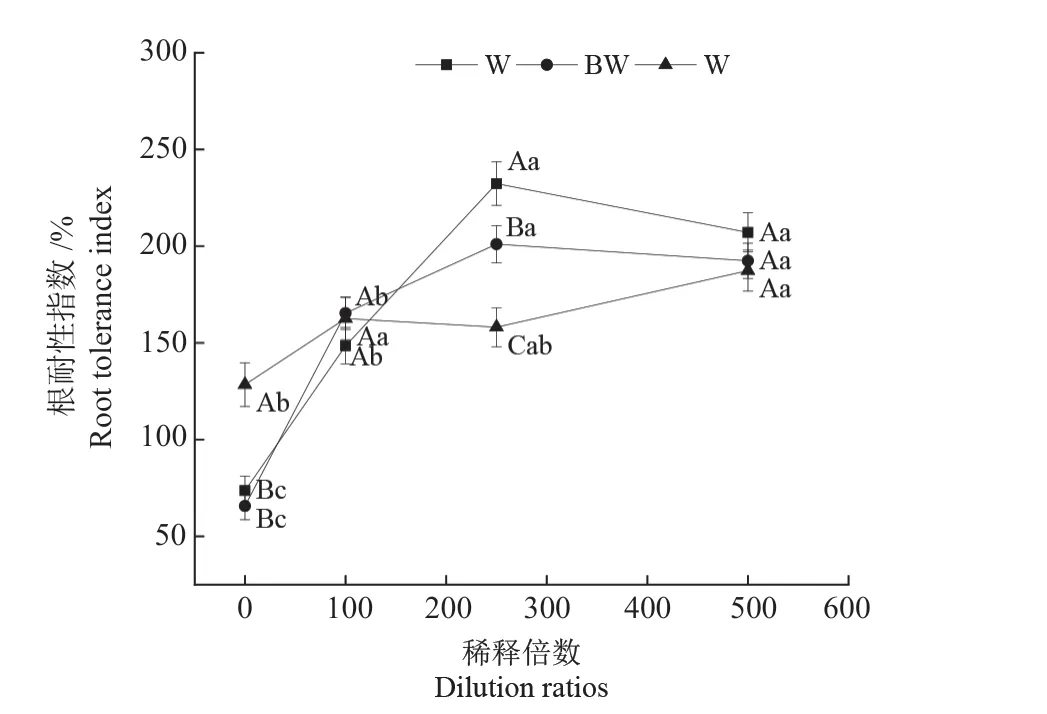
图3 木醋液对辣椒根耐性指数的影响Fig.3 Effects of wood vinegar on root tolerance index of chili pepper
2.2 木醋液的抑菌作用
2.2.1 木醋液对有益细菌生长的影响 枯草芽孢杆菌具有很强的抗菌和抗逆能力,可以活化土壤养分、防止土壤板结,对植物生长产生促进作用[22-23]。图4是培养基中加入木醋液后枯草芽孢杆菌有效活菌数的变化,经过48 h 培养后,与不含木醋液的对照相比,加未灭菌木醋液的培养基和加灭菌木醋液的培养基上生长的菌落数量均显著增加,增幅分别为233.93%和520.55% (P <0.05);加灭菌木醋液的培养基菌落数量与加未灭菌木醋液的相比,枯草芽孢杆菌数量显著增加了85.83% (P <0.05),这说明稀释250 倍的木醋液对枯草芽孢杆菌的生长有促进作用。
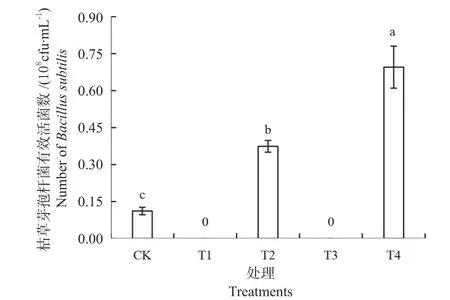
图4 木醋液对枯草芽孢杆菌有效活菌数的影响Fig.4 Effects of wood vinegar on the number of Bacillus subtilis
巨大芽孢杆菌可以分解土壤中的难溶磷,使其转化为能被植物吸收和利用的磷,从而促进植物的生长[24]。图5 是培养基中加入木醋液后巨大芽孢杆菌有效活菌数的变化,培养48 h 后,与不添加木醋液的对照相比,加未灭菌木醋液的培养基和加灭菌木醋液的培养基菌落数量均增加,分别增加了46.67%和24.44%,但差异未达到显著水平。
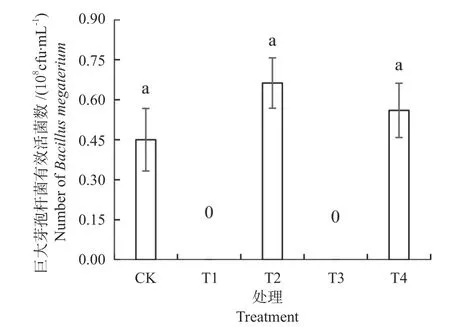
图5 木醋液对巨大芽孢杆菌有效活菌数的影响Fig.5 Effects of wood vinegar on the number of Bacillus megaterium
由此可见,稀释250 倍的木醋液对巨大芽孢杆菌的生长没有明显影响。
2.2.2 木醋液对病原真菌生长的影响 尖孢镰刀菌是对植物危害严重的病原菌之一[25]。表2 为培养基中添加木醋液对尖孢镰刀菌菌落直径的影响。从表中可以看出,加入稀释250 倍的未灭菌木醋液的培养基中,尖孢镰刀菌专化型Ⅰ和尖孢镰刀专化型Ⅲ的菌落直径与对照菌落直径相比差异不显著,但是尖孢镰刀菌专化型Ⅱ和Ⅳ的菌落直径显著减少,降幅分别为5.27%和6.23% (P<0.05)。稀释250 倍的灭菌木醋液对4 种尖孢镰刀菌菌落直径与对照相比差异均不显著,这说明木醋液对尖孢镰刀菌具有一定的抑菌性,但木醋液中的抑菌活性物质可能在灭菌过程中发生分解,造成其抑菌活性降低。
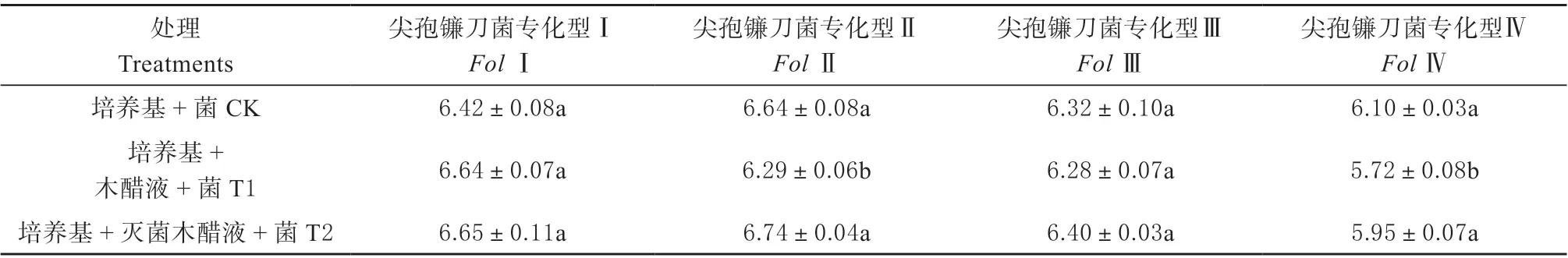
表2 木醋液对尖孢镰刀菌菌落直径的影响Table 2 Effects of wood vinegar on the colony diameters of Fusarium spore
3 讨论与结论
种子萌发是种子植物生活史中的重要阶段, 是种子植物栽培群体构建的重要时期,直接关系到植物的出苗情况[26]。本试验结果表明,未经稀释的木醋液直接浸种会对种子的萌发产生抑制作用,经生物炭和活性炭处理后其抑制作用会减弱,且活性炭效果更好。无论木醋液是否经炭处理,稀释100、250、500 倍后浸种均可以促进辣椒种子的萌发,但稀释250 倍时效果最好。已有的研究也发现,用不同浓度的木醋液浸泡茄子种子,稀释200 ~400 倍是刺激种子发芽的最佳剂量范围[17]。
本试验结果表明枯草芽孢杆菌和巨大芽孢杆菌两种有益细菌对木醋液的敏感程度不同,因此,稀释250 倍的木醋液对2 种有益细菌的生长产生了不同的效果。稀释250 倍的木醋液对巨大芽孢杆菌和枯草芽孢杆菌均无抑制效果,反而可以促进枯草芽孢杆菌的生长,与胡瑞瑞等[27]的结果不一致,其研究结果显示木醋液对枯草杆菌有显著的抑制效果,可能的原因,一是2 个试验所用枯草芽孢杆菌的菌株不同,二是由于2 个试验所用木醋液的生产原料不同,从而导致木醋液的成分存在差异,三是2 个试验对木醋液的稀释倍数不同。本试验所用木醋液浓度较低,故对枯草芽孢杆菌和巨大芽孢杆菌无抑制作用。但是,稀释250 倍的木醋液对病原菌尖孢镰刀菌的一些专化型的生长产生了抑菌作用。目前没有检索到木醋液对尖孢镰刀菌的抑菌效果研究,但已有研究表明木醋液对一些其他病原真菌有明显抑制作用[28-30]。
综上所述,木醋液稀释250 倍对辣椒种子萌发和幼苗生长有促进作用,且促进了枯草芽孢杆菌的生长,但对一些辣椒专化型病原菌产生明显抑制作用。

