黄翅土白蚁肠道纤维素降解菌的分离与鉴定
陈慧颖 马石霞
(西北民族大学 生命科学与工程学院 甘肃兰州 730124)
肠道微生物区系是大多数动物体内不可或缺的组成部分,它影响一系列生物功能,包括生长发育、营养、繁殖、消化、免疫和信息素产生[1,2]。在这些微生物中,细菌是昆虫肠道内微生物群的重要组成部分,其中一些细菌还与其他微生物及其宿主形成共生关系。昆虫的消化道在形态和物理、化学上的性质影响了内源微生物群落结构[3-5]。这类肠道微生物还有待进一步的研究和开发。白蚁幼虫以新鲜或分解的植物材料为食,肠道微生物以具有高度多样性的细菌群落和发酵物为主。
在本研究中,以植物纤维为食的黄翅土白蚁作为昆虫源,用于分离和表征肠道纤维素降解细菌。
1 材料和方法
1.1 收集和解剖
黄翅土白蚁采自河南南阳的地瓜田,保存在装有无菌土壤的塑料容器(200 mL)中。用70%乙醇灭菌的地瓜块茎喂养白蚁。解剖前,将10 只白蚁饥饿24 h 以清理肠道,然后用70%乙醇进行表面灭菌以去除所有污染物。随后,在无菌蒸馏水中洗涤并风干1 min。
1.2 培养基
所有化学品都是购自北京索莱宝生物科技有限公司。营养培养基:3 g 牛肉膏、5 g 蛋白胨、5 g NaCl、20 g 琼脂和1 000 mL蒸馏水。羧甲基纤维素培养基(CMC培养基):15 g CMC-Na、1 g NH4NO3、1 g 酵母膏、0.5 g MgSO4·7H2O、1 g KH2PO4和蒸馏水1 000 mL。两种培养基经121 ℃灭菌20 min,固体培养基加1.5%琼脂。糖发酵试剂盒购自上海威正翔禹生物科技有限公司。
1.3 纤维素分解细菌的分离和筛选
在无菌条件下切开内脏放入9 mL 无菌蛋白胨水中,涡旋匀浆,并按1:10 进行稀释,然后划线接种于无盐培养基,分离单菌落,再采用营养培养基进行纯种培养。用8 mm 无菌圆形木塞在CMC 固体培养基轻轻压出培养孔,将0.1 mL细胞培养液接种于圆孔中心,在30 ℃孵育48 h,然后加入0.1%刚果红溶液孵育15 min,再用1 M NaOH 浸泡10 min,每个孔周围产生的透明区域表明纤维素降解。分离菌的纤维素分解指数通过以下方法测定。
纤维素分解指数=(透明区域直径-培养孔直径)/培养孔直径。
1.4 16 S rDNA 的提取及PCR 扩增
目的纤维素分解细菌培养物以8 000 g 离心6 min,弃去上清液。用细菌基因组DNA提取试剂盒提取DNA。采用通用引物16 S 5’-TGGTAGTCCACCCCCCTAAAC-3’和5’-CTGGAAAGTCCGTGGAGT-3 从基因组DNA 中扩增16 S rRNA。PCR 反应体系为:10 μL DNA, 1×Taq Buffer, 1.25 mM MgCl2, 0.5 mM dNTPs, 0.5 mM 引物,AND 0.1U of Taq DNA polymerase。热循环条件是在94 ℃下初始变性5 min,在94 ℃下变性30 s,在50 ℃下退火30 s,在72 ℃下引物延伸1 min,在72 ℃下最终延伸10 min。聚合酶链反应产物采用1% w/v 琼脂糖凝胶分离,用溴化乙锭(10 mg·mL-1)染色,并用凝胶提取试剂盒回收测序。
1.5 生物信息学分析
使用NCBI 的BLAST-N 搜索程序,将16 S rDNA 基因序列数据与GenBank 数据库进行比对,并构建系统进化树。
1.6 纤维素分解细菌的形态特征
依据伯杰的系统细菌学手册对分离菌落的形态特征进行分类。通过革兰氏染色分析菌落特征。根据性质、形状、色素沉着和革兰氏染色对单个菌落进行评估。
1.7 纤维素分解菌的生化特性
使用糖发酵试剂盒检测分离株的糖代谢能力。将单菌落在营养肉汤中培养72 h。将50 μL 培养物接种在试剂盒中,并在35 ±2 ℃孵育18~24 h,根据试剂盒提供的图表计算结果。
2 结果
2.1 纤维素分解菌的筛选和分离
从肠道匀浆中共分离到27 株细菌,其中5 株细菌具有纤维素代谢活性,命名为CDB3、CEB2、FB6、FB7 和EB2。其中纤维分解活性最高的是CDB3 见表1。

表1 分离菌的纤维素分解指数
2.2 纤维素分解菌16 S rDNA 基因的染色体组型和序列分析
通过16 S rDNA 多重序列比较构建5 种纤维素分解菌系统发育树(图1)。在5 个分离株中,FB7 和EB2 亲缘关系较近,而B2B 和B1B 亲缘关系较远。这些分离株与NCBI数据库中的其他细菌菌株显示出95~100%的核苷酸同源性(见表2)。

图1 16 S rDNA 基因序列系统发育树图
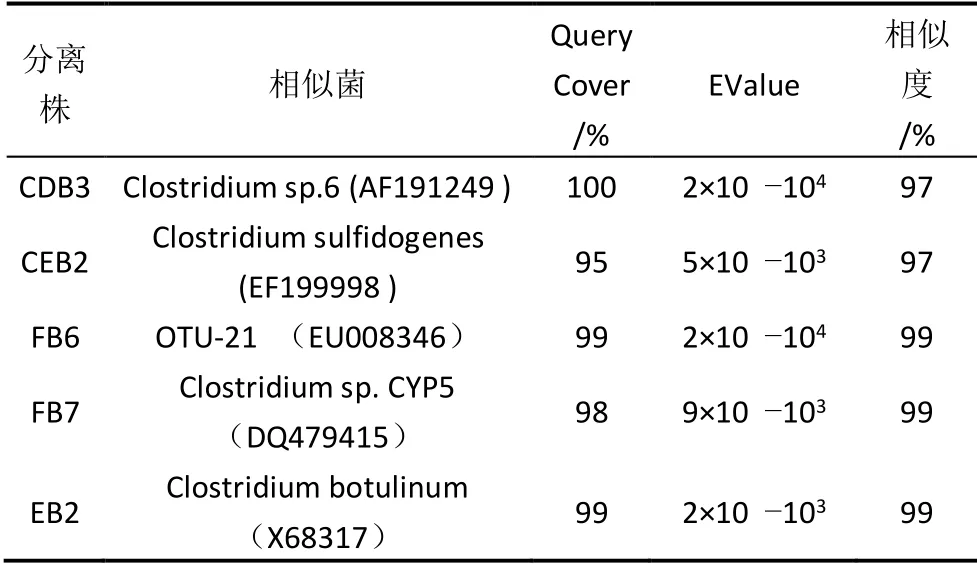
表2 纤维素分解菌16 S DNA 的BLAST-N 结果
2.3 纤维素分解细菌的形态特征
分离细菌的菌落在大小、形状、边缘和高度上各不相同,但是染色特点和菌落颜色具有相似性。5 种分离菌均为革兰氏阴性菌,CDB3 和EB2 为棒状革兰氏阴性菌,菌落较小,突起,边缘呈凸状突起;FB6 和FB7 在形状和革兰氏染色上相似,前者菌落小,边缘呈扁平状突起,而后者较大,圆形突起,边缘呈波状;CDB3 分离株是一种球形革兰氏阴性细菌,在大小、边缘和高度上有明显差异(见表3)。
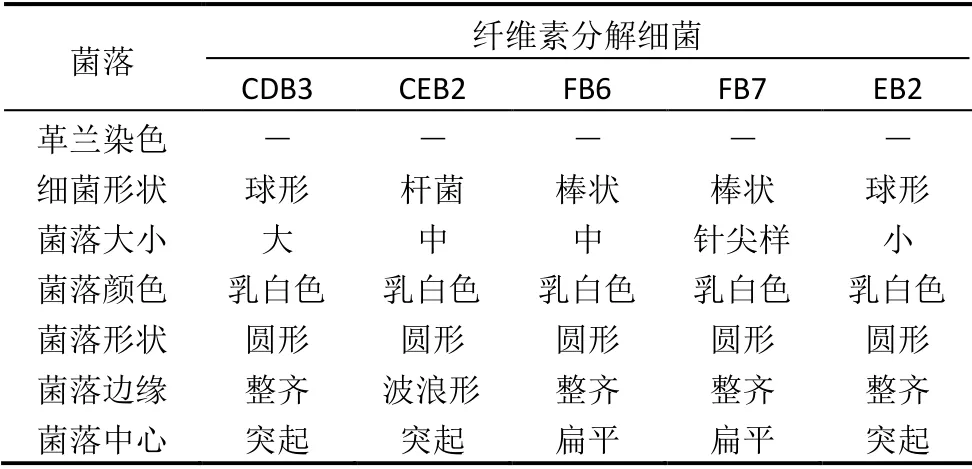
表3 纤维素分解细菌特征
2.4 纤维素分解细菌的生化特性
这些细菌菌株均能发酵果糖、葡萄糖、海藻糖、肌醇、核糖醇、α-甲基-D-葡萄糖苷、柠檬酸盐、半乳糖、已六醇、纤维二糖、七叶苷,但对棉子糖、蜜二糖等利用情况有所差异(见表4)。

表4 纤维素分解细菌分离物的糖发酵实验
3 讨论
纤维素废料是地球上最丰富的可再生资源[6,7],它在农业、林业和城市垃圾中广泛存在。然而,纤维素废物具有异质性和难处理性,它是常规能源生产和环境恢复转化过程的主要障碍。利用生物体开发纤维素酶解系统是最佳的研究方法之一[8-10]。因此,嗜热纤维素降解细菌及其用于生物能转化过程的酶,是开发纤维素降解和生产包括糖和生物乙醇在内的替代燃料的关键[11-13]。本研究从中原地区白蚁肠道内分离培养纤维素分解菌,通过16S RNA 测序,与NCBI 数据库进行比对,构建了系统发育树。同时初步研究了分离菌的菌落特点和菌体特性以及分离菌的糖发酵生化反应特点等。这些研究为采用生物策略分离纤维菌分解菌,以及其进一步的开发利用提供了实验数据。总之,我们从白蚁肠道中筛选出的5 株易于繁殖和培养、高降解纤维素能力的菌株,分离筛选和鉴定这些可降解纤维素的微生物,可以为实现白蚁肠道来源的微生物资源的工业化应用奠定基础,并能够为植物废弃物的生物降解提供技术支持。

