土壤微生物电化学系统降解四环素的机理
赵晓东,李晓晶,赵鹏宇,宋敏丽,燕平梅,任天志,李永涛,3 (.农业农村部环境保护科研监测所,农业农村部产地环境污染防控重点实验室,天津市农业环境与农产品安全重点实验室,天津 3009;.太原师范学院生物系,山西 榆次03069;3.华南农业大学资源环境学院,广东 广州 5064)
近年来,抗生素在畜禽养殖业的滥用[1-2],以及其在动物体内的难以吸收性(排泄率达40%~90%)[3],导致抗生素在动物粪便中具有极高的检出率和残留量[4].畜禽粪肥农用造成了农业土壤中严重的抗生素污染,尤其是四环素在土壤中的含量高达0.16~10967ng/g[5].近期研究发现,土壤中的四环素及其抗性基因(ARGs)会通过食物链传播,从而对人类健康造成威胁[6-8].
微生物修复作为一种绿色、环境友好型的修复技术在土壤污染治理过程中起着关键的作用[9].随着有机污染物的氧化降解,污染土壤中氧化剂(电子受体)逐渐消耗以致缺乏限制了微生物的修复效率,而土壤微生物电化学系统(SMES)能够提供固体阳极作为永不枯竭的电子受体,在将土壤中有机污染物降解的同时还能将此过程中的化学能直接转化为生物电能,既解决了微生物修复效率提升的技术瓶颈,又实现了污染治理与固废资源化利用的双功效,且该过程无二次污染[10-12].
最新的研究表明,运用微生物电化学系统(MES)可以高效地去除水体中残留的四环素类抗生素,虽然MES 对ARGs 的抑制效能仍存在一定争议,但四环素类抗生素的去除率在7d 内较对照处理可提高70%~125%[13-17].为了进一步明确MES 在四环素污染修复中的应用前景,本文前期研究首次将MES 应用至四环素污染土壤中,研究发现相比于黑土、红壤和黄棕壤,SMES 更适用于潮土,四环素降解率较对照可提高39%[18],且ARGs 丰度较对照下降了28%~47%[19].土壤酶是土壤重要的组成成分,主要来源于微生物和植物根系的分泌,它不仅能够有效驱动土壤的养分循环,而且还是土壤有机污染生物修复过程中的重要物质[20].但SMES 是如何调控微生物分泌功能酶从而促进四环素的降解效能仍有待深入研究.因此,本文旨在探明SMES 运行过程中四环素降解-酶活性-微生物之间的内在联系,以期揭示该技术对四环素的生物降解机理.
1 材料与方法
1.1 供试土壤
本研究的供试土壤为潮土,采自天津武清区(N39°27′20.59″, E117°09′26.18″).将采集的土壤在阴凉通风处自然风干,研磨并过2mm 筛保存备用,其基本土壤理化性质见表1.

表1 供试土壤的基本理化性质Table 1 The physicochemical properties of experimental soils
1.2 反应器构型与操作
本研究选取了活性炭空气阴极和碳纤维布阳极的单室反应器构型(体积为6cm×6cm×9cm),如图1(a),活性炭空气阴极的制作方法参照课题组先前的报道[21].为了降低土壤内阻,增强SMES 的电子传递效率,向土壤中掺入质量比为1%(以干土计)的碳纤维丝(长1cm)[22].碳纤维布与碳纤维丝在使用之前均用丙酮浸泡过夜后用蒸馏水冲洗3~5 次备用.反应器填装的土量为300g,将120mL 的蒸馏水加入土壤与碳纤维丝一起搅拌均匀置入反应器中,并在反应器土壤表层加约1cm 厚的蒸馏水作为水封层以阻隔氧气的入侵.
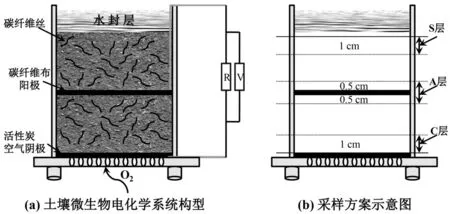
图1 土壤微生物电化学系统构型和采样方案示意Fig.1 The construction of soil microbial electrochemical system and the sampling scheme of the experiment
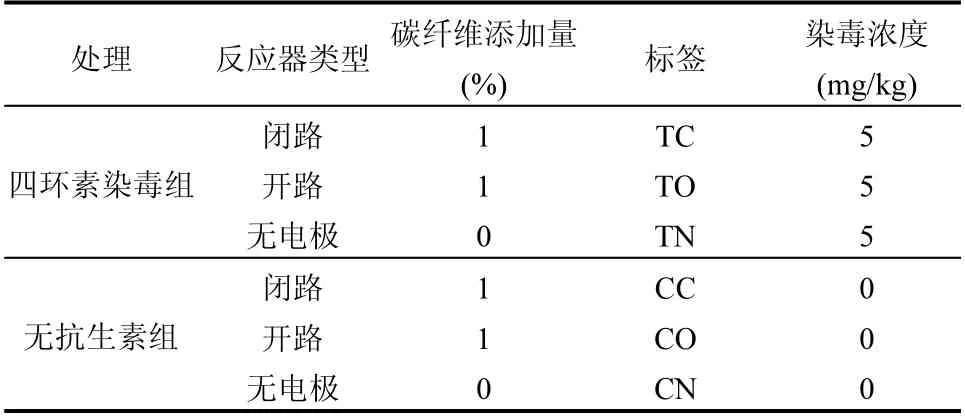
表2 实验设计Table 2 The experimental design
本试验共设两组:第一组为四环素染毒组(染毒浓度为5mg/kg),第二组为不添加四环素对照组.每组包含2 个闭路处理,一个开路对照和一个无电极对照.所有处理均置于恒温培养箱在30℃的条件下暗室培养,试验周期为58d.试验结束后拆反应器取样,取样部位(图1b)分别设定在阴极表面向上1cm以内的区域(C 层)、阳极表面上下各0.5cm 的区域(A层)和从土壤表层向下1cm以内的区域(S层).实验方案具体如下(表2):
1.3 测试方法
土壤pH 值和电导率的测定方法参照课题组先前报道的文献[23]:称取2g 冷冻干燥后的供试土壤倒入50mL 离心管中,按照土水比1:5 加入10mL 去离子水,在涡旋仪上以2500r/min 的转速振荡30min使土水充分混匀,用超高速离心机以10000r/min 的转速离心7min,收集上清液后用pH计和电导率仪测定土壤的pH 值和电导率.
采用土壤酶试剂盒(苏州科铭生物技术有限公司)测定土壤脱氢酶、多酚氧化酶、过氧化氢酶和漆酶的活性,前处理方法根据试剂盒提供的说明书进行.分别在485nm、430nm、240nm 和420nm 波长处使用紫外分光光度计测定土壤脱氢酶、多酚氧化酶、过氧化氢酶和漆酶活性[23-25].
此外,土壤中四环素残留量和微生物群落(包括细菌、真菌和古菌)的测定方法参见本文前期研究成果[19].
1.4 数据分析与统计
Network 图用于分析四环素降解、脱氢酶活性和三域微生物之间的关系,所用软件为Cytoscape 3.7.0.为了增强Network 图的可读性,首先借助IBM SPSS Statistics 2.2 软件对四环素降解、脱氢酶活性和三域微生物之间做Spearman 相关性分析,筛选出达显著正相关(P<0.05)的两两关系进行作图.Network 图中的节点代表四环素降解、脱氢酶活性或者微生物,连接节点的边代表两节点之间的关系[26].采用Canoco5.0 软件进行冗余分析,采用Office 2007、Origin 2019 等软件进行数据分析和作图,采用IBM SPSS Statistics 2.2 软件进行组间差异分析.
2 结果与讨论
2.1 四环素在不同处理中的降解率
四环素在TC 处理展现出最高降解率(70%),在TO 处理中次之(66%),它们较在TN 处理中的降解率分别提高35%和27%(P<0.05,图2),表明SMES 可有效提升土壤中四环素的去除效率[19].从不同土层角度来看,四环素在闭路和开路A 层的降解率最高,其次为C 层,均比闭路和开路处理相应的S 层高出约8% (P<0.05).
四环素在环境中的降解途径主要包括非生物降解和生物降解,其中非生物降解主要包括光解、氧化降解和水解等[27].在本研究中,整个试验过程均在避光条件下进行,且未添加任何氧化剂.同时,所有处理均处于淹水条件,理论上各处理对四环素的水解能力一致.因此,非生物降解并不是SMES 促进四环素降解的主要途径.相比之下,该系统能提供生物电流刺激微生物的代谢活性,从而强化对污染物的生物降解效率[28-29].因此,认为本研究中生物降解是SMES 提升四环素降解效率的主要方式.
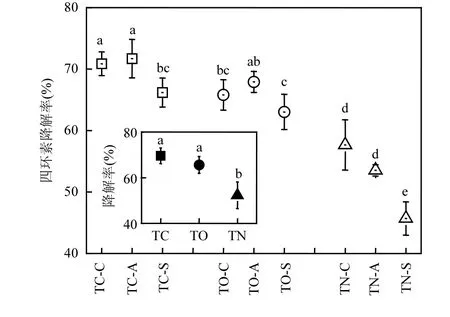
图2 四环素在不同处理中的降解规律Fig.2 Degradation rate of tetracycline in different treatments
2.2 不同处理中土壤pH 值和电导率的变化
经过58d 的实验周期,土壤pH 值展现出规律性的变化(图3a).与原始土壤OS(7.72±0.02)相比,闭路处理的pH 值呈现出一定的降低趋势,而无电极处理则呈现升高趋势.例如TC 处理较OS 处理pH 值降低了0.14 个单位(P<0.05),而CN 处理较OS 增加了0.17 个单位(P<0.05).土壤pH 值在不同处理的变化趋势与氧化还原电位有关,通常情况下土壤氧化还原电位每下降59mV,pH 值会相应增加一个单位,这是因为土壤从氧化态向还原态转变时会消耗土壤中的氢离子,氢离子的消耗直接引起了土壤pH 值的增加[30].而据前人研究表明,SMES 的氧化还原电位显著高于无电极对照[31].同时,SMES 不同层之间比较发现,土壤pH 值在阴极(C 层)明显高于阳极(A层)(图3c),这与前人的研究一致,这是因为阴极表面反应消耗H+引起OH-的积累而导致pH 值在阴极升高,而同时阳极附近会产生H+降低pH 值[11-32].
与不添加四环素的处理相比,添加四环素处理的土壤电导率有明显增加,且电导率在闭路系统中进一步被提高(图3b).在闭路系统中,与相应的阳极附近(A 层)相比,阴极附近(C 层)和表层(S 层)的电导率在TC 处理中增加了38%~45%,在CC 处理中增加了30%~47%(图3d).开路处理与闭路处理展现出相同的趋势.而在无电极处理中,土壤电导率从S 层至C 层逐渐降低.例如,在TN 处理中,S 层的电导率较A层和C 层分别高出42%和73%.分析原因,第一,盐离子随着水分的蒸发而逐渐扩散至土壤表层(S 层),因此所有处理S 层的电导率均高于A 层;第二,闭路和开路处理阴极附近土壤电导率高于阳极的原因可能是水分会通过阴极蒸发或者生物电场驱动从而带动盐离子的迁移[33].
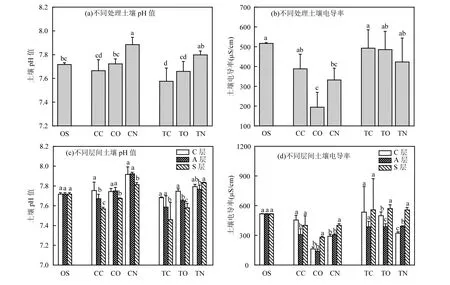
图3 不同处理土壤pH 值和电导率的变化Fig.3 Change of soil pH value and conductivity in different treatments
2.3 不同处理中土壤酶活性的变化
与OS 处理相比,土壤脱氢酶活性在CN 处理中下降了53%(P<0.05),添加四环素(TN 处理)进一步降低了脱氢酶的活性,降幅达38%(图4a).而与TN处理相比,电极引入(TO 处理)后脱氢酶活性增加了126%(P<0.05),且脱氢酶活性在闭路处理(TC 处理)中被进一步提高.脱氢酶可以在一定程度上反应土壤中微生物的降解活性状况,说明在生物电流的不断刺激下,微生物的新陈代谢得到了强化,进而有利于对四环素的降解[34].由图5a 可知,脱氢酶活性在TC 和TO 处理的阳极区域最高,这与四环素降解率的趋势一致(图2).
与土壤脱氢酶活性趋势相似,各处理的土壤多酚氧化酶活性也在实验结束后呈现出不同程度的降低,降幅达16%~34%(P<0.05,图4b).与不加四环素处理相比,多酚氧化酶活性在添加四环素处理中降低了8%~19%.此外,虽然土壤多酚氧化酶活性在不同土层之间没有规律性的变化,但在添加四环素处理中的阳极受到明显的抑制(图5b).多酚氧化酶作为典型的氧化还原酶可以促进芳香族化合物的降解转化,前人研究结果也发现土壤多酚氧化酶的活性会受到四环素的抑制,这意味着该酶在四环素降解过程中的作用相对较小[20].
土壤过氧化氢酶是评价污染土壤毒性状况的指示酶[35],本研究中土壤过氧化氢酶活性主要受到四环素的抑制(图4c).例如,与原始土壤相比,过氧化氢酶活性在未添加四环素处理(CN、CO 和CC 处理)并没有显著的变化,而当过氧化氢酶暴露在四环素环境(TN、TO 和TC 处理)后,其活性显著降低了16%~21% (P<0.05),这与前人的研究结果一致[36-38].同时,过氧化氢酶活性在添加四环素闭路处理的C层和A层较相应的S层显著提高了17%~26% (P<0.05,图5c),这与四环素在TC 处理S 层较高的残留浓度一致.
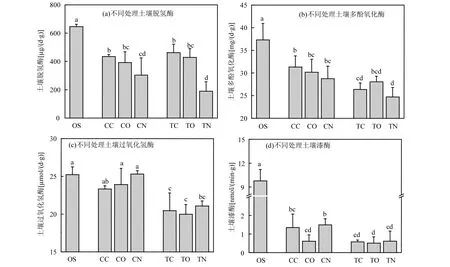
图4 不同处理间土壤酶活性变化Fig.4 Change of soil enzyme activities in different treatments
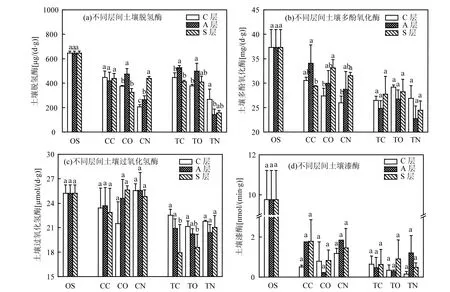
图5 各处理不同层间土壤酶活性的变化Fig.5 Change of soil enzyme activities in different layered soils
漆酶是一种具有广谱性降解能力的含铜多酚氧化酶,它能够将环境中的酚类化合物催化为醌类物质或苯氧自由基[39-40].由图4d 和图5d 可知,与OS相比,土壤漆酶活性在实验处理中受到明显的抑制,且在添加四环素后其活性进一步被降低,这表明漆酶更偏好于好氧降解过程.
2.4 环境因子与微生物群落的冗余分析
采用冗余分析以探明四环素降解、土壤pH 值、电导率、酶活性与主要的属水平微生物群落(包括细菌、真菌和古菌)之间的关系(图6).微生物群落在不同处理中的变化规律参见文献[19],相关数据已上传至NCBI 数据库(SUB5067487, PRJNA516294).由图6 可知,两排序轴的总解释度达80.48%,实线-空心箭头代表解释变量(包括四环素降解、土壤pH 值、电导率、酶活性),虚线-实心箭头代表响应变量(包括属水平的细菌、真菌和古菌群落).本研究中,解释变量共同解释了96.4%的样本信息,其中土壤pH 值对响应变量的解释度达到显著水平(解释度为21.5%,P<0.05),说明pH 值是影响微生物群落结构的重要指标.如图6 所示,pH 值与四环素降解呈负相关关系,这意味着四环素可能在偏酸性条件下更容易被降解.由图还可知,四环素的降解率与土壤脱氢酶活性呈正相关关系,进一步通过Spearman 相关性分析发现,两者之间达极显著水平(r=0.95, P<0.01).Leng等[41]研究指出,四环素的生物降解途径主要包括脱甲基、脱氢、脱羰基和脱氨基等过程.因此,在本研究中脱氢酶在四环素的脱氢过程中很可能起到了重要的作用.此外,数量过半的属水平微生物与四环素降解和脱氢酶呈现出紧密相关关系,如Bacillus、Desulfocapsa 、 Scedosporium 、 Microascus 、Wardomyces 、 Aphanoascus 、 Chaetomium 、Aspergillus、Scopulariopsis、Geoalkalibacter 等.
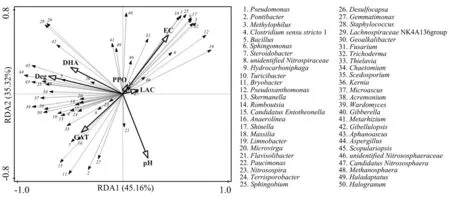
图6 土壤微生物群落与环境因子的冗余分析Fig.6 Redundancy analysis between soil microbial community and environmental factors
产电呼吸是SMES 去除污染物质的重要机制,在阳极,污染物作为电子供体被生物氧化产生质子(H+)和电子(e-),而H+和e-在胞内外的转移速率将会决定污染物的去除效率[42].在呼吸链的氧化还原过程中,脱氢酶会参与代谢中间产物之间的H+转移并产生电位差,这将有利于生物电能的产生[43].在本研究中,脱氢酶活性的增加一方面可能会提升H+的转移速率从而促进四环素的去除效率;另一方面,由H+转移导致的电势差提升了系统的电能输出,这再度刺激了降解菌的代谢活性最终进一步提升了对四环素的生物降解效率.
2.5 四环素的潜在降解功能菌
为了进一步探明脱氢酶的潜在分泌菌,并揭示四环素的潜在降解微生物,通过Network 关联分析对四环素降解率、脱氢酶活性和微生物群落之间的关系做了进一步分析(图7).由图可知,属水平微生物Microvirga 、 Staphylococcus 、 Lachnospiraceae NK4A136group、Geoalkalibacter、Microascus、Wardomyces 、 Aspergillus 、 Aphanoascus 和Scopulariopsis 与四环素降解之间存在较密切的联系.其中,细菌变形菌门地杆菌科中Geoalkalibacter,真菌子囊菌门小囊菌科中Microascus、Wardomyces和 Scopulariopsis,以及同门 Onygenaceae 科中Aphanoascus 的丰度随四环素的添加而增加,并在电极的引入和生物电流的刺激下被进一步提高[19].以Geoalkalibacter 和Microascus 为例,与无四环素对照(CN 处理)相比,它们的丰度在添加四环素后(TN 处理)分别增加了42%和50%,引入电极后(TO 处理)其丰度分别进一步增加了152%和90%,在生物电流的刺激下(TC 处理)分别再度提高了7%和32%[19].
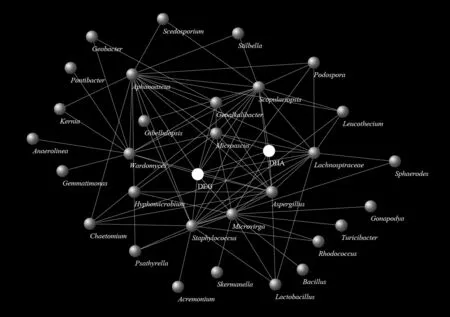
图7 四环素降解率、脱氢酶活性和属水平微生物之间的Network 分析Fig.7 Network analysis showing the connectedness among tetracycline degradation, dehydrogenase activity and microbial abundance at genus level
Geoalkalibacter 是常见的电活性微生物,通常富集于SMES 的阳极区域参与产电过程[44-45].Hamdan等[46]研究表明,Geoalkalibacter 的存在更有利于多环芳烃的降解,这可能是因为Geoalkalibacter 促进了SMES 的产电性能,降解功能微生物的活性受到生物电流的刺激后进一步促进了污染物质的降解.先前研究表明,Microascus 可促进有机物质的降解[47], Microascus 和Wardomyces 在异丙甲草胺污染土壤中的富集证明了它们在降解异丙甲草胺过程中的重要作用[48].同时,Scopulariopsis sp.在五氯苯酚污染土壤中起到了生物修复和生物防治的双重功效[49].以上证据表明,Geoalkalibacter、Microascus、Wardomyces和Scopulariopsis在本研究中可能参与四环素的降解,且真菌子囊菌门中的小囊菌科在此过程中起到了主要的降解作用.由图7 还可知,脱氢酶活性与属水平真菌Microascus 和Scopulariopsis 之间关系密切,表明Microascus和Scopulariopsis很可能通过分泌脱氢酶从而促进了四环素的脱氢过程.
3 结论
3.1 SMES 能够有效去除土壤中残留的四环素,其降解率较无电极对照增加35%(P<0.05).土壤脱氢酶活性在染毒开路和闭路处理中呈现出显著的升高趋势,且与四环素降解率呈显著正相关关系,而土壤过氧化氢酶活性受到四环素的显著抑制.
3.2 Geoalkalibacter、Microascus、Wardomyces 和Scopulariopsis 是四环素的潜在降解菌,相比于细菌和古菌,真菌子囊菌门中的小囊菌科发挥了主要的四环素生物降解作用.其中,Microascus 和Scopulariopsis 很可能通过分泌脱氢酶从而促进了四环素的脱氢过程.
3.3 土壤pH 值是影响微生物群落结构的重要理化指标,且与四环素降解呈负相关关系,这意味着四环素可能在偏酸性环境中更易被降解.

