肉桂醛对大鼠肠系膜动脉的作用和机制*
程筱涵, 白玉华, 齐靖, 邢妍, 陈紫洁, 张渝, 王瞳, 李丽静*,郑晓东***
(1.哈尔滨医科大学 大庆校区 药物化学与天然药物化学教研室, 黑龙江 大庆 163319; 2.哈尔滨医科大学 大庆校区 药理教研室, 黑龙江 大庆 163319; 3.哈尔滨医科大学 大庆校区 遗传学与细胞生物学教研室, 黑龙江 大庆 163319)
高血压与心肌梗死、心力衰竭、缺血性中风及出血性中风等疾病密切相关[1],内皮功能失调是高血压发生的关键因素[2],血管内皮主要通过释放一氧化氮(nitric oxide,NO)、前列环素(prostacyclin,PGs)及内皮源性超极化因子(endothelium derived hyperpolarizing factor,EDHF)舒张血管平滑肌,参与血压的调节[3]。肉桂醛(cinnamicaldehyde,CA)是一种醛类有机化合物,大量存在于肉桂等植物体内,是肉桂挥发油的主要有效成分,具有氧化性,常作为食品添加剂[4]。有研究表明CA具有扩张血管及降压的作用[5],然而CA对大鼠肠系膜动脉的舒张作用以及机制仍未明确,因此本研究通过不同浓度CA处理大鼠分离的肠系膜动脉及其动脉中提取的原代内皮细胞和原代平滑肌细胞,探讨CA舒张大鼠肠系膜的可能机制。
1 材料与方法
1.1 材料
1.1.1实验动物 健康5~6周龄雄性Sprague Dawley(SD)大鼠11只,体质量180~200 g,购买于哈尔滨医科大学大庆校区实验动物中心[合格证号SCXK(黑)20020002],适应性饲养(普通饲料,不禁食、禁水)1周后,用于血管张力检测以及原代细胞提取。实验操作流程经学校伦理委员会审批通过[(2012)-006]。
1.1.2主要试剂与仪器 C108631 CA(上海阿拉丁),苯肾上腺素(phenylephrine,PE)、左旋硝精氨酸甲酯(NG-nitro-L-arginine methyl ester,L-NAME)、吲哚美辛(indomethacin,Indo)、二硫苏糖醇(dithiothreitol,DTT)及乙酰胆碱(acetylcholine,Ach;美国Sigma),二甲基亚砜(dimethyl sulfoxide,DMSO)、高糖dulbecco's modified eagle medium(DMEM,美国Hyclone),胎牛血清(浙江天航)、内皮细胞培养基(endothelial cell medium,ECM;上海中乔新舟),Ⅱ型胶原酶、Bradford蛋白浓度测定试剂盒(去垢剂兼容型)、β-actin小鼠单克隆抗体、生物素标记山羊抗兔IgG(H+L)和4,6-二氨基-2-苯基吲哚(4,6-diamino-2-phenylindole,DAPI;中国碧云天),AF0035磷酸化内皮一氧化氮合成酶抗体(phospho-endothelial nitric oxide synthase antibody,p-eNOS;美国Affinity),超敏electro-chemi-luminescence(ECL)化学发光液(哈尔滨新海基因),细胞渗透性Ca2+探针(fluo 3-AM)、Hank's平衡盐溶液(Hank's balanced salt solution,HBSS;美国Thermo),α平滑肌肌动蛋白(alpha smooth muscle actin antibody,α-SMA)及血小板-内皮细胞粘附分子(platelet endothelial cell adhesion molecule-1,PECAM-1/CD31;美国Abcam),克-亨氏液(krebs-hensleit's solution,Krebs;中国武汉普诺赛),DMT 620 M微血管张力测定系统(丹麦Myo Technology),激光共聚焦显微镜(日本Olympus),CO2细胞培养箱和缺氧培养箱(美国Thermo),Western blot凝胶电泳仪和转膜仪(美国Bio-rad)。
1.2 方法
1.2.1血管张力的检测 SD大鼠5只经水合氯醛麻醉后取肠系膜组织,体式显微镜下分离肠系膜动脉;肠系膜动脉制备成2~3 mm血管段置于DMT620M血管张力检测仪,加Krebs溶液37 ℃平衡30 min,60 mmol/L KCl 预收缩血管3次,继续平衡20 min,加1 μmol/L PE(工作浓度系课题组前期研究确定)预收缩血管[6]。待张力稳定后,加1、10及30 μmol/L CA,或对照组给予与CA等体积的DMSO,记录肠系膜动脉血管张力变化。为验证CA引起血管舒张是否依赖于内皮以及通过何种途径引起舒张,实验分为对照组即未去除肠系膜动脉血管内皮的正常动脉血管、去内皮组(发丝刮除血管内皮,乙酰胆碱舒张率低于10 %为内皮去除完全)、L-NAME+Indo组(100 mmol/L L-NAME和10 μmol/L Indo孵育30 min,工作浓度系课题组前期研究确定[6])、KCl组(60 mmol/L KCl)及DTT组(3 mmol/L DTT孵育30 min)。加1 μmol/L PE预收缩血管后加CA,观察CA舒张肠系膜动脉的情况。使用Powerlab软件用于记录肠系膜动脉张力数值变化。
1.2.2原代细胞的提取及培养 SD大鼠6只(3批次,2只/次)腹腔注入肝素20 min,水合氯醛麻醉,取肠系膜组织置于4 ℃无菌的磷酸缓冲盐溶液(phosphate buffer saline,PBS)中,显微镜下分离肠系膜动脉,分别进行肠系膜动脉内皮细胞(mesenteric artery endothelium cells,MAECs)和动脉平滑肌细胞(mesenteric artery smooth muscle cells,MASMCs)的分离培养。MAECs系将胶原酶Ⅱ消化液注入肠系膜动脉血管管腔孵育20 min,消化液不断冲刷肠系膜动脉血管内壁,收集冲刷下来的MAECs置于含有ECM的离心管中;MASMCs系纵向剪开肠系膜动脉血管,去除血管内皮和外膜后将剩余的血管剪碎,转移到胶原酶Ⅱ溶液中消化1 h,加20%胎牛血清的DMEM培养液。将上述得到的细胞悬液1 200 r/min 离心5 min,弃上清液,加培养液重悬,将所得到的原代MAECs和MASMCs置于37 ℃的5%CO2培养箱24 h。
1.2.3细胞免疫荧光法 取“1.2.2”项下第3代MAECs和MASMCs,分别培养于2个单孔板上,经固定、细胞破膜、封闭处理,分别孵育α-SMA(1 ∶500)和CD31(1 ∶500)一抗,24 h避光孵育对应种属的生物素标记的荧光二抗及DAPI复染细胞核;利用激光扫描共聚焦显微镜分别检测MASMCs的α-SMA蛋白和MAECs的CD31蛋白表达。
1.2.4Western blot实验 取“1.2.2”项下第5~7代MAECs设置为常氧组(21%FiO2)和缺氧组(3%FiO2),均给予DMSO、10 μmol/L CA及30 μmol/L CA处理24 h后提取蛋白质,使用Bradford蛋白浓度测定试剂盒(去垢剂兼容型)进行蛋白定量;处理蛋白质经电泳转膜封闭后,孵育目的蛋白一抗p-eNOS(1 ∶500)和β-actin(1 ∶6 000),孵育二抗,ECL化学发光检测液检测各目的蛋白表达量,并ImageJ软件进行蛋白质条带的光密度分析。
1.2.5激光扫描共聚焦显微镜法 取“1.2.2”项下第5~7代MASMCs培养于单孔板,避光加入HBSS溶液稀释的fluo 3-AM荧光探针40 min,HBSS洗去多余荧光染料;利用激光扫描共聚焦显微镜捕获图像、记录初始Ca2+荧光值即0 μmol/L的DMSO和CA组,5 min后分别加DMSO及1、10及30 μmol/L CA,记录各组细胞荧光值的变化,并使用Fluoview-FV300(Olympus)软件进行Ca2+荧光曲线下面积的图像分析。
1.3 统计学分析
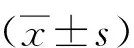
2 结果
2.1 CA对大鼠肠系膜动脉血管张力的影响
血管张力检测结果表明,10和30 μmol/L CA组大鼠肠系膜动脉血管张力分别明显高于1 μmol/L CA组,差异均有统计学意义(P<0.001),故认为CA可促进大鼠肠系膜动脉血管舒张。见图1。

注:(1)与1 μmol/L CA组比较,P<0.001。图1 不同浓度CA对大鼠肠系膜动脉血管张力的影响Fig.1 Effects of different concentrations of CA on vasodilation of rat mesenteric arteries
2.2 L-NAME+Indo、内皮、K+及DTT对CA舒张大鼠肠系膜动脉的影响
结果显示,L-NAME+Indo处理组大鼠肠系膜动脉1、10及30 μmol/L CA引起的血管舒张与对应浓度对照组比较,差异无统计学意义(P>0.05);去内皮处理组大鼠肠系膜动脉10 μmol/L CA引起的舒张血管程度低于对照组、差异有统计学意义(P<0.001),但1和30 μmol/L CA与对应浓度对照组比较、差异无统计学意义(P>0.05);KCl组大鼠肠系膜动脉的1 μmol/L CA和对照组比较、差异无统计学意义(P>0.05),但10和30 μmol/L CA舒张血管程度低于对应浓度对照组,差异均有统计学意义(P<0.001);DTT处理组大鼠肠系膜动脉1 μmol/L CA与对照组比较、差异无统计学意义(P>0.05),但10和30 μmol/L CA引起的血管舒张程度低于对应浓度对照组,差异均有统计学意义(P<0.001)。见图2。
注:(1)与10 μmol/L对照组比较,P<0.001;(2)和30 μmol/L对照组比较,P<0.001。图2 L-NAME+Indo、内皮、KCl及DTT对CA舒张大鼠肠系膜动脉的影响Fig.2 Effects of L-NAME+Indo, endothelium, KCl, DTT on vasodilation of mesenteric arteries by CA
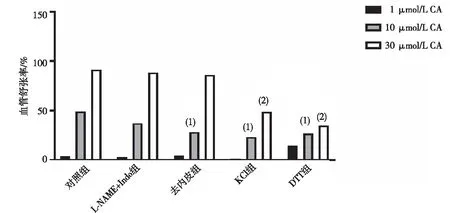
2.3 原代MASMCs和MAECs的细胞形态
结果显示,MASMC呈长梭形,α-SMA蛋白主要表达于细胞质;MAECs呈扁平梭形,CD31蛋白主要表达于细胞质,DAPI用于标记细胞核。见图3。
注:绿色荧光为α-SMA蛋白(MASMCs)或CD31蛋白(MAECs),蓝色荧光为DAPI。图3 原代细胞免疫荧光鉴定结果(细胞免疫荧光染色,×200)Fig.3 Identification images of primary cells(Cellular immunofluorescence,×200)
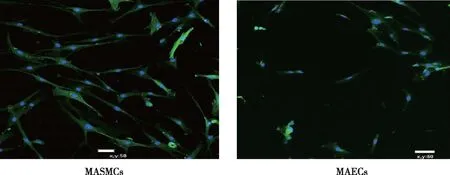
2.4 MAECs中p-eNOS蛋白的表达
Western blot实验结果显示,常氧和缺氧条件下,10 和30 μmol/L CA处理组大鼠MAECs的p-eNOS蛋白表达水平分别与DMSO组比较,差异均无统计学意义(P>0.05)。见图4。
图4 大鼠MAECs中p-eNOS蛋白的表达Fig.4 Expression of p-eNOS protein in MACEs of rats
2.5 MASMCs中Ca2+浓度的变化
激光共聚焦显微镜结果显示,1、10及30 μmol/L CA组大鼠MASMCs中Ca2+荧光曲线下面积与DMSO组比较,差异均无统计学意义(P>0.05);1、10及30 μmol/L CA组大鼠MASMCs中Ca2+荧光曲线下面积分别与同组0 μmol/L CA组比较,差异均无统计学意义(P>0.05)。见图5。
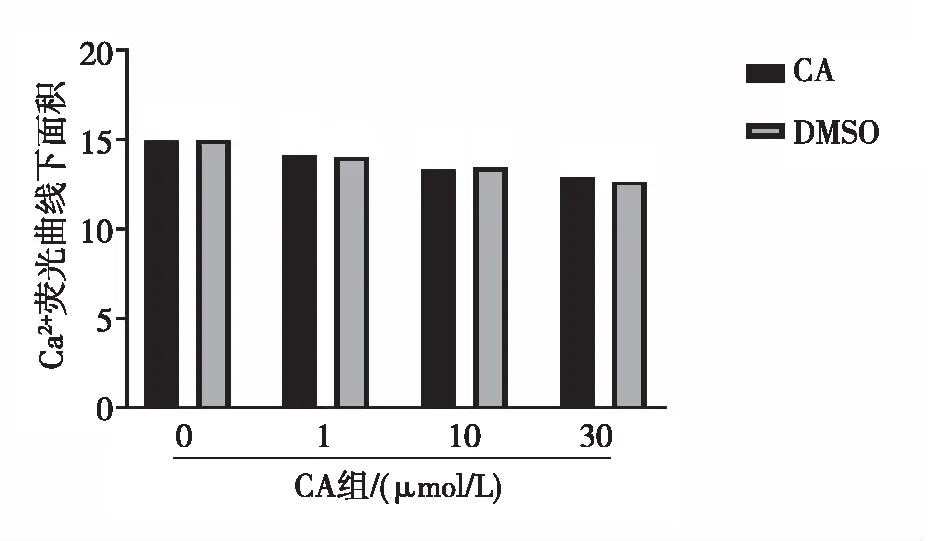
图5 各组大鼠MASMCs中Ca2+浓度的变化Fig.5 Changes of Ca2+ concentration in MASMCs of each group
3 讨论
CA是从自然界的肉桂皮中提取的肉桂精油中的化合物,具有抗氧化、抗微生物及抗糖尿病的特性,且被广泛用于香水、制药及食品加工行业[7-9]。此外,CA可通过抑制细胞增殖,诱导细胞凋亡并具有抗癌作用[10-11]。有报道也表明CA可减少动脉粥样硬化,降低心血管疾病的发生[12],但是关于CA与高血压的相关报道较缺乏。内皮是影响动脉血管舒张功能的主要因素,其中内皮细胞中的eNOS是内皮产生NO的关键酶,L-NAME是eNOS的主要抑制剂[13]。同样,前列环素(epoprostenol,PGI2)也是影响血管收缩的主要因素之一,其主要由血管内皮细胞中环氧合酶(cyclooxygenase,COX)产生[14]。Indo是COX的抑制剂,可以抑制PGI2的产生,进而抑制血管舒张[15]。因此可以利用eNOS抑制剂L-NAME和COX抑制剂Indo来抑制血管内皮活性[16]。本研究发现在肠系膜动脉同时孵育L-NAME和Indo,加入CA后肠系膜动脉仍然为舒张状态,、以上实验证明CA引起血管舒张不依赖于内皮细胞的COX途径。为了探讨低浓度CA舒张血管是否通过NO途径,将肠系膜动脉去除血管内皮后,10 μmol/L CA舒张血管作用受到抑制,因此认为CA在低浓度时具有内皮依赖性。同时利用Western blot验证MAECs中p-eNOS蛋白表达,结果显示无论是在常氧或缺氧条件下,MAECs中p-eNOS蛋白表达水平均无变化,证明CA引起血管舒张不依赖于内皮细胞的NO途径。硫酸吲哚酚是一种蛋白结合的尿毒症毒素,可以抑制大鼠肠系膜动脉的NO信号转导,但是可以通过EDHF途径舒张肠系膜动脉[17],提高细胞外K+浓度可以抑制K+通道活性从而抑制超极化[18],本文研究证实60 mmol/L KCl可以抑制10和30 μmol/L CA引起的血管舒张。这为本文研究证明在高浓度CA不是通过内皮途径而是可能通过EDHF途径提供了潜在证据。
K+和Ca2+通道是影响血管收缩功能的重要离子通道,K+通道分为4种类型,分别是大电导Ca2+激活的K+通道[large (big)-conductance calcium-activated potassium,BKCa]、对三磷酸腺苷敏感的K+通道(ATP-sensitive potassium,KATP)、内向整流性K+通道(inwardly-rectifying potassium,Kir)及电压依赖性K+(voltage-dependent K+,KV)通道,其中BKCa被认为是一种EDHF,其主要机制是内皮细胞内钙浓度升高后,Ca2+激活的K+通道被活化,随后引起内皮细胞的超极化,该超极化可通过传导方式传到平滑肌层,进而引起血管的舒张[19]。因为血管平滑肌层的Ca2+浓度的上调是引起血管收缩的主要因素之一[20],所以本研究在细胞水平检测Ca2+浓度变化。首先原代细胞提取技术从肠系膜动脉血管中分离出MASMCs,并通过细胞免疫荧光实验以及α-SMA抗体对分离出的细胞进行鉴定。结果显示,从肠系膜动脉血管中分离出的大部分细胞表达α-SMA,证明提取分离的细胞是MASMCs。其次研究在MASMCs中孵育fluo 3-AM后,再加入1、10、30及100 μmol/L CA,通过激光共聚焦显微镜检测MASMCs中Ca2+浓度的变化,利用图像分析得到的结果表明MASMCs中Ca2+浓度几乎没有变化。然而本研究利用KCl溶液刺激肠系膜动脉后,再加10和30 μmol/L CA后,KCl组大鼠肠系膜动脉血管舒张程度和对照组比较明显降低。近年来,有研究证实硫化氢(hydrogen sulfide,H2S)是一种潜在的EDHF,可以通过K+通道进而舒张血管[19]。同样,花生四烯酸代谢物5,6-环氧二十碳三烯酸(5,6-epoxyeicosatrienoic acid,5,6-EET)通过血管舒张的内皮源超极化因子EDHF介导的Ca2+流入来影响血管扩张[21]。以上研究为推测CA是通过EDHF途径舒张血管提供了可行性。
DTT是一种小分子氧化还原试剂,有研究表明在放射线暴露后,DTT具有针对造血损伤和肠道损伤的保护作用[22]。H2S是常见的具有氧化性的气体分子,且有舒张血管的作用;DTT是一种具有还原性的小分子化合物,可以抑制H2S舒张血管的作用[23]。本研究发现加入10和30 μmol/L的CA时,孵育DTT组大鼠血管舒张程度和对照组比较明显受到抑制,因此提示CA舒张肠系膜动脉和还原性相关。最近有研究表明,H2S可以被过氧化氢氧化,产生过硫化物进而氧化激活蛋白激酶G1,最终导致血管舒张[24]。因此有理由推测CA可能是通过类似的氧化途径舒张肠系膜动脉,但是具体机制还需要进一步的实验证明。本文选取成年雄性SD而非雌性大鼠作为实验研究对象,其原因是高血压的发病具有明显的性别特征,青年人群中男性比女性更易患高血压,老年人群中女性的患病率则是男性的2倍,主要是由于男性和女性的肾素-血管紧张素-醛固酮系统、缓激肽和NO系统存在差异[25]。
综上所述,本研究结果表明CA可通过内皮源性超极化因子途径及氧化作用舒张大鼠肠系膜动脉,提示CA具有治疗高血压的潜在药用价值。

