不同晶型纳米二氧化锰制备及对亚甲基蓝吸附性能
许乃才,史丹丹
(1.青海师范大学化学化工学院,青海西宁810008;2.青海省科学技术信息研究所有限公司)
染料废水具有毒性大、色度强、化学需氧量高、生物利用度低等特点[1],对生态环境存在着巨大的安全隐患。目前对染料废水的处理方法主要有深度氧化、混凝、生物分解、吸附、光降解等[2]。其中,吸附法具有成本低、效率高、简单易操作和对环境友好等优点[3]。科研工作者已经研究了多种吸附材料来处理染料废水,比如沸石、活性炭、高分子聚合物、磁性壳聚糖、锰氧化物、MOFs 材料等[4]。其中,锰氧化物因其成本低、资源丰富、性质新颖等特点深受青睐。
据文献报道[5],二氧化锰具有多种晶型(α、β、γ、δ 等)和丰富的形貌(纳米棒、纳米线、花状、球状、片状等)。这些不同晶型和不同形貌的二氧化锰对染料污染物的去除能力有所不同,因此研究不同晶型和不同形貌的二氧化锰处理染料废水中的污染物具有重要意义。
笔者以简单的无机物为原料,用水热反应制备了2 种不同晶型和不同形貌的二氧化锰纳米材料用于溶液中亚甲基蓝的吸附去除。探讨了水热反应时间和反应温度对产物晶型和形貌的影响。研究了溶液pH、吸附剂用量和吸附时间对吸附性能的影响。
1 实验部分
1.1 试剂与仪器
试剂:高锰酸钾、硫酸亚铁铵、三水合亚甲基蓝,均为分析纯。所有试剂均未经过预处理直接使用,实验用水均为二次去离子水。
仪器:均相反应器(JXF-8-200);集热式恒温加热磁力搅拌器(DF-101S);恒温培养摇床(THZ 系列);X′pert Pro 型X 射线衍射仪;JSM-5610LV/INCA系列低真空扫描电子显微镜;Autosorb-iQ 全自动气体吸附分析仪;TU1901 紫外可见分光光度计。
1.2 不同晶型MnO2 的制备
称取1.1 g KMnO4置于70 mL 二次水中,磁力搅拌至充分溶解后加入0.684 g 的(NH4)2Fe(SO4)2,继续搅拌使二者混合均匀。将混合液转入100 mL 聚四氟乙烯内衬的高压反应釜中,在240 ℃水热处理0.5 h。冷却至室温后过滤,水洗,所得滤饼置于80 ℃烘箱中干燥12 h,即可制得δ-MnO2。将反应时间延长至24 h,所得产品为α-MnO2。
1.3 吸附实验
称取1.16 g 三水合亚甲基蓝溶解于1000 mL二次水中得到质量浓度为1 g/L 的亚甲基蓝标准储备液。用适量二次水将1 g/L 的亚甲基蓝标准储备液稀释到10 mg/L 用于吸附实验。
1)吸附时间对吸附性能的影响实验。分别将0.1 g 的α-MnO2和δ-MnO2加入20 mL 质量浓度为10 mg/L 的亚甲基蓝溶液中,用0.1 mol/L 的NaOH溶液调节pH=10.0±0.1,在25 ℃的恒温培养摇床中以200 r/min 的速度振荡不同的时间,用移液枪吸取上清液,稀释后用TU1901 紫外可见分光光度计检测亚甲基蓝的浓度。
2)不同pH 条件下的吸附实验。分别将0.1 g 的α-MnO2和δ-MnO2加入20 mL 质量浓度为10 mg/L的亚甲基蓝溶液中,用0.1 mol/L 的HCl 溶液和NaOH溶液调节pH=3.1、5.1、7.0、9.0、10.0,后续检测同吸附时间的影响实验(振荡时间为60 min)。
3)吸附剂用量对吸附性能的影响实验。分别称取0.10、0.20、0.35、0.50 g 的α-MnO2和δ-MnO2加入20 mL 质量浓度为10 mg/L 的亚甲基蓝溶液中,用0.1 mol/L 的NaOH 溶液调节pH=10.0±0.1,后续检测同吸附时间的影响实验(振荡时间为200 min)。
吸附实验的平衡吸附容量(qe,mg/g)和去除率(η,%)用以下公式计算:

式中:ρ0为亚甲基蓝初始质量浓度,mg/L;ρe为亚甲基蓝平衡质量浓度,mg/L;V 为亚甲基蓝溶液体积,L;m 为吸附剂质量,g。
2 结果与讨论
2.1 反应时间对二氧化锰晶型和形貌的影响
图1 为240 ℃条件下不同反应时间制备产物的XRD 谱图。当反应时间为0.5 h 时,所得产物在2θ为12.2、22.4、36.6°附近出现衍射峰,分别对应于单斜晶系K0.5Mn2O4·1.5H2O(PDF# 42-1317)的(001)(002)(110)晶面[6],表明产物为层状δ-MnO2。当反应时间为2 h 时,所得产物在2θ 为12.8、18.2、28.8、37.6、41.9、49.8、60.2°附近出现较强衍射峰,可分别归属于四方晶系MnO2(PDF#44-0141)的(100)(200)(310)(211)(420)(411)(521)晶面[7],表 明产 物为α-MnO2。此时样品的XRD 谱图中出现了α-Fe2O3(PDF#33-0664)衍射峰[8],表明产物中含有微量氧化铁杂质,并始终伴随α-MnO2存在。继续延长反应时间,产物的衍射峰位置和强度不再发生明显变化,表明反应时间对产物的晶型有影响。延长反应时间可使δ-MnO2向α-MnO2转化。

图1 不同反应时间制备产物的XRD 谱图
图2 为240 ℃条件下不同反应时间制备产物的SEM 照片。当反应时间为0.5 h 时,δ-MnO2呈现花状形貌,直径为400~500 nm。当反应时间为2 h 时,α-MnO2呈现纳米线形貌,直径为50~100 nm,并伴有少量纳米颗粒。继续延长反应时间发现α-MnO2纳米线形貌不再发生变化,但其形态越来越完整,表面光滑且颗粒物越来越少。上述结果表明水热反应时间对二氧化锰的形貌和晶体生长有重要的影响。

图2 不同反应时间制备产物的SEM 照片
2.2 δ-MnO2 和α-MnO2 的孔结构分析
图3 为δ-MnO2和α-MnO2的N2吸附-脱附等温线和孔径分布曲线。从3a 看出,δ-MnO2的吸-脱附等温线显示有明显的迟滞环,根据IUPAC 分类为典型的Ⅳ型吸附-脱附等温线类型[9],表明内部含有介孔结构。α-MnO2等温线的吸附分支和脱附分支在p/p0<0.92 时完全重合,但在高压区p/p0>0.92 产生迟滞回线,表明内部含有部分介孔结构。结合图3b 中α-MnO2平均孔径尺寸为35.7 nm 和154.6 nm进一步证实其内部含有介孔结构(2~50 nm);除此之外也含有部分大孔结构(>50 nm)。δ-MnO2的平均孔径集中在3.4 nm,表明内部具有高度有序的介孔特征[10]。另外,δ-MnO2的BET 比表面积为219 m2/g、孔体积为0.38 cm3/g,孔结构性质优异。相比而言,α-MnO2的孔结构参数较小,比表面积仅为26 m2/g、孔体积为0.13 cm3/g。这主要是因为二者的晶型和形貌不同导致孔结构参数差别较大。

图3 二氧化锰的N2 吸附-脱附等温线(a)和平均孔径分布曲线(b)
2.3 pH 对吸附性能的影响

图4 pH 对δ-MnO2 与α-MnO2 吸附亚甲基蓝的影响
图4 为δ-MnO2和α-MnO2在不同pH 条件下对亚甲基蓝的吸附效果。当溶液pH 为10.0 时,δ-MnO2对亚甲基蓝的去除率为82.31%,α-MnO2对亚甲基蓝的去除率为84.12%,稍高于前者。由此可知,在相同条件下α-MnO2对亚甲基蓝的吸附效果稍优于δ-MnO2。在众多二氧化锰晶型中,δ-MnO2由于层状结构、 较大的比表面积和较多的表面羟基活性吸附位点而具有良好的吸附性能[2]。研究表明,δ-MnO2吸附亚甲基蓝的机理较为复杂,除了物理吸附和氢键作用外,体系中还可能发生氧化还原反应[1]。本文研究制备的α-MnO2和δ-MnO2对亚甲基蓝的吸附容量相当甚至前者略优(1.69、1.67 mg/g),除了与吸附剂本身结构有关外,还可能与α-MnO2中含有的Fe2O3有关,因为赤铁矿对亚甲基蓝也具有一定的降解作用[11]。
2.4 吸附时间对吸附性能的影响
图5 为δ-MnO2和α-MnO2对亚甲基蓝的吸附动力学曲线图。从图5 看出,在90 min 以前δ-MnO2的吸附容量随着时间的延长增加较快,120 min 时基本达到平衡状态。而α-MnO2吸附容量的变化与前者有所不同,从吸附开始到90 min,尽管吸附容量随着时间的延长逐渐上升,但是变化过程较为平缓,90 min 以后逐渐建立平衡状态。另外,α-MnO2对亚甲基蓝的吸附容量高于δ-MnO2,在120 min 时δ-MnO2和α-MnO2的吸附容量分别为1.66 mg/g 和1.68 mg/g,对应去除率分别为82.9%和84.4%。该结果与2.3 节中pH 对δ-MnO2与α-MnO2吸附亚甲基蓝的影响结论一致。

图5 δ-MnO2 和α-MnO2 对亚甲基蓝的吸附动力学曲线
2.5 吸附剂用量对吸附性能的影响
图6 为不同吸附剂用量条件下δ-MnO2和α-MnO2去除亚甲基蓝的效果。随着吸附剂用量增加,δ-MnO2和α-MnO2对亚甲基蓝的去除率均不断提升,且α-MnO2的提升更为明显。当吸附剂质量为0.5 g 时,δ-MnO2和α-MnO2对亚甲基蓝的去除率分别为89.06%和94.56%。另外,α-MnO2对亚甲基蓝的去除率始终高于δ-MnO2,表明α-MnO2中微量Fe2O3对亚甲基蓝的去除有一定的贡献。
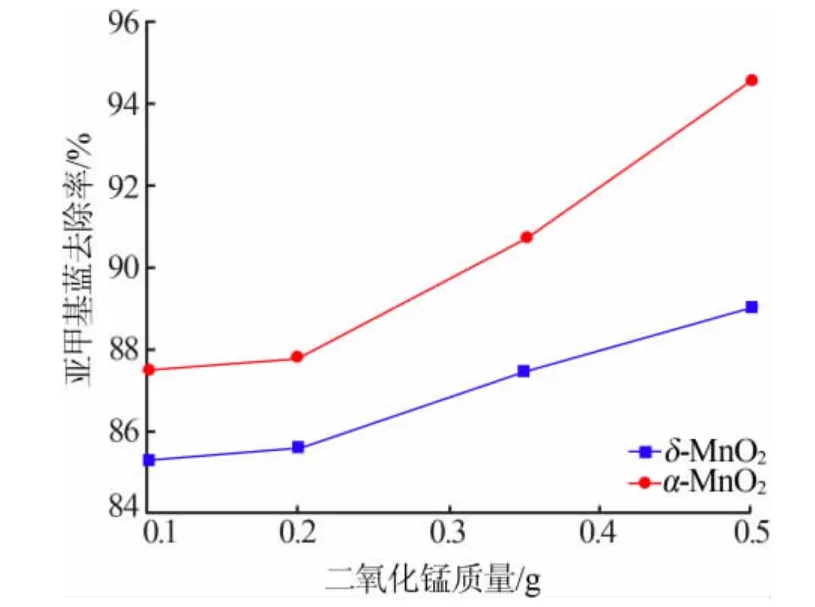
图6 二氧化锰用量对亚甲基蓝去除率的影响
3 结论
1)δ-MnO2和α-MnO2由于晶型不同所显示的形貌也不同,前者为花状微球,后者为纳米线束。二者均为介孔材料,δ-MnO2平均孔径更集中(3.4 nm)、BET 比 表 面 积 更 大(219 m2/g)。2)δ-MnO2和α-MnO2对亚甲基蓝均有一定的吸附能力,但后者吸附效果更好,这与α-MnO2中含有微量Fe2O3有密切关系。δ-MnO2和α-MnO2对亚甲基蓝的吸附在碱性介质中效果更好,当吸附时间达到120 min 时,基本达到吸附平衡状态,去除率分别为82.9%和84.4%。

