双氢青蒿素自微乳给药系统的制备及其评价
张 然,杨 冰,,廖茂梁,,华 洁,,周钰通,,周福军,*,张铁军,*
1.天津医科大学,天津 300070
2.天津药物研究院,天津 300462
3.天津市中药质量标志物重点实验室,天津 300462
4.释药技术与药代动力学国家重点实验室,天津 300462
青蒿素提取分离自黄花蒿Artemisia annuaL.,是一种抗疟药物,其特点有疗效高、毒性较小等[1]。双氢青蒿素(dihydroartemisinin,DHA)是由四氢硼钠还原青蒿素而得,其结构特征为独特的过氧桥,具有多种优点,如药效高、毒性低、在体内吸收快、排泄和代谢迅速、分布广。此外,DHA 的抗疟作用是青蒿素的4~8 倍[2]。有研究表明,DHA 具有抗疟、抗肿瘤、抗炎、抗肺纤维化以及抗其他寄生虫等药理作用[3-4]。但DHA 在水中溶解度较低,其口服生物利用度会受到一定影响,其制剂的开发也受到限制。近年来,研究人员采用增溶技术,如脂质体[5]、环糊精包合物[6]等改善DHA 的溶解度,但其制备工艺复杂,工业化技术要求较高。因此,为进一步提高DHA 的溶解度,应开发制备工艺简单、易于产业化的DHA 新剂型。
自微乳给药系统(self-microemulsion drug delivery system,SMEDDS)是药物、天然或合成油、乳化剂和助乳化剂的均匀混合体系[7-8]。SMEDDS将疏水性药物引入油相体系,在水介质中适度搅拌和适当稀释后形成O/W 型的乳剂,可以大大提高疏水性药物口服生物利用度[9-12]。此外,SMEDDS 还具有较高的生物相容性、稳定性、控释性[13]。近年来,伪三元相图[14-15]作为研究成乳区域的基础工具,操作简单,常与预测效果更好的星点设计-效应面法(CCD-RSM)[16-17]联合用于处方筛选。
因此,为解决DHA 溶解度较差、生物利用度较低等问题,本实验通过绘制伪三元相图筛选处方中辅料(油相、乳化剂和助乳化剂)的比例,采用CCD-RSM 确定处方最佳比例,制备DHA 自微乳(DHA-SMEDDS),进行评价,为进一步研究与开发DHA 的新剂型提供依据,实现提高药物溶解度、增加口服生物利用度、改善胃肠道吸收的目的[18]。
1 材料
1.1 细胞株
犬肾MDCK 细胞,天津药物研究院有限公司惠赠。
1.2 试药
DHA 原料药,昆药集团重庆武陵山制药有限公司,批号C01120200501,质量分数98.2%;DHA对照品,中国食品药品检定研究院,批号100184-201403,质量分数为99.8%;甲醇、乙腈、无水乙醇,色谱纯,天津市康科德科技有限公司;盐酸、磷酸二氢钾,天津市风船化学试剂科技有限公司;磷酸氢二钾,天津市光复科技有限公司;氢氧化钠,天津市凯信化学工业有限公司;正辛醇、聚乙二醇400(PEG400)、聚乙二醇-12-羟基硬脂酸酯(HS15)、中链甘油三酸酯Miglyol 812N、蓖麻油聚烃氧酯(EL35)、聚氧乙烯40 蓖麻油(RH40),北京凤礼精求商贸有限公司;屈臣氏纯净水;1,2-丙二醇,第二军医大学药学系合成药物研究所;辛癸酸甘油酯(MCT),上海佑创实业有限公司;油酸乙酯,国药集团化学试剂有限公司;肉豆蔻酸异丙酯(IPM),上海阿拉丁生化科技股份有限公司;高糖DMEM 培养基、胎牛血清(FBS)、青霉素-链霉素、PBS 缓冲液、胰蛋白酶,美国Gibco 公司;二甲基亚砜(DMSO),美国Sigma 公司;冰冻4%多聚甲醛溶液、DAPI 工作液(1 mg/mL),北京索莱宝科技有限公司;山羊血清工作液,北京康为世纪生物科技有限公司;兔抗ZO-1 抗体,美国Invitrogen Corporation 公司;Triton X-100,北京鼎国昌盛生物技术有限责任公司;Acti-stain 488 phalloidin 荧光标记鬼笔环肽,美国Cytoskeleton 公司;异硫氰酸荧光素(FITC)标记山羊抗兔IgG,武汉谷歌生物科技有限公司;DiBAC4(3),美国Life Technologies公司;Ca2+-ATP 酶、BCA 蛋白定量试剂盒,南京建成生物工程研究所。
1.3 仪器
HPLC Agilent 1260 液相色谱仪,美国Agilent公司;THZ-92C 气浴恒温振摇器,上海博讯实业有限公司医疗设备厂;BS224S 型电子天平,Sartorius公司;SB-3200DTN 超声波清洗机,宁波新芝生物科技股份有限公司;TG20-WS 型高速离心机,长沙维尔康湘鹰离心机有限公司;DF-101S 集热式恒温加热磁力搅拌器,天津赛盟实验仪器有限公司;NANO-ZS90 型马尔文粒度分析仪,英国Malvern公司;HT7700 透射电子显微镜(TEM),日本日立公司;Series Ⅱ型二氧化碳培养箱、Multiskan Go 全自动酶标仪,美国Thermo 公司;超净工作台,Heal Force;CKX-41 型倒置显微镜,日本Olympus 公司;Scientz-IID 型超声波细胞粉碎机,宁波新芝生物科技股份有限公司;细胞计数板,上海市求精生化试剂仪器有限公司;FACS Aira Ⅱ型流式细胞仪,美国BD 公司;IX73 型倒置荧光显微镜,日本奥利巴斯公司;TDL80-2B 型台式离心机,上海安亭科学仪器厂;6 孔细胞培养板、96 孔细胞培养板,美国Corming 公司;激光共聚焦培养皿,上海晶安生物科技有限公司。
2 方法与结果
2.1 DHA-SMEDDS 的制备
固定油相、乳化剂与混合助乳化剂总质量为10 g,称取一定量的油相、乳化剂及混合助乳化剂于茄形瓶中,40 ℃下300 r/min 磁力搅拌30 min,得空白自微乳。于5 g 空白自微乳中精密加入50 mg DHA,40 ℃磁力搅拌1 h,得到DHA-SMEDDS。
2.2 DHA 的含量测定
2.2.1 色谱条件 色谱柱为Reprosil-Pur Basic C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-水;梯度洗脱:0~25 min,40%乙腈;25~40 min,40%~70%乙腈;40~40.1 min,70%~40%乙腈;40.1~50 min,40%乙腈;检测波长216 nm;柱温25 ℃;体积流量1.0 mL/min;进样量20 μL。
2.2.2 对照品储备液配制 精密量取适量DHA 对照品,用甲醇溶解配制成质量浓度为2.140 8 mg/mL的对照品储备液。
2.2.3 对照品溶液配制 精密吸取“2.2.2”项下对照品储备液2.5 mL 于10 mL 量瓶中,用甲醇稀释至刻度,摇匀,分别得到质量浓度为535.2 μg/mL的对照品溶液。
2.2.4 供试品溶液配制 精密量取DHA-SMEDDS 0.5 g 于10 mL 量瓶中,加甲醇适量,超声30 min,冷却至室温后加甲醇稀释至刻度,摇匀,0.22 μm微孔滤膜滤过,取续滤液得到供试品溶液。同法制备SMEDDS 空白对照溶液。
2.2.5 专属性考察 分别取SMEDDS 空白对照溶液、DHA 对照品溶液、DHA-SMEDDS 供试品溶液各20 μL,按照“2.2.1”项下色谱条件进行测定,并记录图谱。专属性实验表明,DHA 呈现2 个色谱峰,分别为α-DHA 和β-DHA,实验样品不干扰DHA的测定,色谱图见图1。
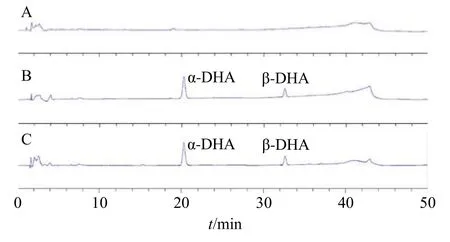
图1 SMEDDS 空白对照 (A)、DHA 对照品溶液 (B)、DHA-SMEDDS (C) 的HPLC 图Fig.1 HPLC of blank SMEDDS (A),DHA reference solution (B) and DHA-SMEDDS (C)
2.2.6 线性关系考察 精密吸取“2.2.2”项下对照品储备液0.1、0.5、1.0、2.5、3.0、5.0 mL 于5 mL量瓶中,用甲醇稀释至刻度,摇匀,分别得到质量浓度为0.042 8、0.214 1、0.428 2、1.070 4、1.284 5、2.140 8 mg/mL 的系列对照品溶液。精密吸取上述系列对照品溶液,按照“2.2.1”项下色谱条件进样测定,记录峰面积,以DHA 2 个色谱峰的峰面积和为纵坐标(Y),其质量浓度(C)为横坐标(X)作线性回归,得到回归方程Y=503.24X+1.642 9,r=0.999 9。结果表明DHA 在42.8~2 140.8 μg/mL 线性关系良好。
2.2.7 精密度考察 精密吸取“2.2.3”项下对照品溶液,按照“2.2.1”项下色谱条件进样测定,连续测定6 次,记录DHA 2 个色谱峰峰面积和。经计算,DHA 2 个色谱峰峰面积和RSD 为0.23%,结果表明仪器精密度良好。
2.2.8 重复性考察 按“2.2.4”项方法制备供试品溶液6 份,按“2.2.1”项下色谱条件连续进样测定6 次,记录DHA 2 个色谱峰峰面积和。经计算,DHA 2 个色谱峰峰面积和RSD 为0.36%,结果表明该方法重复性良好。
2.2.9 稳定性考察 精密吸取“2.2.4”项下适量的供试品溶液,分别于0、8、10、12、21、24 h,按“2.2.1”项下色谱条件测定并记录DHA 2 个色谱峰峰面积和。DHA-SMEDDS 供试品溶液的DHA 2 个色谱峰峰面积和的RSD 为0.43%,结果表明DHASMEDDS 供试品溶液在24 h 内稳定性良好。
2.2.10 加样回收率考察 精密量取已知质量分数的DHA-SMEDDS 9 份,每份0.25 g,置于10 mL量瓶中,分为3 组,采用加样回收法,分别精密添加相当于供试品溶液中DHA 质量分数的80%、100%、120%的DHA 对照品各3 份,加甲醇适量,超声30 min,冷却至室温后加甲醇稀释至刻度,摇匀,0.22 μm 微孔滤膜滤过,取续滤液按“2.2.1”项下色谱条件进样测定并计算加样回收率。结果表明,DHA 的平均加样回收率为100.12%,RSD 为1.79%。回收率符合要求。
2.3 不同溶液中DHA 平衡溶解度的测定
取过量的DHA 原料药于10 mL具塞离心管中,分别加入水、0.1 mol/L 盐酸以及不同pH 值(2.0、3.0、4.0、5.0、5.8、6.0、6.8、7.4)的磷酸盐缓冲液(PBS),放入37 ℃气浴恒温振摇器中,110 r/min振摇24 h,取出后用0.22 μm 微孔滤膜滤过,取续滤液用甲醇稀释适宜的倍数,滤过,按照“2.2.1”项下色谱条件,精密吸取20 µL,测定,记录DHA 2 个色谱峰峰面积和,计算其平衡溶解度。实验结果显示,DHA 在0.1 mol/L 盐酸、不同pH 值(2.0、3.0、4.0、5.0、5.8、6.0、6.8、7.4)的PBS 和水中的平衡溶解度分别为120.4、168.9、167.0、167.8、150.6、141.1、125.8、112.7、46.8、148.1 μg/mL,见表1。
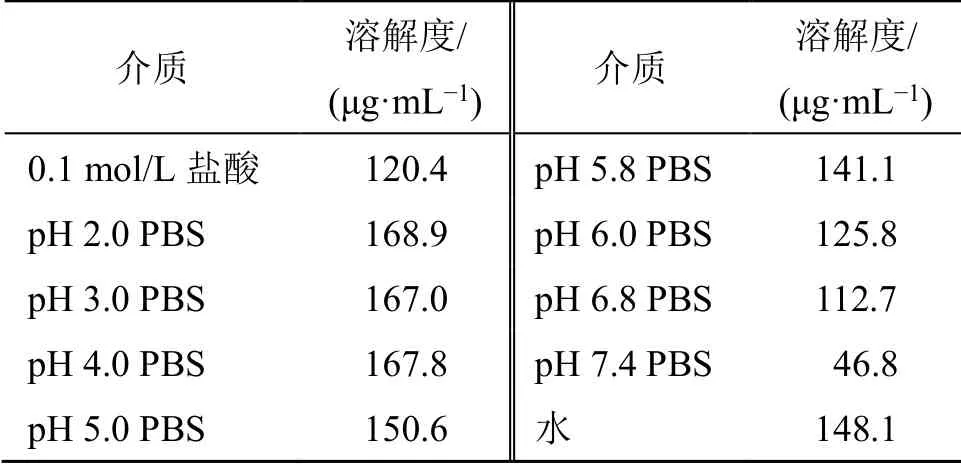
表1 37 ℃下DHA 在不同溶液中的平衡溶解度Table 1 Equilibrium solubilities of DHA in different solution at 37 ℃
2.4 不同溶液中DHA 的表观油水分配系数(P)的测定
取DHA 适量,溶于25 mL 水饱和的正辛醇中,用甲醇稀释至标准曲线范围内后,滤过,按照“2.2.1”项下色谱条件,精密吸取20 μL,测定,记录DHA 2 个色谱峰峰面积和,计算其初始质量浓度(C0)为4.198 7 mg/mL。分别精密吸取上述正辛醇溶液各2 mL,共5 份,置于10 mL 离心管中,分别加入正辛醇饱和的水相(水、0.1 mol/L 的盐酸溶液以及pH 5.8、6.8、7.4 的PBS)各2 mL,放入气浴恒温振摇器中,在37 ℃下,110 r/min 振荡24 h,取出,3500 r/min 离心10 min,静置分层,精密吸取上层正辛醇相1 mL 至5 mL 量瓶中,用甲醇稀释至刻度,摇匀,滤过,按照“2.2.1”项下色谱条件,精密吸取20 µL,测定,记录DHA 2 个色谱峰峰面积和,外标法计算其质量浓度(C油),进而计算DHA 的P,计算公式为P=C油/(C0-C油)。
实验结果(表2)显示,DHA 在0.1 mol/L 盐酸,pH 5.8、6.8、7.4 的PBS 以及水中的P的lgP值均大于1,提示药物的脂溶性较好。
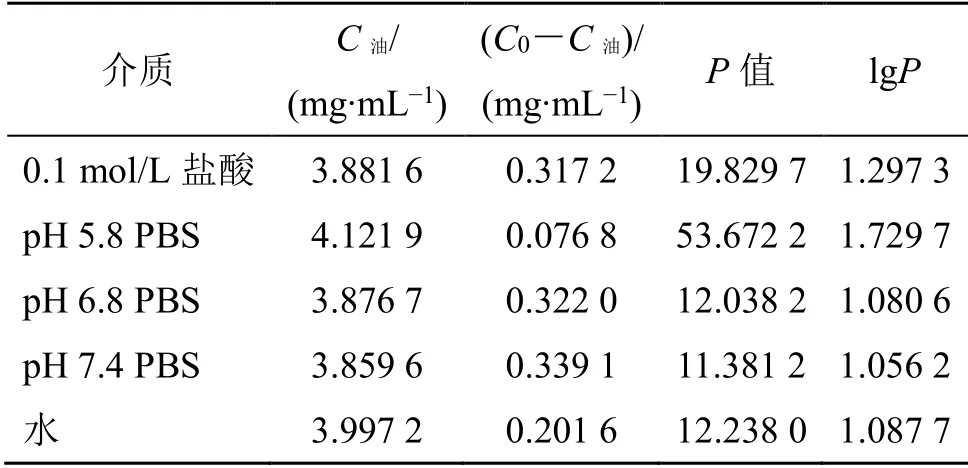
表2 37 ℃下DHA 在不同溶液中的PTable 2 P of DHA in different media at 37 ℃
2.5 DHA-SMEDDS 处方筛选
2.5.1 DHA 在不同辅料中的饱和溶解度试验 称取过量的DHA 原料药于10 mL 具塞离心管中,分别加入不同的油相(Miglyol 812N、橄榄油、MCT、IPM 和油酸乙酯)和助乳化剂(无水乙醇、1,2-丙二醇和PEG400)各10 g,涡旋混匀,40 ℃、110 r/min恒温振荡24 h。达到平衡后,10 000 r/min 离心10 min,吸取适量的上清液并用0.22 μm 微孔滤膜滤过,取续滤液用甲醇稀释至适当质量浓度,滤过,按照“2.2.1”项下色谱条件测定续滤液中DHA 的含量。计算DHA 在不同油相和助乳化剂中的溶解度。结果显示,DHA 在不同油相中的饱和溶解度大小依次为Miglyol 812N>MCT>橄榄油;在助乳化剂中的饱和溶解度大小依次为无水乙醇>PEG 400>丙二醇。DHA 在Miglyol 812N 和MCT 溶解度较好,均可用作油相,考虑到MCT 成本较低,易于获得,故选用溶解度较高的MCT 作为油相。DHA 在无水乙醇和PEG400 溶解度较好,均可用作助乳化剂。结果见表3。
2.5.2 乳化剂的筛选 为了进一步考察辅料的相容性,筛选出乳化效果好的乳化剂,分别将油相与RH40、EL35、HS15 按1∶2、1∶1.5、1∶1、1.5∶1、2∶1 的比例在40 ℃磁力搅拌充分混匀后观察其在纯化水中的分散情况,取适量上述基质,用纯化水稀释适当的倍数,轻轻振摇使其充分乳化,观察自微乳液的情况,从而选出乳化效果较好的乳化剂。
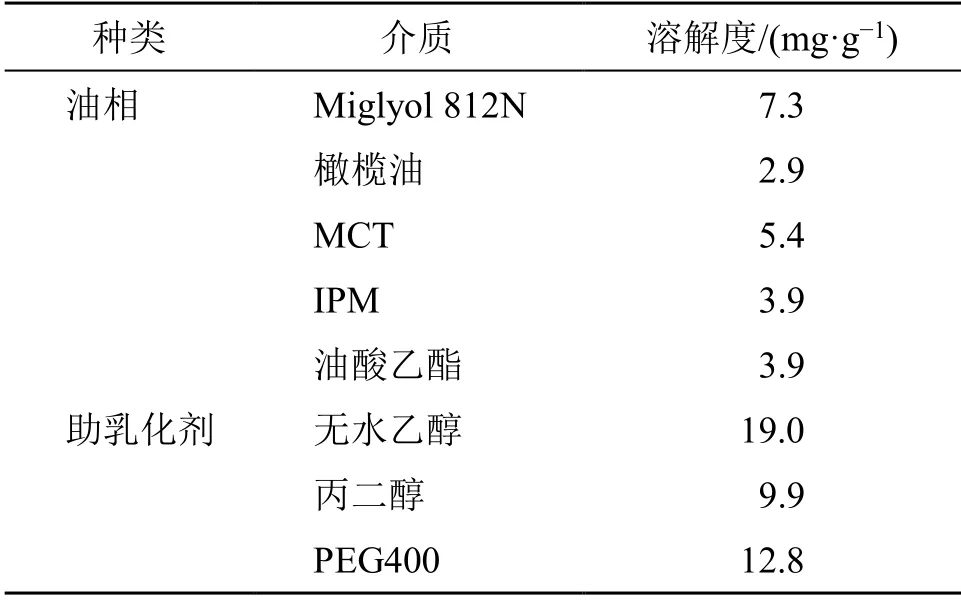
表3 40 ℃下DHA 在不同辅料中的溶解度Table 3 Solubility of DHA in different accessories at 40 ℃
将自乳化情况按照以下3 个级别进行评定:(a)溶液透明澄清,无色或者淡蓝色;(b)溶液略浑浊,显蓝白色乳光;(c)不透明黏稠液体[19]。实验结果表明:当MCT 与RH40 的比例为1∶2、1∶1.5、1∶1、1.5∶1、2∶1 时,自乳化情况分别为a、a、a、b 和b;当MCT 与EL35 的比例为1∶2 时,自乳化情况为a,当其比例为1∶1.5、1∶1、1.5∶1 时,自乳化情况均为b,当比例为2∶1 时,自乳化情况为c;MCT 与HS15 配伍时,乳化情况与EL35 相同。考虑到乳化剂具有较低的毒性,在制备SMEDDS 时应尽可能少的使用乳化剂,因此选择用量少且乳化效果好的RH40 为乳化剂。
2.5.3 助乳化剂的考察 采用PEG400 为助乳化剂,先固定油相与乳化剂的比例为1∶2,考察油相与PEG400 配比为2∶8、2∶4、2∶2、4∶2、8∶2时在40 ℃磁力搅拌充分混匀后观察其在纯化水中的分散情况,取适量上述基质,用纯化水稀释适当的倍数,轻轻振摇使其充分乳化,观察自微乳液是否澄清,以及SMEDDS 在24 h 内是否出现分层情况。评级方法同“2.5.2”项。实验结果表明,以上比例基质的自乳化情况均为a,但SMEDDS 经放置后,24 h 内出现分层现象。为了增加SMEDDS 的稳定性、提高载药量,故加入适量的无水乙醇,制成混合助乳化剂。
2.5.4 混合助乳化剂比例的考察 为确定混合助乳化剂比例,先固定油相、乳化剂、混合助乳化剂的比例为2∶4∶4,考察PEG400 与无水乙醇的比例分别为3∶1、3∶5、3∶9 时,在40 ℃磁力搅拌,充分混匀后观察其在纯化水中的分散情况,取适量上述基质,用纯化水稀释适当的倍数,轻轻振摇,使其充分乳化,观察自微乳液是否澄清,以及SMEDDS 在24 h 内是否出现分层情况。评级方法同“2.5.2”项。实验结果表明,PEG400 与无水乙醇的比例为3∶9、3∶1 时,自乳化情况均为a,但两者配比为3∶1 时SMEDDS 经放置后,24 h 内出现分层现象;而当PEG400 与无水乙醇的比例为3∶5 时,SMEDDS 乳化后的乳液澄清,乳化效果好且在24 h 内不会出现分层现象。因此,确定混合助乳化剂中PEG400 与无水乙醇的比例为3∶5。
2.5.5 伪三元相图的绘制 将乳化剂与混合助乳化剂按照质量比(Km)为1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1 混合后,再与油相按照比例为1∶9~9∶1 进行混合,固定总量为5 g,分别称取相应的MCT、RH40 和混合助乳化剂(PEG400 和无水乙醇),40 ℃水浴磁力搅拌混合30 min,形成均匀透明状液体,称取0.1 g 空白自微乳加纯化水稀释100 倍,观察SMEDDS 的乳化情况,以及在24 h 内是否发生分层。选取自乳化后的溶液透明澄清,呈现无色或者淡蓝色的成乳区域,将伪三元相图的3 个顶点设置为MCT、RH40、混合助乳化剂,使用Origin 2018 绘制空白SMEDDS 的伪三元相图,确定有效自微乳化区域。由图2可知,当油相、乳化剂和混合助乳化剂分别为MCT、RH40、PEG400 与无水乙醇(3∶5)时,各相所占比例分别为10%~30%、27%~81%、7%~63%。所筛选的DHA 空白自微乳加纯化水稀释100 倍后溶液呈澄清或微泛蓝色,并且在24 h 内不会发生分层现象。结果见图2。
2.6 CCD-RSM 优化DHA-SMEDDS 的处方
2.6.1 CCD-RSM 确定最优处方 选择自变量时应考虑该因素是否对SMEDDS 的形成有显著性影响,因此,选定油相质量分数(X1)、乳化剂与混合助乳化剂的质量比(Km,X2)为自变量。选择评价SMEDDS 体系的平均粒径(Y1)和SMEDDS 处方载药量(Y2)为处方评价的因变量。按处方比例精密称取油相、乳化剂、混合助乳化剂,40 ℃磁力搅拌30 min 后加入过量DHA,混匀,10 000 r/min 离心10 min,取上清液即得DHA-SMEDDS。取适量DHA-SMEDDS,加纯化水稀释适当的倍数,摇匀,移取适量上清液,采用马尔文激光粒度仪测定平均粒径。精密称取上述DHA-SMEDDS 1 g 置于10 mL量瓶中,加纯化水稀释至刻度,10 000 r/min 离心15 min,用0.22 μm 的滤膜滤过,吸取续滤液5 mL至10 mL 量瓶中,加甲醇适量超声30 min,用甲醇稀释至刻度,摇匀,滤过,按“2.2.1”项下方法测定SMEDDS 中DHA 含量,计算载药量。
实验采用2 因素5 水平的星点设计法(CCD)安排试验,结合伪三元相图,确定油相质量分数(X1)、Km(X2)的范围分别为10%~25%、0.67~1.5。使用Design Expert 10.0 软件对各成分进行多元线性回归和2 项式的拟合,根据拟合方程绘制三维效应面,表示各指标与各成分之间的关系。使用Design Expert 10.0 软件,以平均粒径(Y1)、载药量(Y2)为因变量,X1和X2为自变量,经过对上述因素进行多元线性回归和2 项式方程拟合后,得到拟合方程Y1=32.04+19.28X1-8.02X2-10.04X1X2+9.12X12+0.18X22,R2=0.971 1,P<0.000 1;Y2=13.9+0.31X1+0.59X2+0.12X1X2+0.7X12+1.01X22,R2=0.804 5,P=0.02;由上述方程可知,P均小于0.05,具有显著性差异,平均粒径和载药量均符合多元线性方程,拟合度良好,相关系数较高,结果具有统计学意义。实验结果见表4。
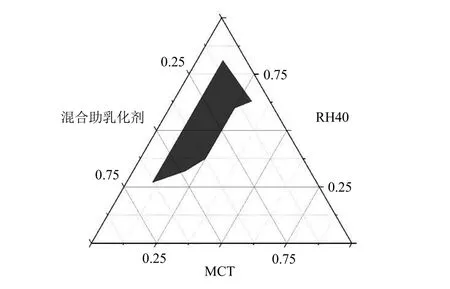
图2 DHA 空白自微乳的伪三元相图Fig.2 Pseudo-ternary phase diagram of blank DHA-SMEDDS
根据上述回归模型,绘制3D 效应面图。结果见图3。其中任一变量保持中央水平不变,其他2个变量在优化水平范围内变化时,油相质量分数、Km之间对于平均粒径而言相互影响较小。平均粒径随油相比例的增加而逐渐增大。而平均粒径因Km条件变化的变化趋势则受油相的影响。油相比例较小时,平均粒径随Km条件的增加而持续增大;油相比例较大时,平均粒径随Km条件的增加而持续减小。油相、Km之间的相互影响对于载药量而言较大。载药量随油相比例、Km的增加而先减后增。
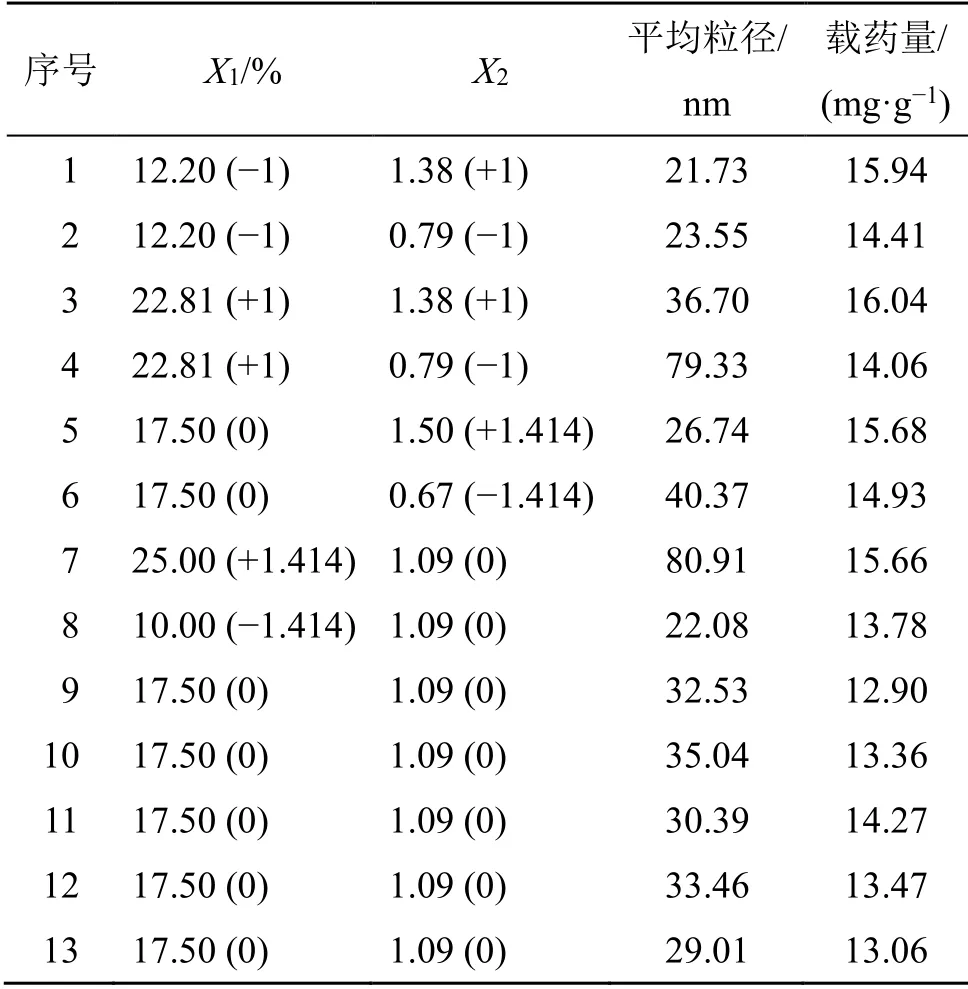
表4 星点设计实验结果Table 4 Experimental results of central composite design

图3 平均粒径和载药量三维效应面图Fig.3 Three-dimensional response surface of average particle size and drug loading
根据自微乳制剂的特点,比表面积和药物溶出与吸收的速度随粒径的减小而增大;载药量越高,实际口服剂量越小[20]。因此,综合考虑乳化剂毒性、无水乙醇含量对临床应用的影响,以粒径≤30 nm为限制条件,油相在15%~25%、Km在0.9~1.2,根据Design Expert 10.0 软件的预测,综合考虑载药量和平均粒径2 个指标对SMEDDS 质量的影响,得到理论最佳处方为油相15%,Km=1.2,即MCT 15%、RH40 46.4%、PEG400 14.48%、无水乙醇24.12%。
2.6.2 最优处方验证 按照最优处方制备3 批DHA-SMEDDS 制剂,取一定量的DHA-SMEDDS制剂用水稀释适宜倍数后,分别测定其粒径与载药量,观察实测的载药量和平均粒径与预测的载药量和平均粒径之间的偏差[偏差=(预测值-实测值)/预测值]。预测值与实测值偏差结果表明,实际的最优处方的平均粒径和载药量与软件预测结果之间偏差的绝对值较小。结果见表5。
表5 星点设计-效应面优化法的验证实验 (±s,n=3)Table 5 Verification experiment of central composite design and response surface optimization method (±s,n=3)
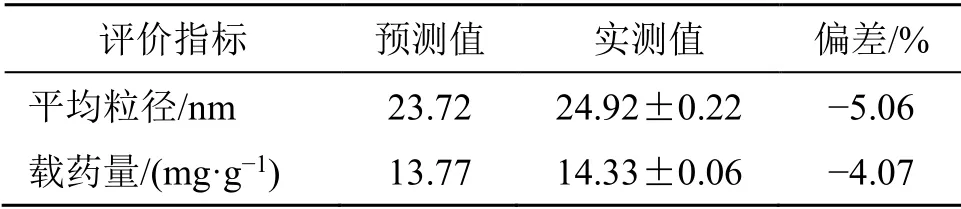
表5 星点设计-效应面优化法的验证实验 (±s,n=3)Table 5 Verification experiment of central composite design and response surface optimization method (±s,n=3)
评价指标 预测值 实测值 偏差/%平均粒径/nm 23.72 24.92±0.22 −5.06载药量/(mg·g−1) 13.77 14.33±0.06 −4.07
2.6.3 处方药物加入量的确定 根据“2.6.1”项下最优自微乳处方配制自微乳基质,分别制成含药量为10、12、15 mg/g 的DHA-SMEDDS,加37 ℃纯化水稀释10 倍,观察是否有药物析出。当DHA 的加入量大于10 mg/g 时,加水乳化后的溶液放置时间在8 h 内有药物析出,其原因可能是载药量超过了自微乳体系可形成稳定的界面膜时的最大承载量,自微乳经乳化后,药物可能没有全部包封在自微乳滴中,有少量药物溶解在乳化剂组成的胶团中,药物超过了乳化剂的溶解能力[20],DHA 结晶析出。因此,将处方中DHA 加入量调整为10 mg/g。
2.6.4 DHA-SMEDDS 的制备 精密称取MCT 3 g,RH40 9.28 g,无水乙醇4.82 g,PEG400 2.90 g 于茄形瓶中,40 ℃下300 r/min 磁力搅拌30 min,得空白自微乳。于空白自微乳中精密加入200 mg DHA,40 ℃磁力搅拌1 h,得到DHA-SMEDDS。
2.7 DHA-SMEDDS 的质量评价
2.7.1 外观观察 DHA-SMEDDS 在25 ℃存放时为透明油状液体,流动性较好。加纯化水稀释100倍后形成的微乳液为淡蓝色澄清透明溶液,具有很好的流动性。
2.7.2 微观形态观察 取DHA-SMEDDS 适量,加纯化水稀释适当的倍数,取少量微乳液滴到测试用有支持膜的铜网上,静置5 min 后,用滤纸吸去多余液体,滴加2%磷钨酸溶液,负染2 min,烘干,于TEM 下观察并记录图像。DHA-SMEDDS 经稀释处理后的乳滴在TEM 下为大小基本相同且分散均匀无粘连的圆球形。TEM 结果见图4。
2.7.3 粒径分布与 Zeta 电位考察 取 DHASMEDDS 适量,加37 ℃纯化水稀释100 倍,制得澄清透明的DHA 微乳液。取微乳液适量,采用马尔文激光粒度分布仪测定DHA-SMEDDS 的平均粒径、多分散性指数(PDI)和Zeta 电位。测定结果表明,DHA-SMEDDS 平均粒径为(24.55±0.18)nm(n=3),PDI 为0.092±0.028(n=3),Zeta 电位为(−3.16±0.14)mV(n=3)。结果见图5。

图4 DHA-SMEDDS 的TEM 图Fig.4 TEM of DHA-SMEDDS
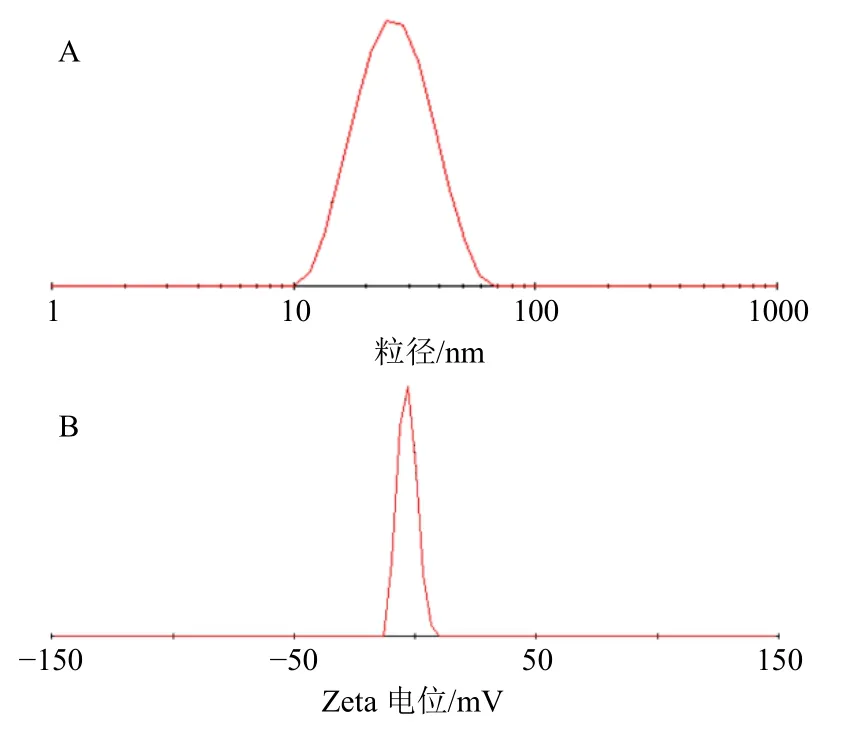
图5 DHA-SMEDDS 的粒径分布 (A) 和Zeta 电位 (B)Fig.5 Particle size distribution (A) and Zeta potential (B)of DHA-SMEDDS
2.7.4 载药量和包封率 精密取DHA-SMEDDS 0.5 g(W0)于10 mL 量瓶中,加甲醇适量,超声30 min,冷却至室温后加甲醇稀释至刻度,摇匀,滤过,按“2.2.1”项下方法测定DHA-SMEDDS 中DHA 质量(W1)。精密取DHA-SMEDDS 1 g 于10 mL 量瓶中,加37 ℃纯化水稀释至刻度,摇匀,制成微乳液,转移至离心管中,10 000 r/min 离心15 min,滤过,精密量取续滤液5 mL 至10 mL 量瓶中,加甲醇适量超声30 min,冷却至室温后加甲醇稀释至刻度,摇匀,滤过,按“2.2.1”项下方法测定DHA质量(W2),根据公式计算载药量和包封率。
载药量=W1/W0
包封率=W2/W1
经计算,DHA-SMEDDS 载药量为(9.64±0.01)mg/g(n=3),包封率为(99.67±0.10)%(n=3)。结果显示,DHA 的载药量和包封率均较好。
2.7.5 乳化时间考察 精密称取DHA-SMEDDS 0.5 g,滴入于300 r/min 磁力搅拌下的50 mL 37 ℃纯化水中进行乳化,测定形成淡蓝色澄清透明溶液所用时间。实验结果表明,DHA-SMEDDS 完全乳化成澄清透明的淡蓝色微乳液所需时间为(13.90±0.10)s,自乳化时间小于2 min,乳化效率高。
2.8 DHA-SMEDDS 稳定性初步研究
2.8.1 高速离心实验 取DHA-SMEDDS 适量,用37 ℃纯化水稀释100 倍,乳化后形成DHA 微乳液,取该微乳液5 mL,10 000 r/min 高速离心15 min,观察微乳液是否分层。结果表明,DHA-SMEDDS的微乳液经高速离心后依然澄清透明,没有产生油水分离及药物析出现象。
2.8.2 强光照实验 分别取DHA-SMEDDS 0.5 g,置于常温(25 ℃)、强光照(4500±500)lx 条件下保存,于第0、5、10 天观察外观,测定平均粒径及DHA 的药物质量分数。结果如表6所示,放置10 d 后,DHA-SMEDDS 及其乳化后的溶液仍澄清透明,微乳液粒径无明显变化,但药物含量下降了15.35%。因此DHA-SMEDDS 应避光保存。
2.8.3 温度对DHA-SMEDDS 稳定性的影响 将DHA-SMEDDS 分别置于4、25 ℃避光保存,于第0、5、10 天观察外观,测定平均粒径及DHA 的药物质量分数。结果如表7所示,4、25 ℃避光放置5、10 d 后,自微乳及其乳化后的溶液仍澄清透明,微乳粒径以及药物含量均无明显变化。因此,DHASMEDDS 应常温避光保存。
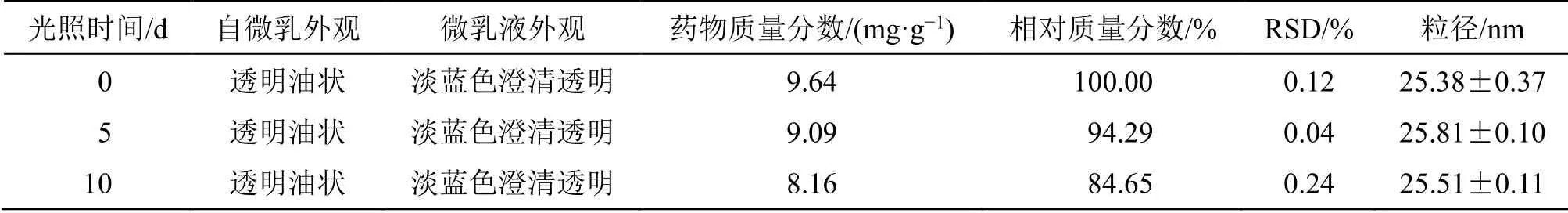
表6 强光照对DHA-SMEDDS 稳定性的影响 (n=3)Table 6 Effects of intense illumination on stability of DHA-SMEDDS (n=3)
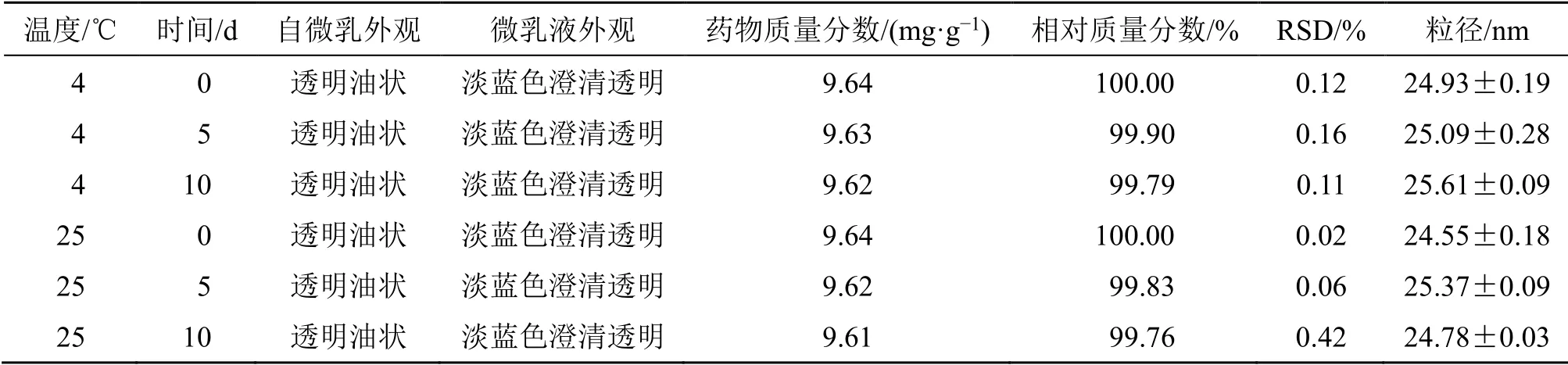
表7 温度对DHA-SMEDDS 稳定性的影响 (n=3)Table 7 Effects of temperature on stability of DHA-SMEDDS (n=3)
2.9 DHA-SMEDDS 在MDCK 细胞模型中促渗机制研究
2.9.1 DHA-SMEDDS 对紧密连接蛋白的影响 将MDCK 细胞按照1×105个/cm2的密度接种于6 孔细胞培养板,将细胞培养板置于CO2培养箱,常规培养24 h。设置如下分组:DHA 组(DHA 5 μg/mL)、空白自微乳2000 倍培养基稀释组、DHA-SMEDDS 2000 倍培养基稀释组(DHA 5 μg/mL)、培养基组作为对照组。按分组给药孵育4 h,弃去药液,每皿加入1.0 mL 冰冻4%多聚甲醛,置于4 ℃环境中固定30 min,每皿中加入100 μL 山羊血清工作液,室温封闭60 min;弃去封闭液,每皿加90 μL 兔抗ZO-1(按比例为1∶80 进行稀释),在4 ℃孵育14 h。分别在每皿中加入90 μL FITC 标记山羊抗兔IgG(按比例为1∶100 进行稀释),室温孵育2 h。
F-actin 蛋白染色:采用上述固定方法进行固定后,PBS 溶液清洗3 次,每皿加入1 mL 1% Triton X-100,在室温中孵育10 min,细胞打孔后每皿加入90 μL Acti-stain 488 Phalloidin 荧光标记鬼笔环肽(按比例为1∶80 进行稀释),室温孵育30 min。紧密连接蛋白染色后每皿滴加90 μL 质量浓度为10 μg/mL 的DAPI 工作液,室温染色10 min,上述每步操作间均用PBS 清洗3 次,最终加入0.5 mL PBS溶液,结果如图6所示。
对照组ZO-1 蛋白边缘清晰,形态完整,荧光强度高;F-actin 呈环状分布于细胞周围清晰明亮,荧光较强。与对照组相比,DHA 作用前后ZO-1 和F-actin 紧密连接蛋白表达无显著性差异,空白自微乳与DHA-SMEDDS 作用后,ZO-1 蛋白荧光强度显著降低,部分条带断裂;F-actin 蛋白荧光强度明显减弱,紧密连接发生断裂。上述结果表明,DHA-SMEDDS 可以减少ZO-1 和F-actin 紧密连接蛋白的表达,进而促进DHA 在MDCK 细胞旁路被动转运。
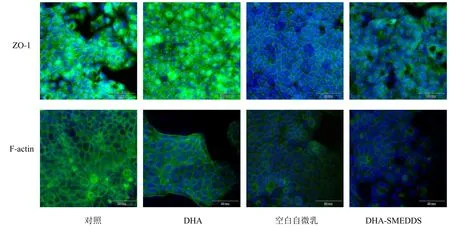
图6 DHA 及DHA-SMEDDS 对MDCK 细胞单层紧密连接蛋白 (ZO-1 和F-actin) 表达的影响 (标尺50 μm)Fig.6 Effects of DHA and DHA-SMEDDS on expression of tight junction proteins (ZO-1 and F-actin) in MDCK cell monolayers (scale 50 μm)
2.9.2 DHA-SMEDDS 对细胞膜电位的影响 将汇合至90%的MDCK 细胞按照1×105个/cm2的密度接种于6 孔细胞培养板,将细胞培养板置于CO2培养箱,常规培养24 h。分组和给药同“2.9.1”项,按分组给药孵育4 h,弃去药液,胰酶消化并离心收集细胞,弃去上清,以PBS 重悬并洗涤细胞2 次,离心收集细胞,每管加入1 mL 质量浓度为5 μg/mL的荧光染料探针DiBAC4(3),重悬细胞,在室温下避光染色30 min,离心收集细胞,弃去上清后以PBS 重悬并洗涤细胞3 次并调整细胞密度约为l×106个/mL。细胞悬液采用流式细胞仪检测荧光强度,设置仪器发射波长为488 nm,激发波长为530 nm,采用未标记荧光的空白细胞管调零。结果见表8。由表8可知,DHA-SMEDDS 组的MDCK 细胞的荧光强度相比于对照组显著增加(P<0.05),DHA 组和空白自微乳组虽然与对照组相比没有显著性差异,但表现出增加的趋势。DHA 作用于MDCK 细胞后可以使细胞膜电位降低,降低细胞膜的黏滞性,增加细胞膜的流动性,SMEDDS 包裹DHA 后可以进一步加强上述作用,使细胞去极化,增加细胞通透性,促进药物的被动转运。
表8 DHA 及DHA-SMEDDS 对MDCK 细胞膜电位的影响(±s,n=3)Table 8 Effects of DHA and DHA-SMEDDS on MDCK membrane potential (±s,n=3)

表8 DHA 及DHA-SMEDDS 对MDCK 细胞膜电位的影响(±s,n=3)Table 8 Effects of DHA and DHA-SMEDDS on MDCK membrane potential (±s,n=3)
与对照组比较:*P<0.05*P < 0.05 vs control group
组别 膜电位 (相对荧光强度)对照 3 832.3±315.5 DHA 4 242.3±178.4空白自微乳 4 252.0±53.5 DHA-SMEDDS 4 744.3±159.0*
2.9.3 DHA-SMEDDS 对Ca2+-ATP 酶活性的影响将汇合至90%的MDCK 细胞按照5×104个/cm2的密度接种于6 孔细胞培养板,将细胞培养板置于CO2培养箱,常规培养24 h。分组和给药同“2.9.1”项,按分组给药孵育4 h,弃去药液,胰酶消化并离心收集细胞,弃去上清,收集细胞,每管加0.2~0.3 mL 生理盐水制成细胞悬液,使用超声粉碎器破碎细胞。细胞破碎悬液采用定磷法测定Ca2+-ATP酶活性。严格按照试剂盒说明书进行操作。DHA 与DHA-SMEDDS 作用后MDCK 细胞Ca2+-ATP 酶活力单位的变化见表9。如表9所示,与对照组相比,DHA、各组自微乳给药4 h 后,Ca2+-ATP 酶活性均显著提高(P<0.05),DHA-SMEDDS 作用后,Ca2+-ATP 酶活性进一步提高,提示该制剂可以增强Ca2+-ATP 酶活性,促进药物跨细胞主动转运。
表9 DHA 及DHA-SMEDDS 对MDCK 细胞Ca2+-ATP 酶活性的影响 (±s,n=3)Table 9 Effects of DHA and DHA-SMEDDS on Ca2+-ATPase activity of MDCK cells (±s,n=3)
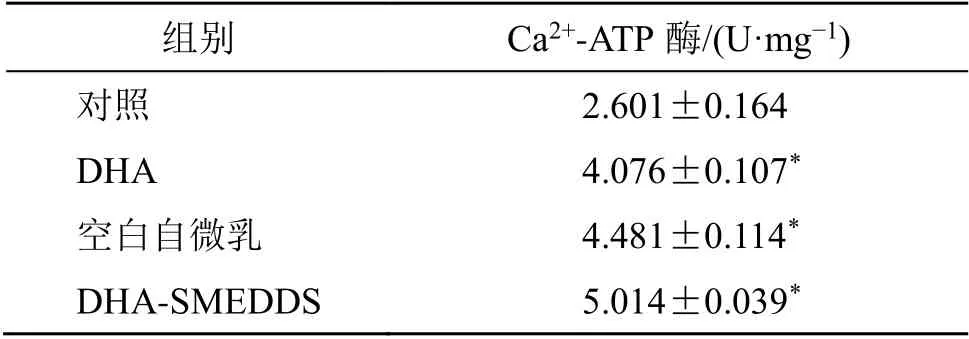
表9 DHA 及DHA-SMEDDS 对MDCK 细胞Ca2+-ATP 酶活性的影响 (±s,n=3)Table 9 Effects of DHA and DHA-SMEDDS on Ca2+-ATPase activity of MDCK cells (±s,n=3)
与对照组比较:*P<0.05*P < 0.05 vs control group
组别 Ca2+-ATP 酶/(U·mg−1)对照 2.601±0.164 DHA 4.076±0.107*空白自微乳 4.481±0.114*DHA-SMEDDS 5.014±0.039*
2.9.4 数据统计 “2.9.2”“2.9.3”项下所有实验数据均以±s表示,采用SPSS 26.0 软件进行处理,各组样本与对照组间比较采用独立样本t检验分析,P<0.05 为差异具有统计学意义。
3 讨论
DHA 是青蒿素的衍生物,其包含独特过氧桥的七元环结构,抗疟活性比青蒿素好,但其水溶性差,稳定性不佳,易受光照、湿热的影响[21]。因此,提高药物的稳定性、溶解度和生物利用度是开发新制剂的研究方向。本研究发现,DHA 在水的平衡溶解度为148.1 μg/mL,属于微溶性药物;在不同pH 值中的平衡溶解度研究发现,在pH 5 左右的环境中相对稳定;DHA 在碱性环境下会转化成其他异构体,因此在制剂的过程中应注意pH 值的控制。
DHA 表观油水分配系数研究显示,DHA 表观油水分配系数P为12.238 0(lgP为1.087 7),DHA的脂溶性较强。一般认为,适宜的水溶性和脂溶性将有利于药物吸收,使药物有效透过生物膜脂质双分子层[22]。SMEDDS 经口服入胃液后,形成小乳滴,可以有效增加药物的溶解度,提高难溶性药物在体内的吸收速度和程度,并具有避免肝首过效应的作用,同时其制备工艺简单,适应于产业化[23],因此,考虑将DHA 制成SMEDDS 制剂,以期提高其溶解度和生物利用度。
SMEDDS 制剂中主要包括油相、乳化剂与助乳化剂等处方影响因素,而其乳化效果主要受油相种类的影响,同时,其粒径大小及稳定性主要由乳化剂决定。助乳化剂的加入可以明显起到增加SMEDDS 对药物的溶解性和稳定性的作用,调节亲水亲油平衡值[24]。本研究将 DHA 制成 DHASMEDDS,首先通过溶解度实验筛选出具有良好溶解性能、成本适宜的MCT 作为油相。通过单因素实验选择具有较好乳化作用的RH40 作为乳化剂。实验过程中发现仅采用PEG400 为助乳化剂时,SMEDDS 的稳定性较差,易产生分层现象,而采用无水乙醇与PEG400 混合助乳化剂时,明显提高了SMEDDS 的稳定性。并对混合助乳化剂的配比进行了系统考察,结果发现PEG400 与无水乙醇配比在3∶5~3∶9 时均具有良好的稳定性。
实验中SMEDDS 粒径为重要的评价指标,其测定方法将影响结果的判断,本课题采用单因素实验考察了稀释倍数、温度等对制剂自乳化粒径的影响,结果显示,采用37 ℃纯化水分别稀释10、50、100 倍,粒径测定无显著影响;采用25 ℃和37 ℃的纯化水稀释同样的倍数,粒径测定无显著影响。
在自微乳初步稳定性实验中,结果显示,DHASMEDDS 的微乳液在高速离心实验中稳定;强光照射使得DHA-SMEDDS 的药物含量下降,SMEDDS不能改变DHA 的光稳定性,储存时应避光;温度影响实验表明25 ℃及4 ℃对DHA-SMEDDS 的稳定性无显著影响,因此,该制剂应常温避光保存。
紧密连接蛋白是调控细胞旁路的主要载体,能够选择性地调节离子、水和水溶性物质通过细胞旁通路的被动扩散[25]。当紧密连接蛋白表达发生改变时,单层膜通透性随之变化,影响药物在细胞旁路的被动转运[26]。DHA-SMEDDS 作用后胞质附着蛋白ZO-1[27]部分条带断裂;细胞骨架蛋白F-actin[28]紧密连接发生断裂、重排,细胞间隙变大。实验结果表明DHA-SMEDDS 可以下调MDCK 细胞的紧密连接蛋白的表达,使细胞的通透性增加,进而促进DHA 的吸收。
膜电位是细胞产生的一种促进离子、营养物质等跨膜运输的电位。细胞膜电位发生改变时,通常细胞膜蛋白结构及其特性例如通透性、黏滞性也会改变,对药物的跨膜转运产生影响[29]。DiBAC4(3)是测量细胞膜电位的敏感慢响应负离子荧光探针,DiBAC4(3)进入细胞,荧光强度越大,细胞膜电位越低,细胞去极化[30]。DHA-SMEDDS 作用后细胞内荧光强度升高,细胞膜电位降低,使细胞通透性增加,促进药物被动转运。
Ca2+是一种重要的细胞内信使,可以调控多种细胞的生理功能,细胞内外Ca2+的转运速度以及浓度受Ca2+-ATP 酶影响,Ca2+-ATP 酶参与细胞调节,使细胞发挥正常功能[31]。MDCK 细胞Ca2+-ATP 酶活性影响实验结果显示,DHA 能够增加Ca2+-ATP酶活性,DHA-SMEDDS 能够加强该作用,若DHA与主动转运的药物连用制成SMEDDS 制剂,可以促进药物跨细胞主动转运。
本研究利用SMEDDS 技术制备了载药量高、粒径小的DHA-SMEDDS,相比于双氢青蒿素脂质体[5],SMEDDS 制备工艺更加简单,易于产业化;与环糊精包合物[6]相比,本研究中制剂的包封率更高,更利于促进药物在体内的吸收,从而提高其口服生物利用度,为该品种的后续研究与开发奠定了实验基础。
利益冲突所有作者均声明不存在利益冲突

