水牛卵泡颗粒细胞对卵母细胞体外成熟的影响
张 俊,石德顺,陆凤花
(广西大学 动物科学技术学院 亚热带农业生物资源保护与利用国家重点实验室,广西 南宁 530000)
卵母细胞体外成熟是体外胚胎生产的关键环节,但目前体外成熟的卵母细胞与体内成熟的卵母细胞相比,普遍存在成熟率、受精率低以及后续胚胎发育质量差等问题[1-2],因此,致力于研究卵母细胞体外成熟效率的提高是一项十分有意义的工作,也是近些年科研工作者研究的热点和难点。卵母细胞体外成熟培养体系是制约卵母细胞体外成熟效率的关键因素[3],与卵母细胞体内成熟的卵泡环境相比,卵母细胞体外成熟体系远不能满足卵母细胞成熟发育所需,因而,尽可能模拟卵母细胞体内成熟环境,不断完善卵母细胞体外成熟培养体系,是研究卵母细胞体外成熟的重点工作。
卵母细胞体内成熟的完成是在卵泡中进行的,因此,卵泡细胞可能对卵母细胞成熟效果产生重大影响[4]。卵泡细胞主要包括颗粒细胞、内膜细胞和卵丘细胞,目前有关颗粒细胞[5-9]、内膜细胞[10]和卵丘细胞[11-19]对卵母细胞体外成熟的影响已有诸多报道。但有关颗粒细胞对卵母细胞体外成熟影响的研究结果说法不一,有研究指出颗粒细胞能提高猪[20]、绵羊[21]和人[22]卵母细胞体外成熟和早期胚胎发育,也有研究表明颗粒细胞及其条件液能抑制牛卵母细胞体外成熟及早期胚胎的发育[10]。但颗粒细胞对水牛卵母细胞体外成熟的影响,目前尚未见有报道。本研究通过对卵母细胞体外成熟率和早期孤雌胚胎发育能力的测定,主要研究颗粒细胞条件液和单层颗粒细胞对水牛卵母细胞体外成熟的影响,以期从颗粒细胞共培养的角度进一步完善水牛卵母细胞体外成熟培养系统。
1 材料与方法
1.1 主要试剂及配制TCM199和血清(Gibco公司), 其他试剂无特别说明均购自Sigma公司。清洗液(CCM):TCM199+5 mmol/L NaHCO3+5 mmol/L Hepes+2%~3% 发情牛血清(oestrous cow serum,OCS);成熟液(M):TCM199+26.2 mmol/L NaHCO3+5 mmol/L Hepes+5% OCS+0.1 mg/L FSH;胚胎培养液(CM):TCM199+26.2 mmol/L NaHCO3+5 mmol/L Hepes+5% OCS;离子霉素溶液:CM液+5 μmol/L离子霉素;6-DMAP溶液:CM液+2 mmol/L 6-DMAP。CCM液、M液和CM液均添加60 mg/L青霉素和100 mg/L 链霉素,并用0.22 μm微孔滤膜过滤器除菌。
1.2 材料来源及处理
1.2.1水牛卵母细胞的收集 所用卵巢从南宁市屠宰场收集中国沼泽型水牛卵巢,收集后放置盛有37℃生理盐水的保温瓶,确保2~3 h内送达实验室。用眼科剪刀将卵巢周围的脂肪组织去除,用一次性12号10 mL注射器抽取直径2~6 mm卵泡的卵泡液,将卵泡液置于60 mm玻璃皿;体式显微镜下捡出卵丘卵母细胞复合体(COCs),用CCM液清洗干净,放入装有1.5 mL M液的玻璃皿进行成熟,注意只选取卵丘细胞层完整和胞质均匀的卵母细胞进行后续试验。
1.2.2水牛颗粒细胞的收集以及颗粒细胞条件液的获取 用生理盐水清洗卵巢后,用12号10 mL注射器抽取直径2~6 mm卵泡(大卵泡闭锁比例较高,小卵泡发育程度较低)的卵泡液,将抽取的卵泡液用孔径40 μm细胞筛过滤,并收集到离心管,1 200 r/min 离心5 min,弃上清后用PBS重悬清洗细胞,离心再用PBS重悬,如此反复1次,最后将清洗干净的颗粒细胞接种至60 mm细胞培养皿进行培养(图1)。
图1 显微镜下水牛颗粒细胞(GC)图(第0代至第3代)
选取第1代到第3代生长状态良好水牛颗粒细胞,传至12孔板5个孔中,确保每孔细胞汇合度至少70%,从传代接种开始计时,每24 h收集1个孔的培养基,如此连续收集5 d,其收集液体为颗粒细胞传代接种后1~5 d的颗粒细胞条件液(GCCM)。在进行颗粒细胞条件液收集期间,每孔细胞均不更换新鲜培养基。
1.3 水牛卵母细胞的体外成熟以及孤雌激活收集的水牛COCs经清洗干净后,置于放有1.5 mL M液玻璃皿中,在5% CO2、38.5℃培养箱中成熟24 h。卵母细胞成熟后,用吸管反复抽打,尽可能吹掉卵母细胞周围扩展的卵丘细胞,然后对成熟好的卵母细胞进行孤雌激活。
卵母细胞体外成熟22~24 h,吹掉卵母细胞周围卵丘细胞,用CM液清洗3遍,用5 μmol/L离子霉素溶液(ionomycin)激活5 min;在含有2 mmol/L 6-DMAP的培养液中培养4 h,再用CM液清洗3次,移至含有黄牛卵丘细胞单层的微滴培养盘中进行培养,观察记录卵裂数和囊胚发育数。
1.4 水牛卵母细胞体外成熟率和早期胚胎发育潜力的评定卵母细胞体外成熟24 h后,吹掉卵母细胞周围卵丘细胞,在体式显微镜下观察统计卵母细胞的第一极体排出情况。卵母细胞孤雌激活后,移至有黄牛卵丘单层细胞的微滴培养盘后,24 h记录统计分裂数,5~8 d记录统计囊胚数,以孤雌激活后发育的卵裂率和囊胚率来评定早期胚胎的发育潜力。孤雌激活后所使用胚胎培养盘为底部铺有黄牛卵丘单层细胞的微滴培养盘,该培养盘需使用前2 d制备,培养胚胎时,注意每隔2 d更换新鲜培养液。
1.5 水牛卵母细胞体外成熟过程动态变化实时追踪卵母细胞从卵泡液中捡出清洗干净后,从放入成熟液起开始计时,使用Bio Tec Cytation 5(CytationTM5)细胞成像多功能检测系统每隔2 h对卵母细胞卵丘扩展和成熟情况进行实时追踪拍照,以记录卵母细胞体外成熟过程的动态变化情况。
1.6 试验设计
1.6.1试验1 主要探讨成熟培养液中添加不同收集时间颗粒细胞条件液(GCCM)对水牛卵母细胞体外成熟以及早期孤雌胚胎发育的影响。将同一批次水牛COCs分别在添加不同收集时间(0,1,2,3,4,5 d)的GCCM(各组GCCM添加比例均为10%)成熟液中进行体外成熟24 h,观察卵母细胞的成熟率(第一极体排出率),然后将卵母细胞进行孤雌激活,观察早期胚胎发育情况,记录胚胎卵裂率和囊胚率。
1.6.2试验2 主要探讨成熟培养液中不同添加比例GCCM对水牛卵母细胞体外成熟以及早期孤雌胚胎发育的影响。将同一批次水牛COCs分别在添加不同比例GCCM(0%,5%,10%,20%,40%)(各组GCCM收集时间均为2 d)的成熟液中进行体外成熟24 h,观察卵母细胞的成熟率(第一极体排出率),然后将卵母细胞进行孤雌激活,观察早期胚胎发育情况,记录胚胎卵裂率和囊胚率。
1.6.3试验3 主要探讨颗粒细胞在不同状态下对水牛卵母细胞体外成熟以及早期孤雌胚胎发育的影响。试验分3组:(1)M液(对照);(2)M液+GC单层细胞;(3)M液+GCCM。将同一批次水牛COCs分别在上述3组中进行体外成熟24 h,观察卵母细胞的成熟率(第一极体排出率),然后将卵母细胞进行孤雌激活,观察早期胚胎发育情况,记录胚胎卵裂率和囊胚率。
1.6.4试验4 主要探讨颗粒细胞在不同状态下对水牛卵母细胞体外成熟过程动态变化的影响。试验分3组:(1)M液(对照);(2)M液+GC单层细胞;(3)M液+GCCM。从放入成熟液开始计时,每隔2 h对卵母细胞动态变化进行跟踪拍照记录。
1.7 数据分析利用SPSS 22.0软件对统计数据进行处理并分析差异显著性,P>0.05表示差异不显著,P<0.05表示差异显著,每个试验至少5次生物学重复(n=5),即同一试验处理中用相互独立的水牛卵母细胞进行至少5次重复。
2 结果
2.1 成熟培养液添加不同收集时间GCCM对水牛卵母细胞体外成熟及早期胚胎发育的影响水牛COCs分别在添加不同收集时间GCCM(0,1,2,3,4,5 d)的成熟液中培养24 h后,观察卵母细胞成熟情况。结果表明(表1):相对于0 d GCCM对照组,1,2,3 d GCCM处理组水牛卵母细胞体外成熟率没有显著性差异(P>0.05),但4 d和5 d GCCM处理组的成熟率显著降低(P<0.05);由此说明,GCCM的适宜收集时间点为颗粒细胞接种后1~3 d。
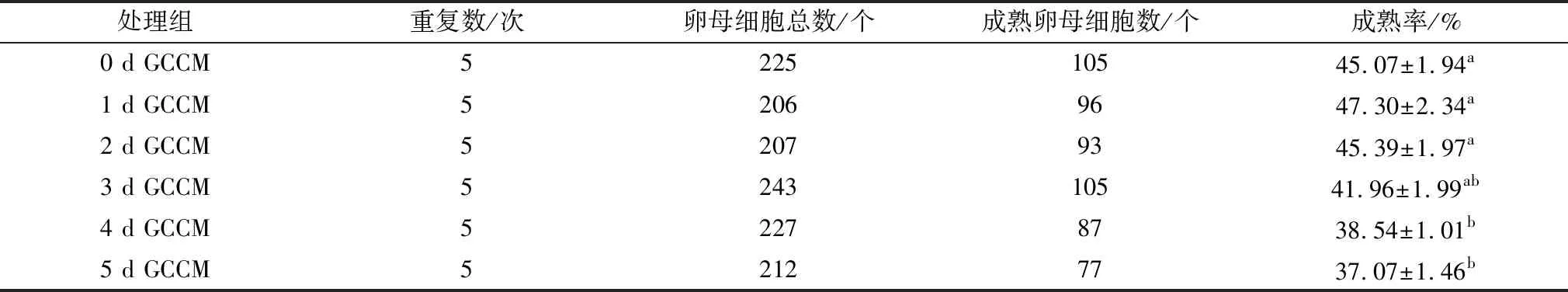
表1 不同收集时间GCCM对水牛卵母细胞体外成熟率的影响
水牛COCs分别在添加不同收集时间GCCM(0,1,2,3,4,5 d)的成熟液中培养24 h后进行孤雌激活,观察胚胎发育情况。结果发现(表2):2 d GCCM处理组的水牛卵母细胞卵裂率与囊胚率均显著高于0 d GCCM对照组(P<0.05),由此说明,收集2 d GCCM添加到成熟液中最有利于水牛卵母细胞体外成熟和早期胚胎发育。
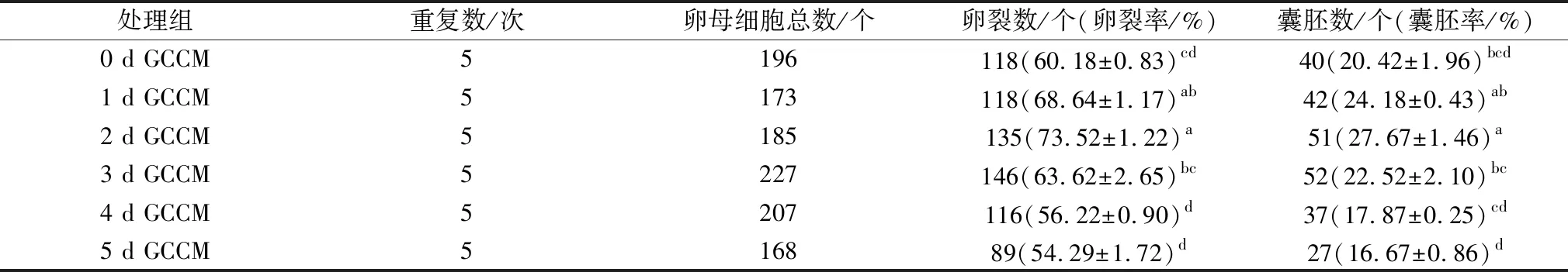
表2 不同收集时间GCCM对水牛卵母细胞体外成熟后早期胚胎发育的影响
2.2 成熟培养液中不同添加比例GCCM对水牛卵母细胞体外成熟及早期胚胎发育的影响水牛COCs分别在添加不同比例GCCM(0%,5%,10%,20%,40%)的成熟液中培养24 h后,观察卵母细胞成熟情况。结果显示(表3):相对0% GCCM对照组,5%,10% GCCM处理组水牛卵母细胞体外成熟率没有显著性差异(P>0.05),但20%,40% GCCM处理组的成熟率显著降低(P<0.05);由此说明,GCCM添加比例以不超过20%为宜。

表3 不同添加比例GCCM对水牛卵母细胞体外成熟率的影响
水牛COCs分别在不同添加比例GCCM(0%,5%,10%,20%,40%)的成熟液中培养24 h后进行孤雌激活,观察胚胎发育情况。结果发现(表4):20% GCCM处理组的水牛卵母细胞卵裂率与囊胚率均显著高于0% GCCM对照组(P<0.05),由此说明,收集2 d GCCM添加到成熟液中最有利于水牛卵母细胞体外成熟和早期胚胎发育。
综合上述试验结果考虑,添加收集时间点2 d、添加比例20% GCCM到水牛卵母细胞成熟液中最为合适,最有利于水牛卵母细胞体外成熟和早期胚胎发育。
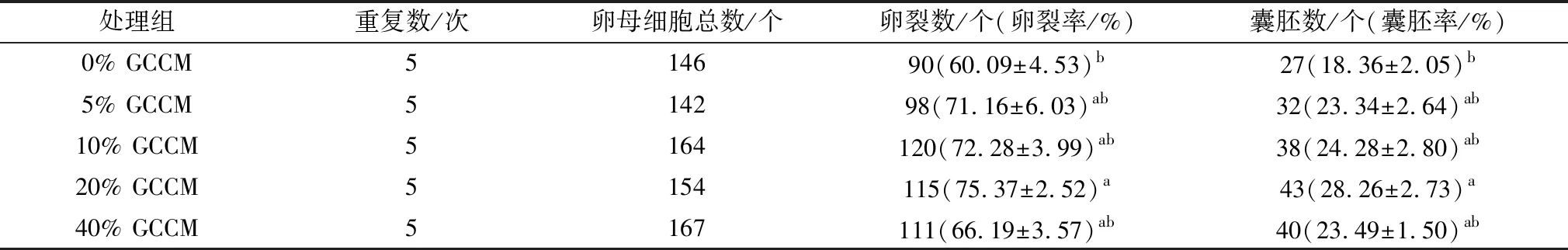
表4 不同添加比例GCCM对水牛卵母细胞体外成熟后早期胚胎发育的影响
2.3 颗粒细胞(GC)在不同状态下对水牛卵母细胞体外成熟及早期胚胎发育的影响水牛COCs分别在GC不同状态(M液即对照,GC单层细胞,2 d+20% GCCM)的成熟液中培养24 h后,观察卵母细胞成熟情况。结果表明(表5):相对于M液对照组,GCCM处理组水牛卵母细胞体外成熟率没有显著性差异(P>0.05),但底部铺有GC单层细胞处理组水牛卵母细胞的成熟率显著低于对照组(P<0.05)。
水牛COCs分别在GC不同状态(M液,GC单层细胞,2 d+20% GCCM)的成熟液中培养24 h后进行孤雌激活,观察胚胎发育情况。结果发现(表6):GCCM处理组的水牛卵母细胞卵裂率与囊胚率均显著高于对照组(P<0.05),但底部铺有GC单层细胞的处理组卵裂率和囊胚率显著低于对照组(P<0.05);由此说明,成熟液中底部铺有GC单层细胞对水牛卵母细胞体外成熟和早期胚胎发育具有抑制作用,而GCCM添加到成熟液对水牛卵母细胞体外成熟和早期胚胎发育具有促进作用。
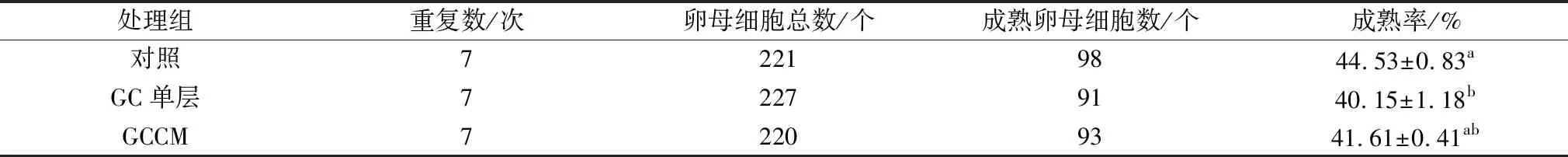
表5 颗粒细胞(GC)在不同状态下对水牛卵母细胞体外成熟率的影响

表6 颗粒细胞(GC)在不同状态下对水牛卵母细胞体外成熟后早期胚胎发育的影响
2.4 颗粒细胞(GC)在不同状态下对水牛卵母细胞体外成熟过程动态变化的影响水牛COCs分别在GC不同状态(M液,GC单层细胞,2 d+20% GCCM)的成熟液培养24 h过程中,使用CytationTM5细胞成像多功能检测系统实时追踪水牛卵母细胞体外成熟过程中细胞动态变化情况,特别是卵母细胞卵丘扩展和细胞体积变大情况等。从追踪水牛卵母细胞动态变化图可知(图2):从0~24 h,对照组水牛卵母细胞基本从4 h起卵母细胞体积开始变大,周围卵丘开始扩展,从8 h起卵母细胞体积迅速增大,卵丘细胞扩展速度加快,至16 h时,卵母细胞体积基本达到最大,卵丘细胞基本扩展完成,从16~24 h卵母细胞基本不发生变化。相对M液对照组,GCCM处理组水牛卵母细胞体积变大和卵丘扩展情况基本和对照组相符,但GCCM处理组卵母细胞卵丘扩展更开,卵母细胞体积也变得更大。但GC单层细胞处理组卵母细胞体积变大和卵丘扩展情况与对照组不同,动态变化图片显示,GC单层细胞组卵母细胞基本从6 h起卵母细胞体积开始变大,周围卵丘开始扩展,从10 h时卵母细胞体积迅速变大,卵丘细胞扩展快速变大,至16 h时卵母细胞体积变大和卵丘扩展基本完成。从水牛卵母细胞体外成熟过程动态变化,GCCM、GC单层细胞处理组与对照组的区别推测,GCCM促进水牛卵母细胞体外成熟和早期胚胎发育以及GC单层细胞抑制水牛卵母细胞体外成熟和早期胚胎发育,可能是因为GC细胞不同状态影响了水牛卵母细胞体外成熟过程中卵丘扩展和卵母细胞体积变化,进而引起卵母细胞内部的生理代谢发生改变,最终影响了卵母细胞的体外成熟。


图2 颗粒细胞在不同状态下对水牛卵母细胞体外成熟动态变化的影响
3 讨论
卵母细胞的体外成熟是卵母细胞逐步获得恢复减数分裂能力和为早期胚胎发育做好准备的过程,卵母细胞的体外成熟会直接影响到卵母细胞后续的受精和胚胎发育能力[23]。卵母细胞获得好的成熟能力,不仅细胞核要成熟,细胞质亦要同步成熟。卵母细胞细胞核成熟通常以第一极体排出率为直接评定指标,细胞质成熟一般比较难以界定,通常以卵母细胞后续早期胚胎发育的卵裂率和囊胚率为间接评定指标[24]。目前,卵母细胞体外成熟存在的主要问题是细胞核和细胞质成熟不同步问题,与卵母细胞成熟体内相比,体外卵母细胞成熟容易出现细胞核先成熟,细胞质成熟滞后现象[25],这直接导致体外成熟卵母细胞质量差、受精率低和胚胎发育质量差等问题。
由于卵母细胞在体内成熟是处于卵泡液环境,并被周围颗粒细胞所包裹,因此颗粒细胞对卵母细胞的成熟起到重要作用,但卵母细胞体外成熟时,颗粒细胞是否对卵母细胞成熟起作用,是否有助于解决卵母细胞体外成熟存在核质不同步问题,这些研究目前已有诸多报道,但研究结果不尽一致。ADELDUST等[21]研究发现,颗粒细胞共培养能提高绵羊卵母细胞体外成熟率和胚胎发育卵裂率,说明颗粒细胞可提高绵羊卵母细胞的细胞核成熟和细胞质成熟。对猪的研究表明,颗粒细胞能提高冷冻复苏后未成熟卵母细胞的细胞核成熟和细胞质成熟[20]。在人上同样也有研究指出,颗粒细胞可提高人卵母细胞体外成熟率和后续胚胎发育囊胚率[22]。石德顺等[10]研究表明,颗粒细胞单层细胞对牛卵母细胞体外成熟后的卵裂率和囊胚率没有显著性影响,但颗粒细胞的条件液能明显抑制牛卵母细胞体外成熟后早期胚胎发育的卵裂率。本研究对水牛的试验结果表明,颗粒细胞条件液和单层细胞对水牛卵母细胞体外成熟和早期胚胎发育的影响结果不同,颗粒细胞条件液能显著提高水牛卵母细胞体外成熟的细胞核成熟和细胞质成熟,但颗粒细胞单层细胞可显著抑制水牛卵母细胞体外成熟的细胞核成熟和细胞质成熟,因此,本研究结果与其他研究结果有异同。
对猪、绵羊和人的试验结果均显示,颗粒细胞单层细胞能提高卵母细胞体外成熟,但本研究在水牛上未能证实颗粒细胞的这一作用效果。分析原因可能是,颗粒细胞的不同状态对水牛卵母细胞体外成熟和早期胚胎发育的影响有很大差异。由于本研究表明颗粒细胞条件液能提高水牛卵母细胞体外成熟,但单层颗粒细胞则抑制成熟,推测颗粒细胞不同状态对水牛卵母细胞体外成熟的动态变化有巨大影响。本研究使用CytationTM5细胞成像多功能检测系统实时追踪水牛卵母细胞体外成熟过程中细胞动态变化也证实了这一点,颗粒细胞单层细胞能明显抑制水牛卵母细胞体外成熟过程中卵母细胞周围卵丘扩展和卵母细胞体积变大速度,与对照组相比,使水牛卵母细胞周围卵丘开始扩展延迟约2 h,且卵母细胞体积变大速度减慢,这表明,从卵母细胞成熟过程的动态变化可知,颗粒细胞单层细胞不利于水牛卵母细胞体外成熟以及后续胚胎发育潜力的获得。至于颗粒细胞在不同状态下,具体影响了卵母细胞体外成熟过程中内部哪些生理过程或者代谢活动,有待进一步研究。
有研究也指出,颗粒细胞能分泌多种生长因子到卵泡液中[26-29],如卵母细胞成熟抑制因子(OMI)等,精密和系统调控卵母细胞成熟的整个过程。张美佳等[30]研究提出,颗粒细胞分泌的卵母细胞成熟抑制因子就是C型钠肽(CNP),该因子是由颗粒细胞分泌,作用于卵母细胞周围卵丘细胞上的受体,进而维持卵母细胞减数分裂的阻滞,提高卵母细胞成熟效果。本研究所使用颗粒细胞条件液能显著提高水牛卵母细胞体外成熟,那么收集使用的颗粒细胞条件液中究竟有哪些生长因子和代谢产物,有哪些生长因子和代谢产物在起作用,又是通过哪些途径在起作用,这是我们所感兴趣和下一步重点研究的内容。
目前,高通量测序技术正蓬勃发展,使用代谢组学和蛋白组学新技术解决卵母细胞成熟的问题是未来发展趋势,特别是研究清楚卵母细胞成熟中颗粒细胞究竟能分泌哪种细胞因子,在卵母细胞体外成熟过程中如何具体起作用,这对于解析清楚卵母细胞成熟过程的具体调控机理具有重要的指导意义。

