化学与物理刺激对马铃薯块茎蛾产卵行为的影响
熊焰,韩瑞,胡纯华,王静,肖春
化学与物理刺激对马铃薯块茎蛾产卵行为的影响
熊焰1,韩瑞1,胡纯华2,王静1,肖春1
1云南农业大学植物保护学院,昆明 650201;2云南农业大学职业与继续教育学院,昆明 650201
【】通过行为观察揭示物理与化学因素联合作用对马铃薯块茎蛾()产卵行为的影响,为马铃薯块茎蛾行为调控技术的发展提供依据。将新鲜马铃薯块茎分别用药液(庚醛、桉叶油醇)浸泡后晾干、用纱布或浸透块茎汁液的纱布包裹块茎,之后在温度(27±2)℃,相对湿度50%—70%,光周期L﹕D=14﹕10环境条件下,于暗期(光照强度1.0—1.5 lx)观察马铃薯块茎蛾已交配雌虫在马铃薯块茎上产卵行为表现(包括滞留时间、降落次数、试探产卵次数和落卵量)。当用低浓度庚醛溶液(0.5 mg·L-1)处理块茎后,可显著延长雌蛾在块茎上的滞留时间,导致总落卵量(块茎上落卵量+块茎外落卵量)增加,但是不会引起试探产卵次数和降落次数的明显变化。当用庚醛溶液(30 mg·L-1)处理块茎后,能够引起滞留时间、降落次数和试探产卵次数的显著降低,并导致总落卵量显著增加。当用低浓度桉叶油醇(6 mg·L-1)处理块茎后,可导致块茎上落卵量显著增加,但滞留时间、降落次数及试探产卵次数均无显著差异。当用高浓度桉叶油醇溶液(30 mg·L-1)处理块茎后,可显著降低雌蛾在块茎上的滞留时间、降落次数和试探产卵次数,同时引起块茎外的落卵量显著增加,但不会引起总落卵量的明显变化。当用纱布包裹块茎后,会显著降低雌蛾的降落次数、试探产卵次数,但不会显著改变滞留时间,块茎上的落卵量以及总落卵量均显著增加。当用浸有块茎汁液的纱布包裹新鲜块茎后,亦获得类似结果。当用含有庚醛(0.5 mg·L-1)的纱布处理块茎后,与空白对照相比,可显著增加雌蛾在块茎上的滞留时间和块茎上的落卵量,同时显著减少雌蛾的试探产卵次数、降落次数;与单一使用庚醛(0.5 mg·L-1)相比,可显著减少雌蛾的试探产卵次数、降落次数,同时显著增加雌蛾在块茎上的落卵量和总卵量;与单一使用纱布处理相比,在各项指标上均无显著性差异。庚醛能够刺激已交配雌蛾在更加密集的时间产卵;在浓度为30 mg·L-1时,庚醛对已交配雌蛾具有驱赶作用;在浓度为0.5 mg·L-1时,庚醛对已交配雌蛾具有吸引作用。桉叶油醇溶液浓度为30 mg·L-1时,对马铃薯块茎蛾产卵仅有驱赶作用。纱布包裹、纱布浸透块茎汁液、6 mg·L-1桉叶油醇溶液仅有刺激已交配雌蛾在更加密集的时间产卵的作用。化学刺激(0.5 mg·L-1庚醛)结合物理刺激(纱布)是纱布刺激产卵作用和0.5 mg·L-1庚醛吸引作用的叠加作用。
马铃薯块茎蛾;物理因素;化学因素;产卵行为
0 引言
【研究意义】化学和物理因素对植食性怀卵雌虫寻找合适的产卵位置尤为重要,物理因素在植食性昆虫接受或拒绝产卵介质中起到一定作用,而化学因素在植食性昆虫产卵寄主选择和定位中发挥重要作用[1-2]。不同植物挥发物组分在植食性怀卵雌虫的产卵行为中表现出不同的作用,有的兼具吸引和刺激产卵作用,部分仅有其中一种作用。因此,确定不同植物挥发物在产卵选择中的作用对开发用于害虫控制的行为调控技术非常重要[3]。马铃薯块茎蛾()是危害马铃薯()的主要害虫之一[4]。据报道,在管理不善的存储仓库中,马铃薯块茎蛾种群可造成高达100%的损失[5]。因此,可通过利用产卵位置所存在的物理或化学因素来调节马铃薯块茎蛾的产卵行为,以减少其对储藏期马铃薯的危害。【前人研究进展】当雌性棉铃虫()产卵时,更多的卵粒会沉积在叶片表面富含腺毛的棉花(spp.)品种上,因为腺毛可以刺激雌性的卵沉积行为[6]。但是,在自然条件下淡褐苹果蛾()的雌性更喜欢将卵产在寄主植物(苹果、梨等)的光滑表面上[7]。马铃薯块茎蛾在田间更喜欢将卵产于裸露的块茎,而不是叶片,在储藏期,其偏好于在眼芽或伤疤上产卵,而不是在存储仓库中光滑的块茎表面[8],且马铃薯块茎蛾偏好于在粗糙的纱布上产卵[9]。此现象说明物理刺激(粗糙度)的改变可以调控马铃薯块茎蛾产卵选择行为。相较于化学防治所带来的严重的“3R”问题[1,10],行为调控由于其安全无毒受到越来越多的重视[11-13]。但作为一种夜蛾,该害虫依靠挥发性气味来寻找宿主[14]。化学因素在马铃薯块茎蛾产卵选择中发挥非常重要的作用[15-17]。可以肯定的是,由于马铃薯块茎挥发物对将要产卵的雌蛾具有很强的吸引力[18],雌蛾可以移动超过100 m并在田间找到破损的马铃薯块茎[19]。桉叶油醇(1, 8-cineole)和庚醛(heptanal)是许多植物精油中的常见成分,刘燕等研究显示桉叶油醇和庚醛均对马铃薯块茎蛾的产卵行为具有很强的调控作用,当两种挥发物分别在较低浓度时,更多的卵沉积在块茎上,而在较高浓度时,较少的卵在块茎上沉积[20]。但是,目前尚不清楚这两种化学物质在低浓度时,是将雌蛾从远处吸引到块茎,还是刺激着陆雌蛾在块茎上产卵,以及这两种化学物质在高浓度时,是将雌蛾驱离块茎以减少卵沉积,还是抑制着陆雌蛾在块茎上产卵。【本研究切入点】现已报道的关于物理和化学刺激对马铃薯块茎蛾产卵方面的影响只是某种或多种刺激作用的结果[8,16-17,21-23]。而关于这些刺激如何影响马铃薯块茎蛾产卵的研究未见报道。【拟解决的关键问题】在马铃薯块茎蛾的产卵高峰期,研究化学因素(桉叶油醇、庚醛和块茎汁)和物理因素(块茎表面的粗糙度)对其产卵行为的影响,为马铃薯块茎蛾行为调控技术的发展打下基础。
1 材料与方法
试验于2017—2018年在云南农业大学植物保护学院完成。
1.1 供试虫源
马铃薯块茎蛾种群是于2017年4月从云南省曲靖市的马铃薯田中采集幼虫建立的,按照Ma等[23]的方法饲养,新孵化幼虫用马铃薯块茎按照20头/块茎((130± 2)g)的密度进行饲养。然后,将被侵害的块茎放入带网的饲养笼中(35 cm×35 cm×35 cm),并以沙作为幼虫化蛹的介质。室内饲养条件为温度(27±2)℃,光周期L﹕D=14 h﹕10 h,相对湿度50%—70%。当成虫羽化后,将20对马铃薯块茎蛾放入一个塑料圆柱形容器(φ=13 cm,h=14.5 cm)中进行交配,并以10%的蜂蜜水为马铃薯块茎蛾提供能量。用网状纱布封闭容器的开口端,在其上放置一张滤纸以沉积卵粒。
将供试马铃薯块茎蛾在蛹期时挑至玻璃瓶中(φ=2 cm,h=4 cm),每瓶1个蛹。待其羽化后,将雌、雄虫(♀﹕♂= 1﹕2)放入塑料圆柱形容器中进行交配24 h,并以10%的蜂蜜水为马铃薯块茎蛾提供能量,然后将2日龄的已交配雌虫用于产卵行为观察。
1.2 已交配雌虫的产卵行为观察
溶液配制:将桉树油醇(95%,Acros Organics,http://www.acros.com)溶于等体积乙醇(99%)和等质量的Tween-80(>99%,Sigma-Adrich,http:// www. sigmaaldrich.com),并用蒸馏水稀释至30和6 mg·L-1两个浓度。以只含等量的乙醇、Tween-80的水溶液为对照。使用上述同样方法配制30和0.5 mg·L-1的庚醛(99%,TCI America,http://www. tcichemicals.com)溶液和只含等量的乙醇、Tween-80的水溶液。在试验前1 d准备每种溶液。此外,将250 g块茎切碎,电动榨汁机研磨,最终获得终浓度为250 g/500 mL的马铃薯汁。在观察之前,将一块纱布浸入马铃薯汁中5 s,风干1 h,然后用纱布包裹块茎(约250 g)进行测试。
在特定的设备中观察马铃薯块茎蛾的产卵行为(图1)。将一个马铃薯块茎放在纸杯(φ=5.5 cm,h=8.5 cm)的上端,在杯中使用软布作为填充物来支撑块茎,以保持≈1/3的块茎裸露在杯子外,块茎的裸露部分表面有3—4个眼芽。然后将杯子+块茎的组合置于圆柱形玻璃容器的中心(φ=12.5 cm,h=15 cm)。该容器的底端用钢筛网(20目)密封,以承载纸杯。将筛环(20目,φ1=5.5 cm,φ2=12.5 cm)放置在块茎的暴露部分周围,以阻止被观察的雌蛾逃出观察区域。容器的上端用均匀刺穿的透明薄膜密封。最后,将一只已交配雌虫放置在观察区域以观察其产卵行为。
观察开始于暗期(光强在1.0—1.5 lx[24-25])的第30分钟,并在150 min结束观察。行为观察集中在以下参数:(1)滞留时间,指雌虫从块茎着陆到离开块茎的总持续时间;(2)降落次数,指在观察过程中雌虫在块茎上着陆的次数;(3)试探产卵次数,指雌虫在产卵前将产卵器挤出以感测块茎表面;(4)卵量,包括块茎上卵的数量、观察区域中块茎外卵的数量和总卵量。解剖每只雌虫以确定在测试后卵巢中是否存在精子。
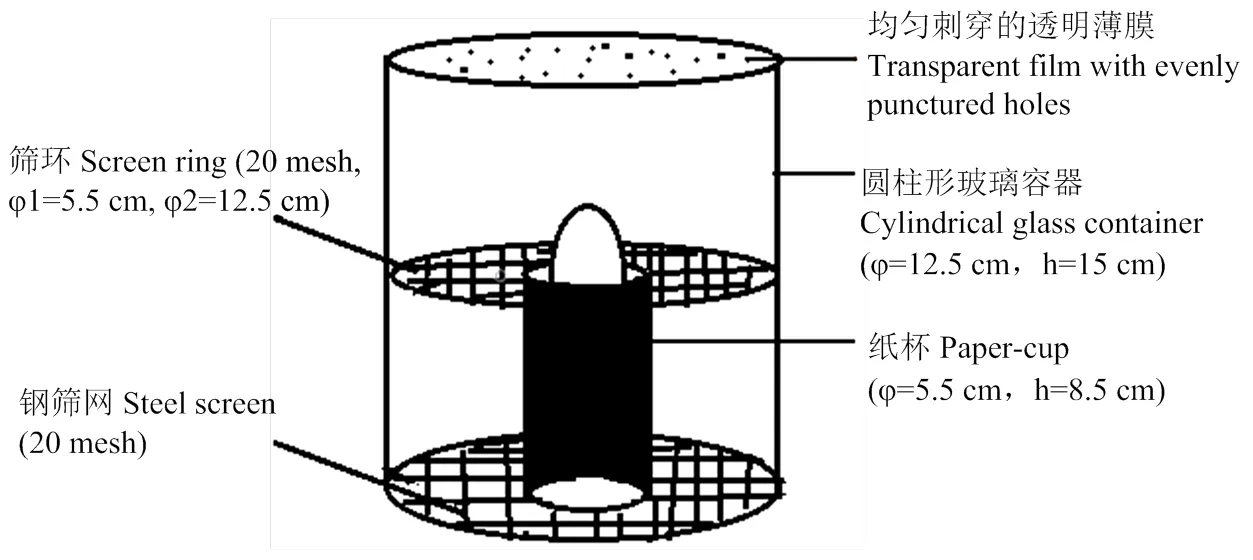
图1 马铃薯块茎蛾产卵观察示意图
使用上述方法,以不同处理(30、6 mg·L-1的桉树油醇;30、0.5 mg·L-1的庚醛;纱布、浸泡马铃薯汁的纱布;0.5 mg·L-1庚醛结合纱布)及对照的马铃薯块茎在环境条件(同饲养条件)下各测试20只雌虫。
1.3 数据分析
单一的物理或化学刺激的数据分析采用SPSS17.0独立样本T检验,<0.05为差异显著,<0.01为差异极显著;物理刺激组合化学刺激的数据分析在显著水平为0.05下采用SPSS17.0单因素方差分析(AVONA)及Tukey多重比较分析。
2 结果
2.1 庚醛对已交配雌蛾产卵行为的影响
对照组马铃薯块茎蛾已交配雌虫在马铃薯块茎上的滞留时间为1 432.2 s,处理组马铃薯块茎蛾已交配雌虫在庚醛(0.5 mg·L-1)处理的块茎上的滞留时间显著增至2 008.0 s(=2.597,=38,=0.013)。庚醛(0.5 mg·L-1)处理组与对照组之间,雌虫在降落次数、试探产卵次数上均无显著差异(=1.649,=38,=1.107;=1.149,=29.075,=0.260)。处理组块茎上和块茎外的卵量与对照组的对应卵量之间均无显著差异(=2.009,=38,=0.052;=1.892,=26.297,=0.070),但处理组的总卵量显著多于对照组总卵量(=2.626,=38,=0.012)(表1)。
对照组马铃薯块茎蛾已交配雌虫在马铃薯块茎上的滞留时间1 318.7 s,处理组马铃薯块茎蛾已交配雌虫在庚醛(30 mg·L-1)处理的块茎上的滞留时间极显著降至317.3 s(=5.651,=25.501,<0.001)。马铃薯块茎蛾已交配雌虫在庚醛(30 mg·L-1)处理的块茎上降落次数和试探产卵次数均极显著性低于对照组(=4.043,=25.668,<0.001;=3.790,=23.730,=0.001)。相对于对照组的平均总卵量18.9粒,处理组的平均总卵量显著增至26.6粒(=2.628,=38,=0.012);处理组和对照组在卵量分布上显示出相反的趋势:对照组的卵量90%以上(18.4粒/18.9粒)产在块茎上,而处理组块茎上的卵量显著降至19.1%(5.1粒/26.6粒)(=6.501,=38,<0.001);处理组的块茎外卵量极显著多于对照组块茎外的卵量(=11.607,=19.592,<0.001)(表2)。
表中数据为平均值±标准误,*:<0.05;**:<0.01(独立样本T检验,=20)。下同
The data in table are expressed as mean±standard error (SE). *:<0.05; **:<0.01 (Independent-Sample T test,=20). The same as below
2.2 桉叶油醇对已交配雌蛾产卵行为的影响
桉叶油醇(6 mg·L-1)处理组与对照组之间,马铃薯块茎蛾已交配雌虫在块茎上的滞留时间(1 469.5、1385.7 s)无显著差异(=0.360,=38,=0.721);降落次数和试探产卵次数也无显著差异(=0.241,=38,=0.811;=0.290,=38,=0.773);处理组块茎上的卵量和总卵量显著或极显著高于对照组的对应卵量(=2.166,=38,=0.037;=2.757,=38,=0.009),而块茎外的卵量之间无显著差异(=2.034,=22.322,=0.054)(表3)。

表3 低浓度桉叶油醇(6 mg·L-1)对已交配雌蛾产卵行为的影响
马铃薯块茎蛾已交配雌虫在桉叶油醇(30 mg·L-1)处理组块茎上的滞留时间(718.2 s)、降落次数(16.1)、试探产卵次数(56.3)均极显著低于对照组(=2.961,=38,=0.005;=2.796,=38,=0.008;=3.214,=30.076,=0.003)。相对于对照组的平均总卵量17.8粒,处理组的平均总卵量增至21.8粒,但两者无显著差异(=1.581,=38,=0.122);在卵量分布上,处理组和对照组显示出相反的分布趋势:对照组的卵量90%以上(17.2粒/17.8粒)产在块茎上,而在处理组块茎上的卵量显著降至44%(9.6粒/21.8粒)(=2.495,=34.545,=0.018);处理组块茎外的卵量极显著多于对照组块茎外的卵量(=2.495,=19.780,<0.001)(表4)。

表4 高浓度桉叶油醇(30 mg·L-1)对已交配雌蛾产卵行为的影响
2.3 不同物理因素与化学因素组合对已交配雌蛾产卵行为的影响
相对于对照组马铃薯块茎蛾已交配雌虫在马铃薯块茎上的滞留时间1 358.8 s,处理组雌虫在纱布包裹的马铃薯块茎上的滞留时间增至1 505.0 s,但两者之间无显著差异(=0.640,=38,=0.526);处理组降落次数和试探产卵次数这两个参数值均极显著低于对照组(=3.421,=24.707,=0.002;=2.994,=27.738,=0.006);处理组块茎上的卵量、块茎外的卵量和总卵量显著或极显著多于对照组的对应卵量(=4.122,=38,<0.001;=2.599,=19.292,=0.017;=5.139,=38,<0.001)(表5)。
相对于对照组马铃薯块茎蛾已交配雌虫在马铃薯块茎上的滞留时间1 365.0 s,处理组马铃薯块茎蛾已交配雌虫在纱布(浸泡马铃薯汁)包裹的马铃薯块茎上的滞留时间增至1 592.7 s,但两者之间无显著差异(=0.916,=38,=0.365);处理组降落次数和试探产卵次数这两个参数值均极显著低于对照组(=5.175,=24.195,<0.001;=3.033,=24.544,=0.006);处理组块茎上的卵量和总卵量均极显著多于对照组的对应卵量(=5.911,=38,<0.001;=7.223,=38,<0.001),而处理组块茎外的卵量与对照组的块茎外的卵量之间无显著差异(=0.858,=38,=0.396)(表6)。

表5 纱布对已交配雌蛾产卵行为的影响

表6 浸泡块茎汁液的纱布对已交配雌蛾产卵行为的影响
物理刺激结合化学刺激(0.5 mg·L-1庚醛结合纱布)对马铃薯块茎蛾已交配雌虫产卵行为的影响是由物理刺激与化学刺激共同作用的结果,雌虫在0.5 mg·L-1庚醛结合纱布处理块茎上的滞留时间与单独0.5 mg·L-1庚醛或纱布处理均无显著差异(=5.020,=3,76,>0.05),但数值上与单独0.5 mg·L-1庚醛处理更为接近;在降落次数和试探产卵次数这两个参数上,0.5 mg·L-1庚醛结合纱布处理与单独纱布处理之间均无显著差异(=35.783,=3,76,=0.736;=25.597,= 3,76,=0.988),但均显著少于0.5 mg·L-1庚醛单独处理(<0.001);在块茎上卵量和总卵量这两个参数上,0.5 mg·L-1庚醛结合纱布处理与单独纱布处理之间均无显著差异(=11.709,=3,76,>0.05;=13.323,=3,76,>0.05),但显著多于0.5 mg·L-1庚醛处理的马铃薯块茎上卵量和总卵量(<0.05)。
3 讨论
植食性昆虫可以从寄主植物中获得生长所需的营养物质,并在寄主植物上产卵以繁衍后代。因此,植食性昆虫能够适时寻找合适的取食、产卵寄主在其生命历程中尤为重要[1]。植食性昆虫产卵位置的选择首先必须有利于后代个体的存活和生长发育,因此雌成虫一般将卵直接产于寄主植物或近距离周边,以便初孵幼虫取食[2]。植食性昆虫寻找和定位产卵位置主要由化学因素(植物次生代谢挥发物)和物理因素(产卵基质、颜色等)决定,化学因素在植食性昆虫产卵定位中发挥作用,而物理和化学因素则在产卵位置识别和选择中起作用[14,26-30]。因此,可利用产卵位置所存在的物理和化学因素来调控植食性昆虫产卵行为,以减轻其危害。

表7 浸泡庚醛(0.5 mg·L-1)的纱布对已交配雌蛾产卵行为的影响
表中数据为平均值±标准误,同列数据后标有不同小写字母表示处理间差异显著(<0.05,单因素方差分析,=20)
Data in the table are expressed as mean±SE. Different lowercases after the data in the same column indicate significant differences among treatments (<0.05, ANOVA,=20)
马铃薯块茎蛾雌虫在产卵过程中同样受到产卵位置所包含的物理和化学因素的影响[17,21,31-32],且产卵位置物理或化学因素的改变能够引起雌虫的产卵行为[8,15-16,20,22-23]。本研究通过滞留时间、降落次数、试探产卵次数和落卵量的分布这4个参数来揭示产卵位置的物理或化学因素对产卵行为的影响,其中纱布包裹块茎处理显著增加了卵量,这与Fenemone[21]马铃薯块茎蛾偏好产卵于粗糙的介质上的研究结果一致。马铃薯块茎蛾已交配雌虫在纱布包裹的块茎上的滞留时间基本保持不变,但降落次数和试探产卵次数显著降低,说明雌蛾在单次降落时在纱布上的滞留时间更长,纱布上适合产卵的位置更多;雌蛾总卵量的增加表明在1日内产卵量不变的情况下,纱布可能会刺激雌蛾更加密集的产卵,而浸泡块茎汁液的纱布起到同样效果。此现象可能是由于试验本身有块茎气味存在(被包裹的块茎),而马铃薯汁的加入会增强块茎气味但不足以使产卵行为特征改变。
本研究中,雌蛾对6 mg·L-1桉叶油醇处理块茎的产卵行为特征结果显示,滞留时间、降落次数和试探产卵次数基本不变,而块茎上的卵量和总卵量均显著增加,此结果与康敏等[8]研究结果一致。滞留时间、降落次数和试探产卵次数不变表明低浓度桉叶油醇不会影响雌蛾靠近马铃薯块茎,块茎上的卵量和总卵量均显著增加而块茎外的卵量不变表明低浓度桉叶油醇可能在雌蛾接触块茎时刺激其在更加密集的时间产卵。而在30 mg·L-1桉叶油醇高浓度下,雌蛾滞留时间、降落次数、试探产卵次数均显著减少,总卵量不变而块茎上的卵量显著减少,此结果与康敏等[8]桉叶油醇对马铃薯块茎蛾表现出产卵引诱或促进效果的结果相反。滞留时间、降落次数、试探产卵次数均显著减少表明高浓度桉叶油醇会驱赶已交配雌蛾靠近马铃薯块茎,总卵量不变而块茎上的卵量显著减少则是高浓度桉叶油醇会驱赶已交配雌蛾靠近马铃薯块茎的结果。两种浓度(6和30 mg·L-1)对雌蛾产卵行为的影响与刘燕等桉叶油醇在6—12 mg·L-1浓度范围内对马铃薯块茎蛾表现为产卵引诱作用,在18—30 mg·L-1浓度范围内则表现为产卵驱避作用的结果一致[20]。
雌蛾在30 mg·L-1高浓度庚醛处理块茎上滞留时间、降落次数、试探产卵次数均显著减少,总卵量显著增加而块茎上的卵量显著减少,此结果与刘燕等[20]庚醛在6—30 mg·L-1浓度范围内对马铃薯块茎蛾表现为产卵驱避效果的研究结果相符。滞留时间、降落次数、试探产卵次数均显著减少表明高浓度庚醛会驱赶雌蛾靠近马铃薯块茎,导致块茎上的卵量显著减少,总卵量显著增加则表明高浓度庚醛会刺激雌蛾密集产卵。雌蛾在0.5 mg·L-1低浓度庚醛处理块茎上滞留时间显著增加,降落次数和试探产卵次数基本不变,总卵量显著增加。降落次数不变而滞留时间增加表明雌蛾单次滞留时间增长,有更多的时间进行试探产卵或产卵;总卵量的增加表明低浓度庚醛会刺激雌蛾密集产卵。高浓度、低浓度的庚醛和桉叶油醇的测试结果均符合某些化学物质在低浓度下为引诱物,在高浓度下为驱避物的规律[33]。
马铃薯块茎蛾防治中所用到的“push-pull”效应可以有效的改变产卵选择行为,其“push-pull”效果可达到56.3%[23],但所产生的“push-pull”效果均只是化学因素(植物次生代谢物)所引起的,而未见物理刺激在其中起到的作用。本研究选择0.5 mg·L-1庚醛和纱布引诱组合,观察并对比其与单一刺激对马铃薯块茎蛾产卵行为的影响(表7),结果显示这种组合具有两种单一刺激的共同作用;化学因素能吸引雌虫,物理因素则刺激其产更多粒卵,该结果为马铃薯块茎蛾的产卵行为调控提供了可行方向。
4 结论
庚醛能够刺激马铃薯块茎蛾已交配雌蛾在更加密集的时间产卵;在浓度为30 mg·L-1时,庚醛对已交配雌蛾具有驱赶作用;在浓度为0.5 mg·L-1时,庚醛对已交配雌蛾具有吸引作用。桉叶油醇溶液(30 mg·L-1)对马铃薯块茎蛾产卵仅有驱赶作用。纱布包裹、纱布浸透块茎汁液、桉叶油醇溶液(6 mg·L-1)仅有刺激已交配雌蛾在更加密集的时间产卵的作用。化学刺激(0.5 mg·L-1庚醛)结合物理刺激(纱布)是纱布刺激产卵作用和0.5 mg·L-1庚醛吸引作用的叠加作用。
[1] 陆宴辉, 张永军, 吴孔明. 植食性昆虫的寄主选择机理及行为调控策略. 生态学报, 2008, 28(10): 5113-5122. DOI: 10.3321/j.issn:1000- 0933.2008.10.059.
Lu Y H, Zhang Y J, Wu K M. Host-plant selection mechanisms and behavioural manipulation strategies of phytophagous insects. Acta Ecologica Sinica, 2008, 28(10): 5113-5122. DOI: 10.3321/j.issn:1000- 0933.2008.10.059. (in Chinese)
[2] 唐宇翀, 周成理, 陈晓鸣. 植食性昆虫产卵行为生态学研究进展. 林业科学研究, 2010, 23(5): 770-777. DOI:10.13275/j.cnki.lykxyj. 2010.05.003.
Tang Y C, Zhou C L, Chen X M. Progress in the oviposition behavior ecology of herbivorous insect.Forest Research, 2010, 23(5): 770-777. DOI:10.13275/j.cnki.lykxyj.2010.05.003. (in Chinese)
[3] 周海波, 陈巨莲, 程登发, 孙京瑞, 刘勇, 陈林. 植物挥发性次生物质在害虫生态调控中的机理及应用//植物保护科技创新与发展——中国植物保护学会2008年学术年会论文集, 2008: 168-175.
Zhou H B, Chen J L, Cheng D F, Sun J R, Liu Y, Chen L. The mechanism and application of plant diversity secondary biomass in pest ecological expansion//Scientific and Technological Innovation and Development of Plant ProtectionProceedings of the 2008 Annual Conference of the Chinese Plant Protection Society, 2008: 168-175. (in Chinese)
[4] Cooper S G, Douches D S, Zarka K, Grafius E J. Enhanced resistance to control potato tuberworm by combining engineered resistance, avidin, and natural resistance derived from,. American journal of potato research, 2009, 86(1): 24-30. DOI: 10.1007/s12230-008-9057-8.
[5] Rondon S I. The potato tuberworm: a literature review of its biology, ecology, and control.American Journal of Potato Research, 2010, 87(2): 149-166.DOI: 10.1007/s12230-009-9123-x.
[6] 张慧英, 杨雪梅. 棉花叶片茸毛分布及其与棉铃虫产卵的关系. 植物保护学报, 1994, 21(4): 296, 304. DOI: 10.13802/j.cnki.zwbhxb. 1994.04.002.
Zhang H Y, Yang X M. Observations on the distribution of cotton leaf pubescence as related to the oviposition of cotton bollworm. Journal of plant protection, 1994, 21(4): 296, 304. DOI: 10.13802 /j.cnki.zwbhxb.1994.04.002. (in Chinese)
[7] Danthanarayana W. The bionomics, distribution and host range of the light brown apple moth,(Walk.) (Tortricidae). Australian journal of zoology, 1975, 23(3): 419-437. DOI: 10.1071/ZO9750419.
[8] 康敏, 谭仲夏, 任静涛,苏鹏娟, 肖春.印楝素与桉叶油醇对马铃薯块茎蛾产卵选择性的影响. 安徽农学通报, 2007, 13(3): 134-135. DOI: 10.3969/j.issn.1007-7731.2007.03.067.
Kang M, Tan Z X, Ren J T, Su P J, Xiao C. Effects of azadirachtin and cineole on oviposition by(Lepidoptera: Gelechiidae) females. Anhui Agricultural Science Bulletin, 2007, 13(3): 134-135. DOI: 10.3969/j.issn.1007-7731.2007.03.067. (in Chinese)
[9] Traynier R M M. Field and laboratory experiments on the site of oviposition by the potato moth(Zell.) (Lepidoptera, Gelechiidae). Bulletin of Entomological Research, 1975, 65(3): 391-398. DOI: 10.1017/S0007485300006064.
[10] Shelton A M, Badenes-Perez F R. Concepts and applications of trap cropping in pest management. Annual Review of Entomology, 2006, 51: 285-308. DOI: 10.1146/annurev.ento.51.110104.150959.
[11] 樊慧, 金幼菊, 李继泉, 陈华君. 引诱植食性昆虫的植物挥发性信息化合物的研究进展. 北京林业大学学报, 2004, 26(3): 76-81. DOI: 10.13332/j.1000-1522.2004.03.018.
Fan H, Jin Y J, Li J Q, Chen H J. Advances on plant volatiles semiochemicals attracting herbivorous insects. Journal of Beijing Forestry University, 2004, 26(3): 76-81. DOI: 10.13332/j.1000-1522. 2004.03.018. (in Chinese)
[12] 黎卓维, 曾鑫年, 黎卓莹, 罗建斌. 寄主植物气味对昆虫取食和产卵行为的影响//科技创新与绿色植保——中国植物保护学会2006学术年会论文集, 2006: 246-249.
Li Z W, Zeng X N, Li Z Y, Luo J B. Effects of host-plant odor on insect feeding and oviposition behavior//Science and technology innovation and green plant protection. China Society of Plant Protection. Proceedings of the 2006 Annual Conference of the Chinese Plant Protection Society, 2006: 246-249. (in Chinese)
[13] 薛伟伟. 黄花烟草对烟夜蛾和棉铃虫产卵行为的调控机理研究[D]. 郑州: 河南农业大学, 2005.
Xue W W. Studies on the regulation mechanism of rustic tobacco to oviposition ofGuenee andHubner[D]. Zhengzhou: Henan Agricultural University, 2005. (in Chinese)
[14] Fenemore P G. Host-plant location and selection by adult potato moth,(Lepidoptera: Gelechiidae): a review. Journal of Insect Physiology, 1988, 34(3): 175-177. DOI: 10.1016/ 0022-1910(88)90047-9.
[15] 马艳粉, 张晓梅, 李正跃, 肖春. 滇杨叶片提取物对马铃薯块茎蛾产卵选择性的影响. 农药, 2011, 50(7): 522-523. DOI: 10.16820/j. cnki.1006-0413.2011.07.021.
Ma Y F, Zhang X M, Li Z Y, Xiao C. Effect of extracts from poplar () leaves on oviposition for potato tuber moth,(Zeller). Agrochemicals, 2011, 50(7): 522-523. DOI: 10.16820/j.cnki.1006-0413.2011.07.021. (in Chinese)
[16] 马艳粉, 胥勇, 肖春. 10种寄主植物挥发物对马铃薯块茎蛾产卵的引诱作用. 中国生物防治学报, 2012, 28(3): 448-452. DOI: 10.3969/j.issn.2095-039X.2012.03.024.
Ma Y F, Xu Y, Xiao C. Oviposition attraction effect of ten host-plant volatiles on potato tuber moth,. Chinese Journal of Biological Control, 2012, 28(3): 448-452. DOI: 10.3969/j.issn.2095-039X.2012.03.024. (in Chinese)
[17] Fenemore P G. Oviposition of potato tuber moth,Zell. (Lepidoptera: Gelechiidae); identification of host-plant factors influencing oviposition response. New Zealand Journal of Zoology, 1980, 7(3): 435-439. DOI: 10.1080/03014223.19 80.10423798.
[18] Sun H Y, talekar N S, LI Z Y. Characterization of oviposition of potato tuber moth(Lepidopterra: Gelechiidae) in potato. Journal of Yunnan Agricultural University, 2009, 24(3): 354-360. DOI: 10.16211/j.issn.1004-390x(n).2009.03. 003.
[19] Cameron P J, Walker G P, Penny G M, Wigley P J. Movement of potato tuberworm (Lepidoptera: Gelechiidae) within and between crops, and some comparisons with diamondback moth (Lepidoptera: Plutellidae). Environmental entomology, 2002, 31(1): 65-75. DOI: 10.1603/0046-225X-31.1.65.
[20] 刘燕, 谢冬生, 熊焰, 王春娅, 任智强, 肖春. 庚醛与桉叶油醇组合对马铃薯块茎蛾产卵选择的影响. 植物保护, 2016, 42(3): 99-103. DOI: 10.3969/j.issn.0529-1542.2016.03.016.
Liu Y, Xie D S, Xiong Y, Wang C Y, Ren Z Q, Xiao C. Effects of combination of cineole with heptanal on oviposition choice of the potato tuber moth,. Plant protection, 2016, 42(3): 99-103. DOI: 10.3969/j.issn.0529-1542.2016. 03.016.(in Chinese)
[21] Fenemore P G. Oviposition of potato tuber moth,Zell. (Lepidoptera: Gelechildae); the physical nature of the oviposition substrate.New Zealand journal of zoology, 1978, 5(3): 591-599. DOI: 10.1080/03014223.1978.10430129.
[22] 康敏, 任静涛, 苏鹏娟, 胡纯华, 肖春. 3种植物提取物对马铃薯块茎蛾产卵的抑制作用. 安徽农业科学, 2007, 35(10): 2858-2859.
Kang M, Ren J T, Su P J, Hu C H, Xiao C. Oviposition deterring effect of crude extracts from three plants on. Journal of Anhui Agricultural Sciences, 2007, 35(10): 2858-2859. (in Chinese)
[23] Ma Y F, Xiao C. Push-pull effects of three plant secondary metabolites on oviposition of the potato tuber moth,. Journal of Insect Science, 2013, 13(1): 128. DOI: 10.1673/031.013.12801.
[24] LI H T, Yan S, Li Z, Zhang Q W, Liu X X. Dim light during scotophase enhances sexual behavior of the oriental tobacco budworm(Lepidoptera: Noctuidae). Florida Entomologist, 2015, 98(2): 690-696. DOI: 10.1653/024.098.0244.
[25] 闫硕, 李慧婷, 朱威龙, 朱家林, 张青文, 刘小侠. 光强度对棉铃虫交配行为的影响. 昆虫学报, 2014, 57(9): 1045-1050. DOI: 10.16380/j.kcxb.2014.09.012.
Yan S, Li H T, Zhu W L, Zhu J L, Zhang Q W, Liu X X. Effects of light intensity on the sexual bebavior of the cotton bollworm,(Lepidoptera: Noctudae).Acta Entomologica Sinica, 2014, 57(9): 1045-1050. DOI: 10.16380/j.kcxb.2014.09.012. (in Chinese)
[26] 徐正浩, 崔绍荣, 何勇, 李迪, 赵明, 张旭, 余柳青. 植物次生代谢物质和害虫防治. 植物保护, 2004, 30(4): 8-11. DOI: 10.3969/j.issn. 0529-1542.2004.04.002.
Xu Z H, Cui S R, He Y, Li D, Zhao M, Zhang X, YU L Q. Plant secondary metabolites and pest control. Plant Protection, 2004, 30(4): 8-11. DOI: 10.3969/j.issn.0529-1542.2004.04.002. (in Chinese)
[27] 任荔荔, 祁力言, 蒋巧根, 周曙东, 戴华国. 植物果实、颜色和形状对橘小实蝇产卵选择的影响. 昆虫知识, 2008, 45(4): 593-597. DOI: 10.3969/j.issn.0452-8255.2008.04.020.
Ren L L, Qi L Y, Jiang Q G, Zhou S D, Dai H G. Oviposition preference of oriental fruit fly,. Chinese Bulletin of Entomology, 2008, 45(4): 593-597. DOI: 10.3969/j.issn. 0452-8255. 2008.04.020. (in Chinese)
[28] Foster S P, Howard A J. Influence of stimuli fromon ovipositional behavior of generalist herbivore. Journal of chemical ecology, 1998, 24(7): 1251-1275. DOI: 10.1023/A:1022455120922.
[29] Markheiser A, Rid M, Biancu S, Gross J, Hoffmann C. Physical factors influencing the oviposition behaviour of European grapevine mothsand. Journal of Applied Entomology, 2017, 142(1/2): 201-210. DOI: 10.1111/jen. 12423.
[30] Renwick J A A. Chemical ecology of oviposition in phytophagous insects.Experientia, 1989, 45(3): 223-228. DOI: 10.1007/BF01951807.
[31] Meisner J, Ascher K R S, Lavie D. Factors influencing the attraction to oviposition of the potato tuber moth,Zell. Journal of Applied Entomology, 1974, 77(1/4): 179-189. DOI: 10.1111/j.1439-0418.1974.tb03245.x.
[32] 康敏, 马艳粉, 李正跃, 余菊芬, 肖春. 马铃薯块茎蛾对马铃薯块茎挥发物的嗅觉反应. 安徽农业科学, 2009, 37(30): 14740-14742.
Kang M, Ma Y F, Li Z Y, Yu J F, Xiao C. Olfactory responses ofto volatiles from potato tuber. Journal of Anhui Agricultural Sciences, 2009, 37(30): 14740-14742. (in Chinese)
[33] Das G P. Plants used in controlling the potato tuber moth,(Zeller). Crop protection, 1995, 14(8): 631-636. DOI: 10.1016/0261-2194(95)00046-1.
Influences of chemical and physical stimuli on oviposition Behavior of
Xiong Yan1, Han Rui1, Hu Chunhua2, Wang Jing1, Xiao Chun1
1College of Plant Protection, Yunnan Agricultural University, Kunming 650201;2College of Continuing Education and Vocational Education, Yunnan Agricultural University, Kunming 650201
【】The objective of this study is to determine the effect of combination of chemical and physical factors on oviposition behavior of potatoworm (), and to provide a basis for the development of behavior regulation technology of.【】Tubers were treated with different methods: (1) soaked in heptanal, cineole solution and then dried, (2) wrapped with cotton gauze, or with cotton gauze loading tuber juice, respectively, then oviposition behavior parameters (including landing times, arresting time, ovipositor-probing times, amount of eggs) of mated females on the tubers were observed at the dark-phase (red light intensity: 1.0-1.5 lx) under the environment-controlled conditions of temperature (27±2)℃, relative humidity 50%-70%, and photoperiod 14L﹕10D.【】Females would arrest for longer time (arresting time), and more eggs would be deposited on the surface of the tubers when heptanal solution (0.5 mg·L-1) was applied onto the surface of tubers, but the times of ovipositor-probing and landing did not increase significantly. Significant reduction in arresting time, landing times and ovipositor-probing times, and more egg-deposition, were observed when heptanal solution at the concentration of 30 mg·L-1was applied to the tuber surface. More eggs were laid on the surfaces of tubers, and no significant change in oviposition behavior (arresting time, landing times and ovipositor-probing times) occurred when cineole solution (6 mg·L-1) was applied. Application of cineole solution at the higher concentration (30 mg·L-1) would result in significant reduction in arresting time, landing times and ovipositor-probing times, and in more egg deposition outside the tuber. When tubers were wrapped with cotton gauze, more eggs were deposited on the tubers, the times of landing and ovipositor-probing decreased significantly, but no significant difference in arresting time appeared. Similar oviposition behaviors were observed when tubers were wrapped with cotton gauze loading tuber juice. Compared with the blank control, the treatment (tubers + cotton gauze loading heptanal (0.5 mg·L-1)) led to more eggs deposition and longer arresting time, and to significant reduction in times of ovipositor-probing and landing. Compared with the single use of heptanal (0.5 mg·L-1), it could significantly reduce ovipositor-probing times and landing times, and at the same time, it could significantly increase the amount of eggs on the tuber and the total amount of eggs. Compared with the single use of cotton gauze, there was no significant difference in each index.【】Heptanal can stimulate mated femaleto oviposit in more intensive time. at the concentration of 30 mg·L-1, heptanal will repel the females from the treated potato tuber; at the concentration of 0.5 mg·L-1, heptanal will show an attractive effect on mated female moths. Cineole (30 mg·L-1) only has repellent effect on moths, while wrapped with cotton gauze, cotton gauze soaked in tuber juice, cineole solution (6 mg·L-1) only show stimulating effect on oviposition of females. These results indicate a co-attractive of combination of the chemical stimulus (0.5 mg·L-1heptanal) and the physical stimulus (cotton gauze).
potato tuber moth (); physical factor; chemical factor; oviposition behavior

10.3864/j.issn.0578-1752.2021.03.011
2020-05-04;
2020-05-28
国家自然科学基金(31560607)
熊焰,E-mail:xyan891@163.com。韩瑞,E-mail:hanrui_0228@163.com。熊焰和韩瑞为同等贡献作者。通信作者肖春,E-mail:x.chun@163.com
(责任编辑 岳梅)

