解脲脲原体感染对不育男性精液质量的影响
王昭蓉, 张占虎, 王秋红, 李海波, 丛 辉
(1.南通大学附属妇幼保健院检验科,江苏 南通 226001;2.南通大学附属医院医学检验科,江苏 南通 226001)
有研究结果显示,不育男性占育龄男性的8%左右,在不孕不育夫妇中男性因素占50%[1],其中10%~40%的男性不育与生殖道感染相关[2]。解脲脲原体(Ureaplasma urealyticum,UU)可能是引起男性不育的重要原因之一[3]。UU感染后在泌尿生殖道黏膜及上皮细胞上定居,可导致精子总数、精子活力及精子正常形态率降低[4],但其致不育的具体机制目前尚不清楚。近年来,氧化应激对男性生殖系统的影响备受关注,活性氧(reactive oxygen species,ROS)在精子发生、精子活力、精子获能、顶体反应等活动中起重要调节作用[5]。过量ROS及其代谢物可造成精子膜脂质氧化损伤,破坏精子核内DNA完整性,改变线粒体结构,进而影响功能。线粒体结构完整性、功能状态直接关系到精子活力,而线粒体膜电位(mitochondrial membrane potential,MMP)是反映线粒体功能的客观指标,可用于评估线粒体功能。本研究拟分析UU对不育男性精子常规参数、MMP、ROS的影响,探讨UU感染与精液质量的关系。
1 材料和方法
1.1 研究对象
选取2018年1—11月南通大学附属妇幼保健院男性不育患者112例(不育组)。入选标准:年龄25~40岁,采集标本前1个月未使用抗菌药物治疗,无免疫性疾病,通过细菌培养、聚合酶链反应等检验方法排除淋病奈瑟球菌、沙眼衣原体、人型支原体、生殖支原体等常见病原体感染,无外伤、遗传病及家族史,无明显睾丸、附睾、输精管等生殖系统器官(包含隐睾、精索静脉曲张、睾丸扭转等)异常。不育患者近1年夫妻生活正常,未采取避孕措施而女方未孕,女方体检均正常,排除妇科疾病、先天遗传因素、生殖器官畸形或病变、内分泌因素、免疫因素等引起的不孕。对照组为临床明确诊断是女方因素引起不孕并在南通大学附属妇幼保健院实施体外受精联合胚胎移植术(in vitrofertilization,IVF)的26名男性。本研究经南通大学附属妇幼保健院伦理委员会批准(批号:Y2017081),患者本人签署知情同意书。
1.2 方法
1.2.1 标本采集 患者禁欲2~7 d,洗手消毒后通过手淫方式取精,每例患者提取2份标本,1份用于精液常规检验,取出标本后先观察外观,记录接收时间,并静置于37 ℃水浴箱30 min,待完全液化后开始检测;另1份用于UU检测。
1.2.2 仪器和试剂 WLJY-9000型伟力彩色精子质量检测系统(computer assisted semen analysis,CASA,北京伟力新世纪科技发展有限公司)、BriCyte E6流式细胞仪(深圳迈瑞公司)、MagX自动核酸提取仪(上海仁度生物科技有限公司)、Bio-Rad CFX96实时荧光核酸扩增检测仪(美国伯乐公司)、解脲脲原体核酸检测试剂盒(上海仁度生物科技有限公司)、Diff-Quik精子形态学快速染液(珠海贝索生物技术有限公司)、JC-1荧光染料和DCFH-DA荧光探针(上海碧云天生物有限公司)。
1.2.3 精液常规分析 待精液完全液化后,测定精液体积;取10 μL样本滴加至37 ℃预温的Makler板中,使用CASA对精液进行常规分析;0.9%氯化钠溶液洗涤后,离心取沉淀精子滴至载玻片上,自然干燥后进行Diff-Quik染色,显微镜下每张玻片至少计数200个精子,计算精子正常形态率。所有操作均按《世界卫生组织人类精液检查与处理实验室手册》第5版[6]进行。每日室内质控均在控,仪器状态均正常。
1.2.4 精液UU检测 使用MagX自动核酸提取仪提取UU RNA并扩增,扩增条件:42 ℃、1 min,40个循环。结果判定:dt≤35为阳性;dt无数值或≥40为阴性;dt结果为36~39需重复测定,如仍在36~39之间,且扩增曲线呈典型的S型,则判断为阳性,若非典型S型曲线,则判为阴性;dt表示样本S型曲线与阈值线交点横坐标读数(循环数)。
1.2.5 MMP检测 参照试剂盒说明书,用磷酸盐缓冲液(phosphate buffer saline,PBS)调整精子浓度至1×105/mL,加入JC-1染色缓冲液充分混匀,37 ℃避光孵育20 min,600×g、4 ℃离心2次,再用适量JC-1染色缓冲液重悬沉淀。检测JC-1聚合物时,激发波长为525 nm,发射波长为590 nm;检测JC-1单体时,激发波长为490 nm,发射波长为530 nm。流式细胞仪选用前向散射光和侧向散射光设门后,通过荧光通道FL1-H和FL2-H收集荧光信号。用P2/P3百分比表示膜电位高低。
1.2.6 ROS检测 参照试剂盒说明书,用PBS调整精子浓度至1×105/mL,加入DCFH-DA荧光探针,充分混匀后37 ℃避光孵育20 min,每3~5 min颠倒混匀1次,600×g、4℃离心3次,洗去游离DCFH-DA,再用适量PBS重悬沉淀。流式细胞仪选用488 nm激发波长,525 nm发射波长,实时或逐时间点检测刺激前后荧光强弱,以相对荧光强度反映细胞内ROS含量。
1.3 统计学方法
采用SPSS 21.0软件进行统计分析。计数资料以例或率表示,组间比较采用χ2检验。呈非正态分布数据以中位数(M)[四分位数(P25~P75)]表示,组间比较采用秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 男性UU感染率分析
不育组中,UU感染(UU阳性组)52例,UU未感染(UU阴性组)60例,不育组UU感染率为46.4%;对照组中UU感染5例,UU未感染21例,感染率为19.2%。不育组UU感染率显著高于对照组(P<0.05)。
2.2 UU感染对不育男性精液常规参数的影响
在不育患者中,UU阳性组精子活力、前向运动精子百分比、精子浓度、精子总数和精子正常形态率均显著低于UU阴性组(P<0.01),而精液量2个组之间差异无统计学意义(P>0.05)。见表1。
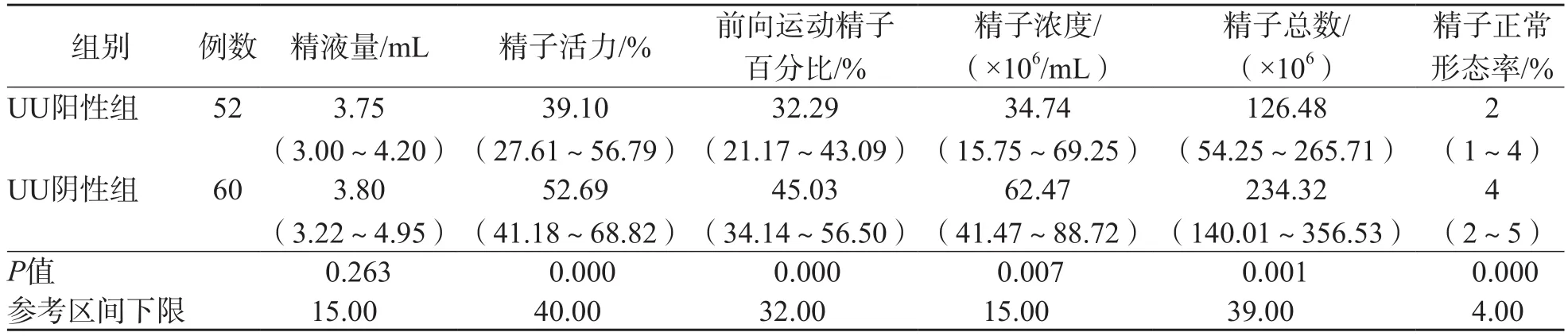
表1 UU感染对不育男性精液常规参数的影响 M(P25~P75)
2.3 UU感染对不育男性精液MMP的影响
UU阳性组MMP P2/P3[(0.45±0.39)%]显著低于阴性组[(0.97±0.73)%](P<0.05)。见图1。
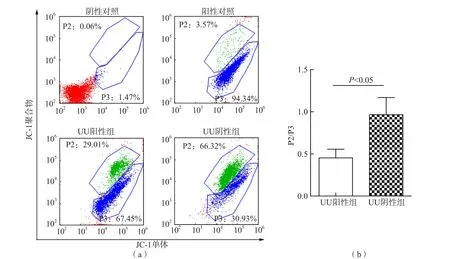
图1 UU阳性组与UU阴性组精子MMP检测结果比较
2.4 UU感染对不育男性精液ROS影响
UU阳性组ROS[(48.26±8.38)%]显著高于UU阴性组[(25.95±7.82)%](P<0.01)。见图2。

图2 UU阳性组与UU阴性组精子ROS检测结果比较
3 讨论
近年来,男性不育呈增长趋势,男性不育患者中生殖道感染发病率较高[7]。生殖道感染可能是导致患者精液量减少、精子总数下降、精子活力降低的重要原因之一。UU是原核生物中最小、最简单的一类无细胞壁微生物,是寄生于男、女生殖道的常见病原体,同时也是非淋性尿道炎的病原体之一。有研究结果表明,UU在男性不育生殖道中的感染率最高[8]。本研究结果显示,不育组UU感染率为46.4%,显著高于对照组(19.2%),其中UU阳性组精子浓度、精子总数、精子活力、前向运动精子百分比、精子正常形态率与UU阴性组比较差异均有统计学意义(P<0.01),与王勇等[9]和WANG等[10]的研究结果一致。UU感染可逆行侵入生精小管,干扰精原细胞分裂,从而减少精子生成,造成精子浓度、精子总数下降。UU能吸附在精子表面,吸附部位出现精子膜缺损乃至严重损坏,使精子由流线型变得“臃肿”,尾部出现卷曲形态改变,有些精子因免疫反应发生凝集,使运动阻力增大,致前向运动精子百分比降低[11]。精子正常形态率是精液常规分析中的重要指标,UU感染后精子畸形率升高,易引起男性不育[12]。有研究结果表明,精液中感染UU并不能真正影响精子质量,只有当某种类型UU感染达到一定浓度或机体免疫力低下时,才会产生不良影响和相应的临床症状[13],这也解释了对照组也有UU感染的原因。
精子活力作为衡量精液质量的重要指标,被视为完成精-卵结合的主要因素之一。三磷酸腺苷为精子运动提供能量,正常精子由三羧酸循环产生能量传递电子,电子经呼吸链传递的同时,将质子从线粒体内膜基质侧泵到内膜侧,形成MMP。JC-1是一种阳离子型亲脂性荧光探针,能自由穿过细胞膜,随细胞膜电位变化而在膜两侧保持动态平衡,其聚集程度随MMP升高而增加。JC-1可与线粒体内膜特异性结合,但在线粒体膜裂解时会被释放出来,因此,用JC-1检测MMP来判断线粒体膜损伤程度,具有结果可靠、敏感性高等优点[14]。本研究结果显示,UU阳性组MMP显著低于UU阴性组(P<0.05),表明UU感染使精子MMP降低。董浙清等[15]的研究结果表明,MMP下降可引起精子尾部线粒体形态及位置异常、结构紊乱、线粒体鞘缺失等。精子MMP水平还反映了精子的能量代谢水平,MMP下降表明精子运动所需能量减少,可导致精子活力下降或精子细胞凋亡、坏死。有研究结果表明,MMP与精子活率、精子活力及精子受精率呈正相关[16]。
ROS在生理状态下一般由精子自身及精液中的白细胞产生,适当的ROS水平有利于维持精子细胞的正常功能。本研究结果显示,UU感染对不育男性精子ROS有显著影响,ROS超过一定水平后,线粒体内膜将出现非特异性转运孔道,MMP下降,因此ROS产生过度是MMP下降的重要原因之一。过量的ROS会导致氧化应激,引起精子膜脂质氧化损伤、精子DNA损伤、精子线粒体损伤及细胞凋亡,从而破坏精子功能,导致精子死亡[17]。有研究结果证实,ROS升高导致精子功能障碍是男性不育症的一个重要原因[18]。
综上所述,UU感染对精子质量存在一定影响,可能机制是干扰线粒体活性等引起男性不育。积极预防和治疗UU感染,对预防不育症发生有重要意义。

