糖尿病性周围神经病理性疼痛中circ-SCN9A 的作用与临床价值*
刘 磊 席 鹏 李文举 雷舒煜 李亦梅
(新疆医科大学第一附属医院疼痛科,乌鲁木齐 830011)
神经病理性疼痛 (neuropathic pain, NP) 是由躯体感觉神经系统的损伤或疾病而直接造成的疼痛,主要分为周围神经病理性疼痛和中枢神经病理性疼痛[1]。糖尿病性周围神经病理性疼痛 (diabetic peripheral neuropathic pain, DPNP) 是指由糖尿病或糖尿病前期病变导致的周围神经病理性疼痛[2]。目前,DPNP 的发生率逐年升高,已成为亟待解决的医学难题之一。本研究致力于进一步明确DPNP 的发病机制并寻找其可靠的诊断标记物。钠电压门控通道α亚单位9 (sodium voltage-gated channel alpha subunit 9, SCN9A) 基因编码的蛋白 (Nav 1.7) 参与组成神经细胞中的痛觉感受器[3,4]。该基因的突变可以导致多种以疼痛为主的疾病[5]。微小RNA (microRNA, miRNA)可通过降低编码基因mRNA 的表达来抑制其蛋白质的翻译。例如,miR-30b 可通过降低SCN9A 基因mRNA 的表达来抑制Nav 1.7 蛋白翻译,从而降低NP 实验大鼠疼痛的严重程度[4]。
在基因的转录成分中,环状 RNA (circular RNA, circRNA)缺乏线性转录本的 “poly (A) 尾”,通过首尾末端的相接形成环化结构[6,7],可结合各种 miRNA,抑制其功能,发挥 miRNA“海绵”的作用[7]。人类神经系统中高丰度的circRNA 可通过多种途径游离于外周循环系统[8,9]。最新研究证实circRNA可通过内源性miRNA“海绵”机制参与疼痛性疾病的发生[10,11]。例如,circRNA_9119 可以通过吸附miR-26a 减轻进行性的热痛觉过敏和机械性痛觉过敏[12]。circAnks1a 对miR-324-3p 的吸附可提高背角神经元的兴奋性和神经损伤引起的疼痛程度[13]。DPNP 病人血清circHIPK3 水平显著高于健康人群,敲减circHIPK3 则可减轻糖尿病大鼠的NP 程度[14]。
由于circRNA 分子呈封闭环状结构,不容易受RNA 外切酶影响,在神经系统表达丰度高且具有一定的时序和疾病特异性,这使得circRNAs 有巨大潜力成为疼痛类疾病的诊断标志物。本研究在前期通过生物信息学分析发现SCN9A 基因区域可以转录生成多个circRNA 分子,创新性地探讨了它们在DPNP 中的作用和临床价值。通过拟合临床样本、生物信息学分析和分子生物学实验等多种技术手段对其在DPNP 发生中的潜在诊断价值和可能作用机制进行了研究,以期推动该病的临床诊断治疗。
方 法
1.样本采集
收集2017 年1 月至2019 年12 月在我科收治的诊断为DPNP 的病人。
纳入标准:自愿参加本研究并同意抽取其外周静脉血样;符合《糖尿病性周围神经病理性疼痛诊疗专家共识》的诊断标准;《ID Pain》评分> 2 分;年龄 ≥18 岁;疼痛数字评分法 (numerical rating scale, NRS)评分≥4 分,4~6 分为中度疼痛,7 分以上为重度疼痛;视觉模拟评分法(visual analogue scale, VAS)评分在6~10 分;意识清醒,可以进行正确的沟通和言语表达;无肿瘤等其他严重躯体性疾病。
排除标准:年龄 < 18 岁;NRS < 4 分;急慢性胰腺炎;神经系统损害性疾病;精神活性物质滥用史;肝肾功能不全者。
共收集DPNP 病人60 例(男女各30 例),其中男性平均年龄为(70.8±5.3)岁,平均病程(6.1±0.6)年;女性平均年龄为(72.3±4.2)岁,平均病程(6.5±0.5)年。收集本院无NP 症状的2 型糖尿病病人60 例,男30 例,平均年龄(66.3±4.5)岁;女30 例,平均年龄(69.0±3.2)岁;收集的健康对照者为本院常规体检确认后的健康人群,男女各30 例,男性平均年龄(67.6±3.4)岁,女性平均年龄(70.0±4.5)岁。本研究所有内容和实施过程均获得了入组者的知情同意和本单位医学伦理委员会的批准和监督。
2.主要试剂与仪器
体液RNA 提取专用试剂TRIzol LS Reagent (Invitrogen, Karlsruhe, Germany);EDTA 真空采血管及针头(积水,日本);circRNA 反向设计引物和线性内参 (GAPDH) 引物(生工,上海);构建circRNA过表达专用试剂盒pHB-circBasic™ circular RNA cloning kit (汉恒,上海);特异性siRNA (锐博,广州);逆转录试剂ReverTra Ace qPCR RT Master Mix (TOYOBO, Japan);双荧光素酶 (Luciferase, LUC)报告系统(Promega, USA);Ribonuclease R (Epicentre, USA);2×Power Taq PCR MasterMix(百泰克,北京);胎牛血清 (Bovogen, Australian);Anti-KCNJ6抗体(义翘神州,北京)、单克隆 Anti-GAPDH 抗体 (Sigma, USA);适用于Real-time PCR 用的PowerUp™SYBR™ Green Master Mix (Applied Biosystems, USA);微量移液器 (Eppendorf, Germany);细胞培养板 (Corning, USA);Real-time PCR 自动化分析仪 (Bio-RAD, USA);全自动酶标仪、细胞培养箱 (Thermo Scientific, USA);超净工作台(智城,上海);数显电热恒温水槽、生化培养箱 (精宏,上海);水平摇床(其林贝尔,江苏);超声波细胞粉碎机 (新芝,浙江)。
3. 血清总RNA 提取与Real-time qPCR 分析
在上午空腹状态下,收集入组者外周血3 ml,然后置于冷冻离心机内以3000 g 的速度离心10 min,收集上清,置于-80℃冰箱保存。按照TRIzol LS Reagent 的说明书对血清内的RNA 进行提取,采用全自动酶标仪对所提RNA 进行浓度和纯度测定。取1 μg RNA 进行cDNA 合成。利用circRNA 序列数据库(http://www.circbase.org/) 获取所有来自SCN9A基因的已知circRNA 分子的转录起始位点和序列信息,设计相应的反向引物。使用Real-time PCR 自动化分析仪对血清样本中的circRNA 进行qRT-PCR表达分析。使用△Ct 方法计算circRNA 的相对表达水平。
4. 环状RNA 鉴定与细胞亚定位分析
用含1%双抗(青霉素、链霉素)和10%胎牛血清的DMEM 培养液培养人神经母细胞瘤细胞系SH-SY5Y,细胞培养箱设为5% CO2、37℃。Ribonuclease R (RNase R) 是一种核糖核酸外切酶,可以从3'-5'方向切割降解RNA,能够消化几乎所有的线性RNA 分子,但不易消化呈环形的RNA。本研究以3 U RNase R/μg RNA 的比例对细胞总RNA 进行Rnase R 消化处理(37℃,10 min),然后以处理过的RNA 作为模板合成cDNA,与常规的cDNA 分别进行线性SCN9A 基因和SCN9A 来源的circRNA 进行表达测定比较。细胞的亚定位往往决定circRNA行使生物学功能的类型,按照核质分离试剂盒说明书标准流程对筛选出的circRNA 进行了细胞亚定位分析。
5.筛选SCN9A 来源circRNA 的互作miRNA
在转染前24 h,以5×103/孔的细胞密度接种于96 孔板中。利用circRNA 生物信息学分析工具(http://www.circbase.org/和https://circinteractome.nia.nih.gov/index.html)预测可能与上述筛选出的circRNA 结合的miRNA,合成它们的类似物。将含有备选circRNA 结合位点片段的报告质粒和这些miRNA 类似物共转染入细胞内。在48 h 后按照说明书操作步骤测定LUC 活性。最后,与阴性对照进行比较,计算每个miRNA 类似物所致LUC 活性的改变倍数。针对上述LUC 实验筛选出的miRNA分子,在细胞中分别转染上述circRNA 的过表达载体和siRNA 化合物,继而检测这些miRNA 表达水平受到circRNA 调控的影响程度。
6. SCN9A 来源circRNA 在DPNP 中的潜在诊断价值和分子作用机制分析
接受者操作特性曲线(receiver operating characteristic curve,ROC 曲线)是评估临床指标敏感性和特异性的常用逻辑回归模型。在本研究中SCN9A来源circRNA 的表达分为健康对照组、无NP 症状的2 型糖尿病病人组和DPNP 病人组,其中DPNP病人组又分为中度疼痛病人亚组与重度疼痛病人亚组。整合KEGG (Kyoto Encyclopedia of Genes and Genomes)、DIANA-mirPath 和TargetScan 等多个数据分析工具对SCN9A 来源circRNA 结合的miRNA生物学作用通路进行挖掘和分析,揭示从circRNA表达到靶向功能基因改变等复杂调控的分子机制。采用分子互作图形化展示工具Cytoscape 3.4.0 构建 DPNP 相关SCN9A 来源circRNA 的最相关调控网络。基于上述基础,利用免疫印迹技术 (Western blotting, WB) 检测SCN9A 来源circRNA 分子对靶向蛋白的调控作用,验证circRNA 影响DPNP 发生的分子生物学机制。
7. 统计学分析
本研究所有数据使用Excel 进行录入和整理,采用统计产品与服务解决方案软件 (Statistical Product and Service Solutions, SPSS) 17.0 版本对数据进行统计分析,P < 0.05 认为差异具有统计学意义。
结 果
1. SCN9A 来源的circRNA 在DPNP 病人血清中存在显著的差异表达
通过生物信息学数据检索,在人体内SCN9A基因共发现14 条circRNA 分子,本研究发现其中hsa_circ_0117953 (circ-SCN9A) 在DPNP 病 人 血 清中的水平显著高于健康对照组(P < 0.001,见图1A),hsa_circ_0117948 则在病人血清中较健康对照组降低(P < 0.05,见图1A)。示意图显示了circ-SCN9A的生物信息学序列分析结果,其是由母基因线性转录本的第二至第七外显子剪切后首尾相接形成。进一步实验显示了circ-SCN9A 具有抵抗RNase R 切割的circRNA 生物学特性,主要分布于细胞结构的细胞质中(见图1C, D)。
2.多个miRNA 受到circ-SCN9A 的吸附
针对circ-SCN9A 的序列结构进行miRNA 结合能力预测,发现了37 个可能结合circ-SCN9A的miRNA 分子。本研究采用LUC 报告分析系统与37 个miRNA 类似物的文库进行实验验证后发现其中6 个miRNA (miR-661、miR-1324、miR-877-3p、miR-1256、miR-153-3p、miR-1264)对LUC 的活性抑制率超过了30%(见图2A)。将circ-SCN9A 过表达后发现这6 个miRNA 的表达均不同程度地受到抑制(见图2B)。敲减circ-SCN9A 后,这6 个miRNA 的表达均明显上调 (见图2C),这说明circ-SCN9A 可以调控这6 个miRNA 的表达水平从而影响它们生物学功能的发挥,其中hsa-miR-1256与circ-SCN9A 之间的相互作用关系最为显著(见图2)。
3.血清circ-SCN9A 水平在DPNP 中的临床诊断价值

图1 SCN9A 来源的circRNA 在DPNP 中的表达及细胞内定位(A) 在SCN9A 来源的14 条circRNA 分子中,hsa_circ_0117953 (circ-SCN9A)在DPNP 血清中呈现出显著的高表达(n = 60),*P < 0.05,***P < 0.001,与健康对照组相比;(B) circ-SCN9A 在染色体的位置和转录剪切模式;(C)与线性SCN9A 转录本相比,circ-SCN9A 具有抵抗RNA 外切酶的生物学特性,**P < 0.01;(D)核质分离实验证实circ-SCN9A 主要是分布于细胞质内,*P < 0.05,***P < 0.001Fig. 1 Expression and intracellular localization of SCN9A-derived circRNA in DPNP(A) Among 14 circRNA molecules from SCN9A, hsa_circ_0117953 (circ-SCN9A) showed significantly high expression in DPNP serum (n = 60), *P < 0.05, ***P < 0.001, compared with healthy control group; (B) circ-SCN9A in chromosome position and its transcriptional and cleaved pattern; (C) Compared with linear SCN9A transcript, circ-SCN9A has biological characteristics of resistance to RNA exonuclease, **P < 0.01; (D) Nucleocytoplasmic separation experiments confirmed that circ-SCN9A was mainly distributed in the cytoplasm, *P < 0.05, ***P < 0.001.
本研究发现血清中circ-SCN9A 的水平在DPNP病人和健康对照者之间存在显著性差异(见图1A)。ROC 曲线模型是分析连续变量特异性和敏感性的指标,曲线下的面积越大,则变量的诊断价值越大。本研究采用该模型来分析circ-SCN9A 在DPNP 中的诊断价值,结果显示ROC 曲线的线下面积达到了0.89,敏感性为0.81,特异性为0.83(见图2D)。为排除糖尿病本身导致circ-SCN9A 变化的影响,本研究比较了circ-SCN9A 在无NP 症状的2 型糖尿病病人组和健康对照组之间变化,未发现统计学差异(见图 3A)。DPNP 伴有中度疼痛病人的血清circ-SCN9A 水平显著低于重度疼痛病人组(P < 0.01,见图 3B)。这些结果说明circ-SCN9A的表达变化并不受糖尿病状态的影响,而是与其导致的DPNP症状相关,暗示血清中circ-SCN9A 的水平有望作为该病具有诊断价值的潜在外周生物学标志物。
4. DPNP 相关circ-SCN9A 可通过调控miR-1256影响下游靶基因的表达

图2 DPNP 相关的circ-SCN9A 对miRNA 的调控作用和临床价值分析(A) LUC 报告基因实验筛选出多个与circ-SCN9A 具有结合能力的miRNAs;(B) 与阴性对照组相比,细胞中过表达circ-SCN9A 可显著抑制上述miRNAs 的表达,*P < 0.05,**P < 0.01,***P < 0.001;(C) 与阴性对照组相比,敲减circ-SCN9A 的表达水平可显著提高上述miRNAs 的水平,**P < 0.01,***P < 0.001;(D) ROC 曲线分析显示血清中circ-SCN9A 水平在DPNP 中具有较好的潜在诊断价值Fig. 2 The regulatory role of DPNP-related circ-SCN9A on miRNA and its clinical value analysis(A) A number of miRNAs with binding ability to circ-SCN9A were screened by LUC reporter gene assay; (B) Compared with negative control, upregulated circ-SCN9A in cells significantly inhibited the expression of the above miRNAs, *P < 0.05, **P < 0.01, ***P < 0.001; (C) Compared with negative control, downregulated circ-SCN9A expression can significantly improve the levels of the above miRNAs, **P < 0.01, ***P < 0.001; (D) ROC curve analysis showed that the serum level of circ-SCN9A had good potential diagnostic value in DPNP.
KEGG 是一个基因组破译方面的数据库,用于从分子水平来了解细胞和生物系统的高级功能,为更高层次和更复杂各种细胞活动和生物体行为作出可靠的计算推测。为探究DPNP 相关circ-SCN9A的神经生物学病理机制,本研究联合多个生物信息学分析工具对circ-SCN9A 互相作用的多个miRNA进行KEGG 生物学作用通路分析显示,与circ-SCN9A 存在调控作用关系的6 个miRNA 均共同参与了5-羟色胺能突触(Serotonergic synapse) 作用通路 (见图 4A)。对它们在该通路中的调控关系进行图形化展示发现了多个与之有关的靶向作用蛋白基因(见图4B)。鉴于其中miR-1256 与circ-SCN9A的作用关系最为密切(见图2),本研究采用WB实验对miR-1256 在该调控网络中的靶基因钾向内整流通道亚家族J6 (potassium inwardly rectifying channel subfamily J member 6, KCNJ6) 进行蛋白表达水平检测,结果发现circ-SCN9A 的表达可以显著影响下游基因KCNJ6 的蛋白水平(见图4C)。
讨 论
神经病变是糖尿病病人常见的并发症,20%左右病人有DPNP 的症状,严重影响病人日常生活工作及心理健康,相应医疗支出也迅速增加[2,15,16]。高血糖可以使神经元处于显著的氧化应激状态,激活细胞内信号转导分子引起炎症反应,进而释放组胺、前列腺素、细胞因子等多种细胞介质[2]。这些介质可以作用于神经细胞外膜上的痛觉感受器使其敏化,进而导致神经细胞膜上离子通道异常开放,增加兴奋性神经递质的释放,从而使得神经细胞过度兴奋,最终使机体产生痛觉过敏或超敏状态[2]。在痛觉传输的过程中,编码离子通道蛋白的基因发挥着重要的作用。SCN9A 基因编码的离子通道蛋白Nav 1.7 是维持神经元兴奋性的关键调节因子,其在周围神经系统的伤害感受器神经元和大脑皮层下的结构中高度富集表达[17]。Nav 1.7 的功能获得性突变与DPNP 等获得性疼痛病有密切联系[17,18]。然而,对于SCN9A 基因的环状转录本在疼痛相关的疾病中的作用尚未见报道,亟待明确。

图 3 血清circ-SCN9A 水平与疾病临床特点之间的相关性比较(A) 血清circ-SCN9A 水平在DPNP 病人组、无NP 症状的2 型糖尿病病人组和健康对照组之间比较,***P < 0.001;(B) 伴有重度疼痛的DPNP 病人血清circ-SCN9A 水平显著高于中度疼痛病人组,**P < 0.01Fig. 3 The correlation between serum circ-SCN9A level and clinical characteristics of the disease(A) Serum circ-SCN9A level among DPNP group, type 2 diabetic patients without NP symptoms and healthy controls, ***P < 0.001; (B) The serum circ-SCN9A level of DPNP patients with severe pain was significantly higher than that of patients with moderate pain, **P < 0.01.
本研究对来源于SCN9A 基因的circRNA 在DPNP 中的表达谱进行了检测,发现部分circRNA存在显著的差异表达,尤以circ-SCN9A 的差异最为显著(见图1A)。通过细胞生物学功能分析发现circ-SCN9A 可以在神经细胞质内吸附多个miRNA,进而调节这些miRNA 的生物学功能(见图2、3)。在circRNA 与疼痛疾病的研究中发现circHIPK3 不仅在DPNP 病人的血清内高表达,而且上调程度与神经病理性疼痛分级呈正相关[14]。这提示circRNA具有作为DPNP 临床生物学标志的潜力。本研究利用ROC 模型发现circ-SCN9A 在外周血血清中的水平具有较好的鉴别DPNP 和健康者的价值(见图2D),且不受糖尿病本身状态的影响并与DPNP 伴发的疼痛程度相关(见图3),有望成为DPNP 新的客观生物学指标。为探究其中的分子病理学基础,本研究对circ-SCN9A 所调控的多个miRNA 的功能进行了生物信息学集合分析,发现它们可共同地作用于Serotonergic synapse(5-羟色胺能突触)通路(见图3A),调节多个重要功能蛋白(见图3B)。这其中KCNJ6 基因编码一种由G 蛋白控制的ATP 敏感的内向整流钾通道[18,19]。已发现KCNJ6基因的突变可以降低个体对痛觉的敏感性[19],提示该基因对于人类痛觉阈值的维持具有重要的调节作用。本研究发现circ-SCN9A 的表达对于KCNJ6 基因的蛋白水平具有显著的调节作用 (见图3C)。这一重要发现从分子神经病理学机制层面证明了DPNP 相关的高表达circ-SCN9A 可抑制miR-1256的基因沉默作用,从而促进KCNJ6 基因的蛋白表达,进而使得DPNP 病人痛觉阈值降低,导致疼痛性临床症状的发生。这一发现对于进一步深入理解DPNP 发生的分子神经病理学机制具有重要的推动作用。
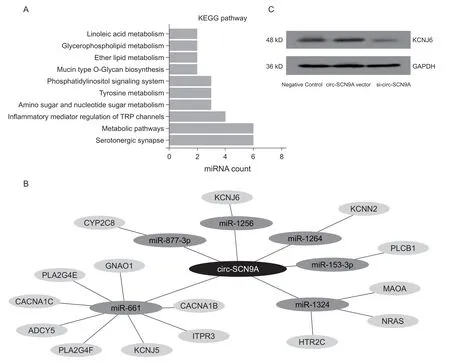
图4 DPNP 相关的circ-SCN9A-miRNAs 调控网络的作用通路筛选和分子机制(A) KEGG 分析显示circ-SCN9A 所调控的6 个miRNAs 均作用于5-羟色胺能突触(serotonergic synapse)通路;(B) 构建circ-SCN9A-miRNAs-mRNA 调控网络展示circ-SCN9A 在该通路中的基因调控关系;(C) circ-SCN9A 的表达可以显著影响上述调控网络中下游基因KCNJ6 的蛋白水平Fig. 4 The pathway screening of DPNP-related circ-SCN9A-miRNAs regulatory network and their molecular mechanism(A) KEGG analysis showed that the 6 miRNAs regulated by circ-SCN9A all acted on the Serotonergic synapse pathway; (B) The regulatory network of circ-SCN9A-miRNAs-mRNA was constructed to demonstrate the gene regulatory relationship in this pathway; (C) Expression of circ-SCN9A can significantly affect the protein level of the downstream gene KCNJ6 in the above regulatory network.
DPNP 的临床诊断主要依靠于病人的糖尿病病史和临床表现,一直缺乏有临床价值的生物标记物,对于DPNP 病情的客观评估造成一定的困难。目前多项研究已证实circRNA 在外周血中具有较高的稳定性和表达丰度,有望作为神经疾病诊断和治疗的潜在生物标记[20]。外周血血清circRNA 的检测具有无创、快速和低成本的优点,本研究中DPNP 血清高表达的circ-SCN9A 不仅参与了DPNP 的发生发展并有望具备作为该病潜在的生物学诊断标志的临床价值。目前,虽然部分具有5-羟色胺再摄取抑制作用的药物(如度洛西汀)对于DPNP 的治疗显示出较为肯定的疗效,但其详细作用机制却未能完全阐明[2,15]。本研究揭示DPNP 中高表达的circ-SCN9A 可作用于5-羟色胺能突触通路,这强烈提示在DPNP 发生过程中该通路被阻滞或许是此类药物发挥DPNP 治疗效果的分子药理学基础之一。然而,此类药物对于5-羟色胺能突触通路的下游基因靶点的阻断不具有选择性,因此常存在诸多不良反应和治疗风险。
本研究的不足之处在于缺乏活体动物模型来验证上述临床发现和细胞学机理,然而本研究为后续开发针对DPNP 中5-羟色胺能通路的上游和下游靶点更加特异性的靶向药物提供了前期基础,具有重要的转化医学价值。
综上所述,本研究首次阐述了人类疼痛相关基因SCN9A 来源的circRNA 与神经病理性疼痛的关系,发现血清中circ-SCN9A 有望作为DPNP 的潜在临床生物学标记,为更深入理解DPNP 发生的分子病理学机制提出了新的思路,对后续该病特异性靶向治疗策略的提出具有重要的推动意义。

