腹腔镜食管裂孔疝修补术25例疗效分析
阿卜来提·艾则孜 阿地力·阿布拉
食管裂孔疝是胃食管连接部和胃的腹部成分通过膈肌的食管裂孔进入纵隔[1]。正常情况下,远端管状食管在膈肌下方延伸约2 cm与胃相连,胃食管连接部和膈肌收缩有助于减少胃反流[2],因此多数食管裂孔疝患者伴有胃酸反流症状,胃食管反流病(gastroesophageal reflux disease,GERD)是以烧心、反流症状、吞咽困难、胸痛、反流以及咳嗽和呼吸困难为主要特征的胃肠道疾病之一,随着年龄的增加发病率更高[3]。GERD在西方国家的患病率较高,发病率2.5%~27.8%[4],亚洲国家发病率2.5%~33.1%[5],由此可见随着检查技术水平的提高及人们生活水平提高,全部世界GERD发病率逐年增加,因此临床上需要引起注意。
目前内科治疗上主要采用质子泵抑制剂(proton pump inhibitor,PPI),但是部分患者PPI效果欠佳,需要手术干预。传统手术方式取胸腹联合切口,手术创伤非常大,术后不良反应发生率高。随着医疗技术的提高,腹腔镜修补食管裂孔疝已经成为症状性食管裂孔疝患者的标准治疗方法[6]。
资料与方法
一、对象
收集2017年9月至2019年9月新疆民心医院共完成腹腔镜食管裂孔疝修补术患者25例。其中男性14例,女性11例;年龄38~72岁,平均(48.30±7.27)岁;平均身高(163±8.14)cm,平均体质量指数(body mass index,BMI)为(25.32±5.12)kg/cm2。
25例患者均伴有反酸、烧心症状,伴胸骨后疼痛17例,嗳气16例,合并有哮喘7例,均既往有抗酸治疗病史。术前均行胃镜和上消化道钡透联合诊断,根据食管裂孔疝分型,此次病例中滑动性食管裂孔疝13例、混合疝8例、巨大食管裂孔疝4例。
二、方法
25例患者均知情同意后,所有患者术前、术后均由经Gerd Q问卷调查专业培训过的医务人员进行Gerd Q调查,术前行胃镜、上消化道钡餐检查。

图1 游离组织后可见部分胃组织通过食管裂孔进入胸腔

图2 食管裂孔疝用圆针7号丝线缝合膈肌脚
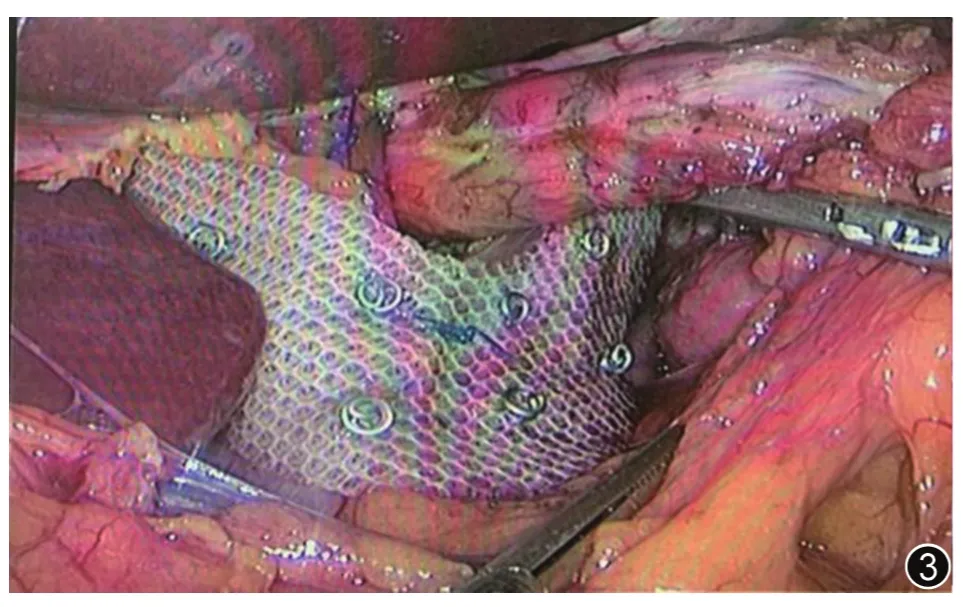
图3 用专用补片修补、加固食管裂孔
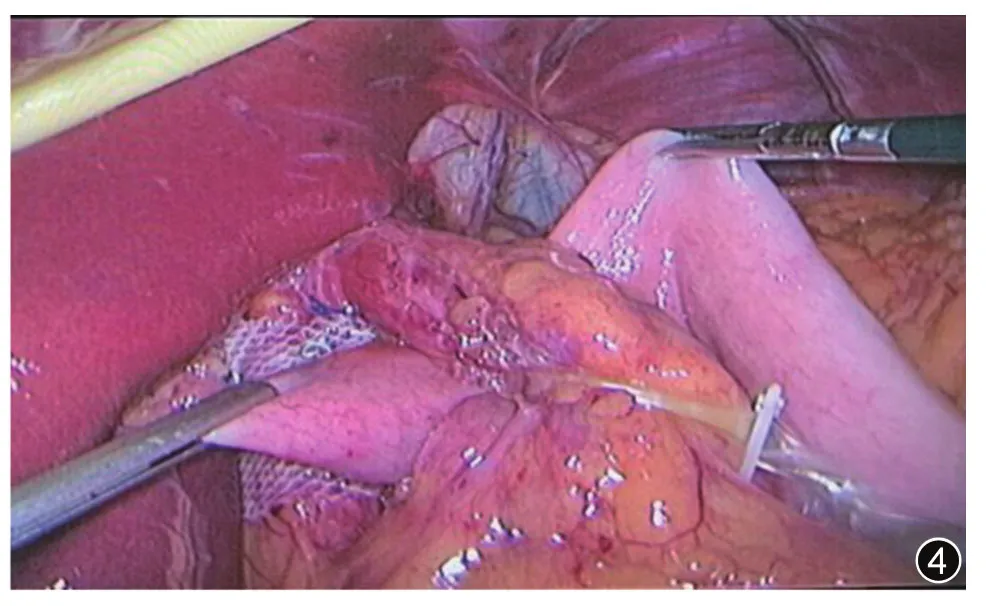
图4 术中采取胃底折叠,以达到抗反流目的
术前常规禁食、禁水,留置胃管、导尿管。所有患者采用气管插管全身麻醉,仰卧位,右侧抬高30°,头高脚低,双腿分开外展“大字形”。术者位于患者两腿之间。切口选用:因为操作主要在贲门区,避免镜头长度不够,造成操作困难,脐上2~3 cm左右置10 mmTrocar,作为观察孔;左锁骨中线中腹行10 mm孔作为主操作孔(超声刀或热能刀操作孔),便于直接操作,右锁骨中线5 mm,通常用于无损伤操作钳做牵拉暴露,气腹压力选择10~14 mmHg(1 mmHg=0.133 kPa)。采用4~5 mm孔用将钢丝自制成“S”型,进入腹腔,套上橡胶管作为左肝拉开器,无损伤牵拉肝脏,暴露贲门。先用超声刀或热能刀离断肝胃韧带,游离胃底至左隔肌脚根部,于胃小弯上部打开小网膜,打开食管下段的膈食管筋膜,游离出左、右膈肌角,用一纱条悬吊食管,完成腹段食管的游离。关闭裂孔,缩小裂孔至1.0 cm左右,管壁裂孔后用食管裂孔疝专用补片加固食管裂孔。牵拉胃底从食管后方绕过,改良Nissen法为将左侧胃底穿过食管侧胃底与右侧胃底前壁缝合2~3针,完成食管周围的360°全包绕;改良Toupet法关闭巨大缺损后,食管较短,胃底张力较大,将食管左侧胃底通过食管后方,包绕食管,与食管右前侧壁缝合3至4针,胃底外缘与右侧膈肌脚缝合固定l针,完成食管侧后方的270°胃底包绕。左肝下置入腹腔引流管并经左肋缘下戳口引出。
三、统计学分析
采用SPSS 23.0统计学软件进行数据分析。计量资料用均值±标准差(±s)表示,采用t检验;计数资料用例数(百分率)表示,采用χ2检验。P<0.05为差异有统计学意义。
结 果
25例腹腔镜食管裂孔疝修补术全部成功。手术时间110(70~190)min,失血量10~50 ml;术后24~48 h进流质饮食,无术后并发症;术后平均住院时间9.1 d,17例患者食管裂孔直径>3 cm,为避免张力缝合,该17例患者均采用腹腔镜食管裂孔专用补片修补,其他8例采取直接缝合。术后胸痛、反酸嗳气等症状明显得到改善,术中摆置引流管于术后2~3 d拔出。
25例患者均行Gerd Q问卷调查,术前Gerd Q评分平均值为(9.8±1.14)分,术后Gerd Q评分平均值为(6.8±1.06)分,差异有统计学意义(t=9.435,P<0.05),提示术后患者反流症状较前明显缓解。
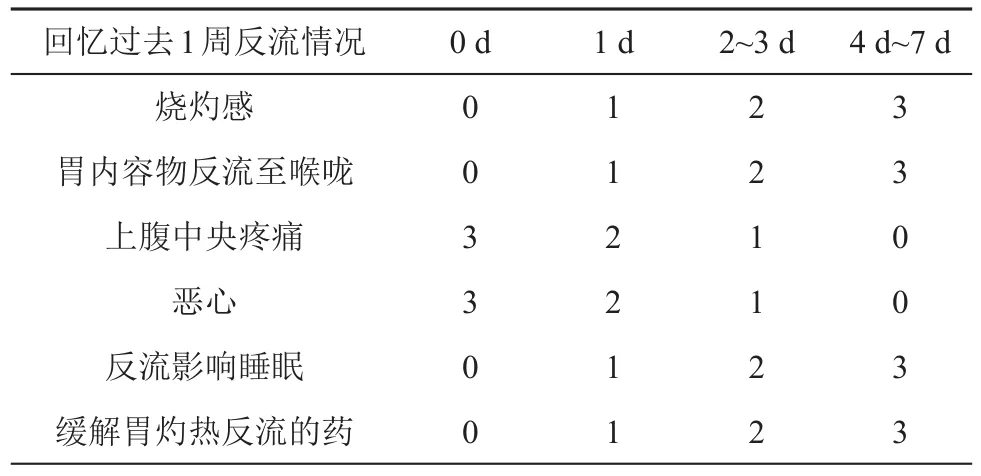
表1 Gerd Q评分量表(分)
25例患者均随访,随访时间中位数8.6个月,无明确复发患者,全部患者中反酸、烧心症状基本缓解;伴有胸痛的17例患者胸痛症状均明显缓解;合并哮喘的7例患者鼻塞、呼吸困难等症状明显好转;25例患者均术后复查6个月,上消化道钡透均未见疝囊复发,未出现术后并发症。
讨 论
食管裂孔疝的表现多种多样,可能是无症状的,也可能表现为反流或梗阻症状。虽然无症状食管裂孔疝患者诊断困难,但近年来诊断率一直在上升,与常规体检率的上升相一致[7]。对于与病理生理症状相关的GERD,由于手术的侵袭性和有效性,以往内科治疗一直是控制症状的首选方法[8],尽管PPI对GERD患者的疗效很高,但由于对PPI缺乏反应,临床失败率高达20%~30%。然而,长期使用PPI可能会导致不良事件,如慢性肾脏疾病、痴呆、骨折、自发性细菌性腹膜炎和非典型肺炎[9]。因此该类患者需要采取外科治疗,避免发生大量并发症而使病情加重。而且随着腹腔镜方法的引入,与手术相关的发病率已经下降,在长期症状改善和成本效益方面,腹腔镜手术优于内科治疗[10]。
根据美国胃肠和内镜外科医师协会推荐的指南,GERD患者的手术指征如下:(1)内科治疗失败;(2)出现GERD并发症(即消化性狭窄和Barrett食管);(3)食道外表现(即哮喘、声音嘶哑、咳嗽、胸痛和吸入)[11]。本研究中,25例患者均既往有口服抑酸药物史,抑酸药物治疗效果欠佳,其中有3例患者甚至出现PPI相关并发症,因此手术治疗可被考虑为最佳治疗方案。
根据最新研究,目前腹腔镜抗反流手术逐步成为GERD的标准外科治疗方法,因为创伤小、恢复快及节省费用等优点,在部分西方国家同样被认为是PPI治疗无效患者的另一种治疗方式[12]。腹腔镜胃底折叠术是控制GERD症状的有效方法,完全典型症状控制率为86.3%,不典型症状控制率为63.3%[13]。本研究中,所有患者术后反酸、烧心症状较前明显缓解,胸痛、哮喘等症状明显改善。
根据患者食管裂孔疝的大小及类型,手术方式略有不同,术中采用Toupet术和Nissen术;针对术前抗酸药物治疗有效,则主要采用Toupet术式为主,如果术前抗酸药物治疗效果不佳,采用Nissen术式。关闭或修补扩大的食管裂孔的方法:如果食管裂孔很大,可用人造网片修补食管裂孔缺损,覆盖上去的网片边缘应超过疝环边缘2 cm;食管裂孔>3 cm,为避免张力缝合建议采用补片关闭缺损;食管裂孔直径<3 cm,则采用7号丝线关闭缺损,本研究中后期效果无明显差异。药物治疗无效非常明显的18例患者行Nissen术,其余患者反酸、嗳气症状较轻,故行Toupet术;根据食管裂孔疝大小,将患者分为2组,并根据疝的大小决定是否用补片:17例患者食管裂孔直径>3 cm,为避免张力缝合,该17例患者均采用腹腔镜食管裂孔专用补片修补,其他8例采取直接缝合,手术顺利,术后治疗效果无明显差异。
同时研究显示,包括年龄、性别和BMI在内的人口统计因素、PPI治疗持续时间和GERD病史等临床参数与手术结果无关[14]。最近,基于腹腔镜技术的发展和经验的积累,现在可以在保持上述益处的同时降低复发率[15]。总之,对于伴有明显症状的食管裂孔疝患者,提高生活质量而言,腹腔镜抗反流手术是一种可行、安全、有效的治疗方案[13]。
综上,本文章描述了本院完成的25例食管裂孔疝修补术,处于减少术后疼痛、发病率和住院时间等优点,与传统的开腹手术相比,腹腔镜修复食管裂孔疝已经成为首选的手术方法,但我们研究存在样本量小和涉及的随访时间相对较短等缺点,因此需要继续长期随访,在保证质量的前提下需要适当增加样本量,继而总结出对患者最有力的治疗方案。

