下肢动脉硬化闭塞症患者介入术后白细胞介素-8、白细胞介素-18、血管内皮细胞生长因子检测及意义
尹 晶, 吴清华, 王 鹏, 姜建威, 张 弘, 姜海军
目前临床上采用经皮腔内血管成形术(PTA)和支架植入术治疗下肢动脉硬化闭塞症(atherosclerotic occlusion,ASO)效果显著,但术后血管再狭窄成为治疗难点[1]。研究显示血管内皮损伤后形成血栓或血管重构引起炎性反应等,均为血管内介入术后血管再狭窄发病的可能机制[2]。研究证实体内炎性反应标志物白细胞介素(interleukin,IL)-8和IL-18可促进炎性反应发生并参与疾病发生发展[3]。血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)参与血管生成和炎性反应等过程,并可促进疾病发展进程[4]。下肢ASO患者介入术后血清IL-8、IL-18、VEGF水平检测研究尚未见报道。本研究选取下肢ASO患者为研究对象,分析介入术后血清IL-8、IL-18、VEGF水平变化及其临床意义。
1 材料与方法
1.1 一般资料
选取在承德医学院附属医院就诊的下肢ASO患者65例(研究组),均经CTA诊断。其中男44例,女21例;年龄52~73岁,平均(64.22±14.07)岁;病程2~24个月。研究组患者介入术后随访3个月,随访结束后复查CTA并与术前比较,术后发生血管再狭窄12例(再狭窄组),未发生再狭窄53例(未再狭窄组)。另选取同期体检的健康志愿者42例(对照组),其中男28例,女14例;年龄55~72岁,平均(65.36±12.78)岁。两组临床资料比较,差异均无统计学意义(P>0.05),具有可比性。患者纳入标准:①下肢ASO患者符合相关诊断标准[5];②未应用激素类药物治疗;③无溶栓、抗凝禁忌证;④对研究知情且签署同意书。排除标准:①有心、肝等重要脏器严重损伤;②有精神疾病;③下肢溃疡坏疽;④下肢ASO患者介入术前后接受其他治疗;⑤不服从治疗或试验安排。
1.2 介入治疗方法
根据研究组患者术前CTA检查结果,采用Seldinger技术穿刺股动脉并置管,实施PTA后行双下肢DSA造影,若血管狭窄开通<50%,即植入支架[6]。随访3个月后复查CTA,评估血管狭窄情况,判断标准为支架内或支架两端血管腔直径狭窄>50%[7]。
1.3 血清IL-8、IL-18、VEGF水平检测
研究组入组时、术后24 h、随访3个月末,对照组入组时分别抽取清晨空腹静脉血4 mL,离心10 min后吸取血清,置于-20℃保存待检测。采用酶联免疫吸附试验(ELISA)法检测血清VEGF、IL-18水平(试剂盒购自深圳晶美生物技术公司),放射免疫分析法检测血清IL-8水平(试剂盒购自北方免疫试剂研究所)。
1.4 临床指标检测
两组入组时均抽取空腹静脉血3 mL。采用ELISA法检测血清血小板活化因子(PAF)、超敏C反应蛋白(hs-CRP)水平,免疫荧光法检测血清尿酸(UA)、尿酸转运蛋白(UAT)水平,微量热沉法检测纤维蛋白原(FIB)含量。
1.5 统计学方法
采用SPSS 22.0软件对数据进行分析。计量资料符合正态分布以均数±标准差(±s)表示,两组间比较用t检验;计数资料以例表示,两组间比较用χ2检验。采用logistic回归法对ASO患者术后再狭窄发生相关因素进行单因素和多因素分析。P<0.05为差异有统计学意义。
2 结果
研究组血清PAF、hs-CRP、UA、FIB水平与对照组相比均显著升高(P<0.001),UTA水平显著降低(P<0.001),见表1。研究组术前、术后血清IL-8、IL-18、VEGF水平与对照组相比,均显著升高(t=18.571、11.393、0.618,P<0.001和t=5.832、4.396、2.735,P<0.001);研究组术后血清IL-8、IL-18、VEGF水平与术前相比,均显著降低(t=22.590、6.437、12.171,P<0.001),见表2。研究组中再狭窄组血清IL-8、IL-18、VEGF水平,均显著高于未再狭窄组(P<0.001),见表3。

表1 两组一般资料比较
表2 研究组介入术前后血清IL-8、IL-18、VEGF水平变化 ±s
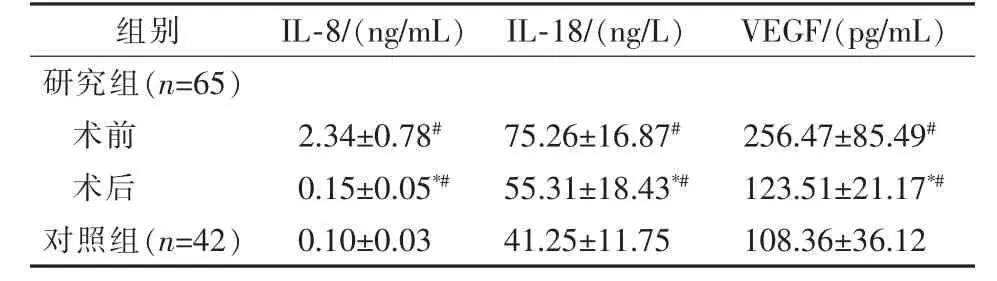
表2 研究组介入术前后血清IL-8、IL-18、VEGF水平变化 ±s
*与术前比较,P<0.001;#与对照组比较,P<0.001
组别 IL-8/(ng/mL)IL-18/(ng/L) VEGF/(pg/mL)研究组(n=65)术前 2.34±0.78# 75.26±16.87# 256.47±85.49#术后 0.15±0.05*# 55.31±18.43*# 123.51±21.17*#对照组(n=42) 0.10±0.03 41.25±11.75 108.36±36.12
表3 研究组再狭窄发生时血清IL-8、IL-18、VEGF水平变化 ±s
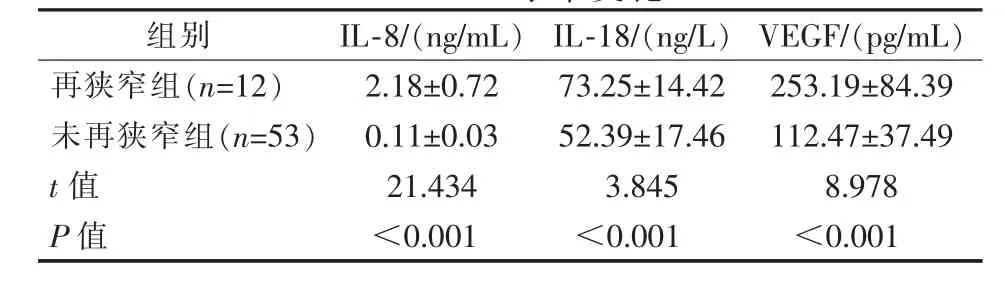
表3 研究组再狭窄发生时血清IL-8、IL-18、VEGF水平变化 ±s
组别 IL-8/(ng/mL)IL-18/(ng/L)VEGF/(pg/mL)再狭窄组(n=12) 2.18±0.72 73.25±14.42 253.19±84.39未再狭窄组(n=53)0.11±0.03 52.39±17.46 112.47±37.49 t值 21.434 3.845 8.978 P值 <0.001 <0.001 <0.001
Logistic单因素分析下肢ASO患者介入术后血管再狭窄相关影响因素结果显示,血清UA、FIB、IL-8、IL-18、VEGF水平升高为影响术后血管再狭窄的危险因素,见表4。进一步logistic多因素分析结果显示,血清IL-8、IL-18、VEGF水平升高为术后血管再狭窄的独立危险因素,见表5。
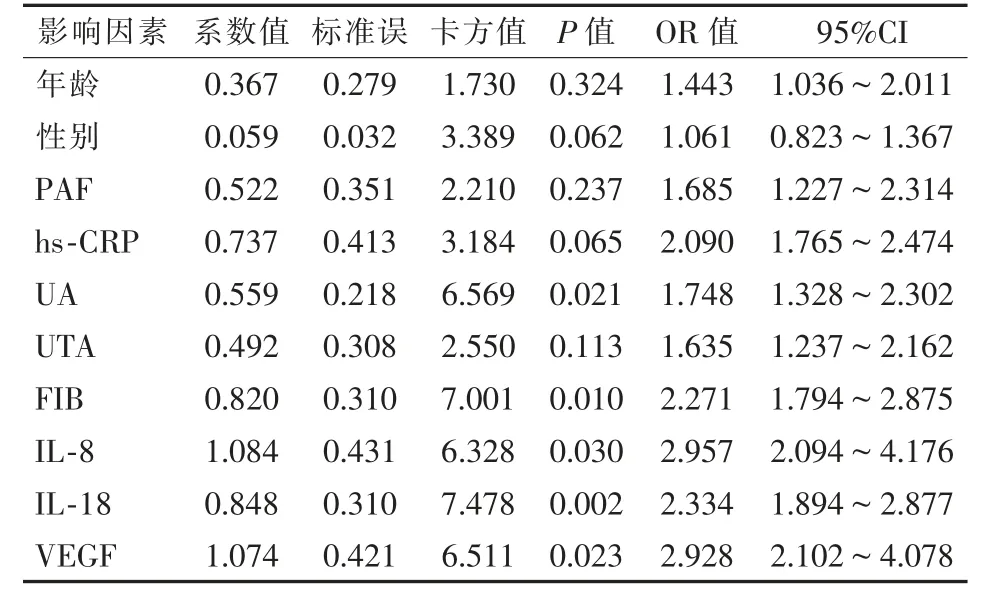
表4 Logistic单因素分析下肢ASO患者介入术后再狭窄相关因素的结果
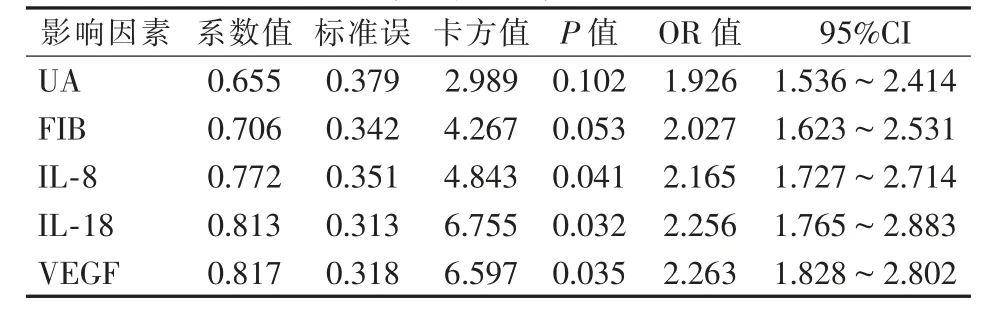
表5 Logistic多因素分析下肢ASO患者介入术后再狭窄相关因素的结果
3 讨论
下肢ASO是一种慢性进展性疾病,炎性反应或内皮细胞损伤引起细胞脂质沉积,引发动脉粥样硬化,促使管腔狭窄或闭塞,以皮温降低、下肢溃疡等为主要临床表现[8]。临床治疗多采用PTA和支架植入术,但部分患者会出现术后血管再狭窄。因而,如何有效评估术后疗效或预后具有重要临床意义[9]。
研究表明IL-8对机体炎性反应具有促进作用,炎性反应越严重,患者血清IL-8水平越高,并参与粥样硬化斑块形成过程[10]。IL-18为新型炎性因子,可促进血管内皮细胞增殖并参与血管重塑等过程[11],但有关IL-18与下肢ASO发病过程的研究相对较少。本研究检测下肢ASO患者血清IL-8、IL-18水平,结果显示患者术前血清IL-8、IL-18水平均显著高于正常对照组,与文献报道相似[12];其术后水平显著低于术前,但仍显著高于正常对照组,这有利于临床早期预测下肢ASO疾病发生,其水平变化还在一定程度上反映疾病进展。本研究还根据下肢ASO患者术后是否发生血管再狭窄,比较分析其血清IL-8、IL-18水平变化,结果显示再狭窄组患者血清IL-8、IL-18水平显著高于未再狭窄组,说明血清IL-8、IL-18水平与术后再狭窄密切相关,其表达水平越高越易发生术后再狭窄。其原因,可能为介入手术操作过程中患者血管壁和内皮细胞受到不同程度损伤,机体出现局部炎性反应,导致血清IL-8、IL-18水平急速上升并引发动脉粥样硬化及血管增生过程。当机体血管内皮细胞恢复正常时,血清IL-8、IL-18水平下降[13]。
研究发现VEGF可促进血管内皮细胞有丝分裂,并反映血管内皮功能[14]。有研究表明,VEGF在动脉粥样硬化形成过程中发挥重要功能,可促使新血管形成,但极易破裂形成血栓并与高表达水平FIB相互作用,加快动脉粥样硬化斑块形成[15]。本研究结果显示,下肢ASO患者介入术前后血清VEGF水平均显著高于对照组,且术后显著低于术前;说明介入术前后患者血清VEGF水平存在显著差异,并可能参与ASO疾病发生、发展过程。这可能是由于下肢ASO患者术前和术中体内半胱氨酸水平升高导致血管内皮细胞损伤或功能障碍,进而引起VEGF水平升高。术后半胱氨酸水平恢复时,VEGF水平明显下降[16]。本研究结果还显示,再狭窄组患者血清VEGF水平显著高于未再狭窄组,说明血清VEGF水平高低与介入术后血管再狭窄发生有关。对影响下肢ASO患者介入术后再狭窄的相关因素进行logistic单因素分析显示,UA、FIB、IL-8、IL-18、VEGF水平均为影响术后再狭窄的危险因素;进一步多因素分析显示,IL-8、IL-18、VEGF水平为术后再狭窄发生的独立危险因素。本研究结果提示,血清IL-8、IL-18、VEGF水平可作为下肢ASO患者介入术后血管再狭窄的重要指标,并可评估介入术后恢复情况。
综上所述,下肢ASO患者介入术后血清IL-8、IL-18、VEGF水平均显著降低,且血管再狭窄患者三者水平均显著高于未再狭窄患者。检测三者表达水平对下肢ASO患者介入术后治疗效果及再狭窄发生具有重要预测价值,有助于临床早期治疗及预后评估。

