颅内动脉瘤介入治疗相关症状性缺血并发症分析
蒋业清, 鲁 刚, 葛 亮, 黄 磊, 万海林, 王震宇, 潘 婷, 张晓龙
颅内动脉瘤人群发病率约为3%[1],其破裂可导致严重致残和致死后果[2]。目前介入治疗已成为颅内动脉瘤主要治疗方式[3],同时症状性缺血并发症发生率及转归成为评价手术安全和疗效的重要指标[4-5],但对颅内动脉瘤介入治疗相关症状性缺血并发症原因及处理措施的研究相对较少。本研究回顾性分析颅内动脉瘤介入治疗相关症状性缺血并发症的原因及处理措施。
1 材料与方法
1.1 一般资料
回顾性分析2011年1月至2019年4月上海华山医院连续介入治疗的942例患者(1 055枚动脉瘤)中确诊的37例症状性缺血并发症。所有患者均按本中心治疗常规及围手术期用药[6]。
1.2 并发症与随访
症状性缺血并发症诊断根据神经科查体和影像学检查结果。2名神经介入专家分别确定并发症原因(意见不一时由科室讨论确定)。术中症状性缺血并发症指术中有血管痉挛、血栓形成或栓塞,术后有新发神经功能缺失,且头颅CT或MRI有新发脑梗死灶;术后症状性缺血并发症指术中造影未见缺血征象,术后麻醉清醒后48 h内出现新发神经功能缺失,急诊造影显示载瘤动脉、动脉瘤累及分支及远端血管内血栓形成或栓塞。
术后6个月采用改良Rankin量表(mRS)评价神经功能恢复状况(<2分为预后良好,≥2分且较术前评分增加为预后不良)。
2 结果
942例患者(1 055枚颅内动脉瘤)中症状性缺血并发症37例(3.9%,37/942),其中术中症状性缺血并发症25例(2.6%,25/942),术后症状性缺血并发症12例(1.3%,12/942)。
2.1 术中症状性缺血并发症
25例中男13例,女12例,年龄(55.3±12.7)(25~76)岁;动脉瘤大小(9.2±6.7)(3.1~27.0)mm;动脉瘤位置、破裂与否、多发动脉瘤及治疗方式见表1。术中症状性缺血并发症发生原因:①载瘤动脉内血栓形成(16例,其中瘤颈部反复操作10例,过度栓塞4例,支架贴壁欠佳2例);②瘤颈部分支闭塞(3例,弹簧圈表面血栓形成或瘤颈部反复操作);③远端分支栓塞或血栓形成[6例,其中导引导管内附壁血栓脱落5例(图1),分支血管痉挛1例]。处理措施及预后:对术中血栓形成或血管闭塞,经导引导管给予替罗非班10μg/kg溶栓、尼莫地平抗血管痉挛、全身肝素化,若效果不佳给予微导丝机械碎栓或Solitaire支架取栓,同时配合动脉内给予替罗非班10μg·kg-1·h-1。术后复查常规头颅CT,如无出血,给予替罗非班10μg·kg-1·h-1静脉维持2~3 d。对支架辅助栓塞患者,予双联抗血小板治疗(肠溶阿司匹林100 mg/d,氯吡格雷75 mg/d)。术后6个月随访显示,mRS评分≥2分2例(0.2%,2/942)。
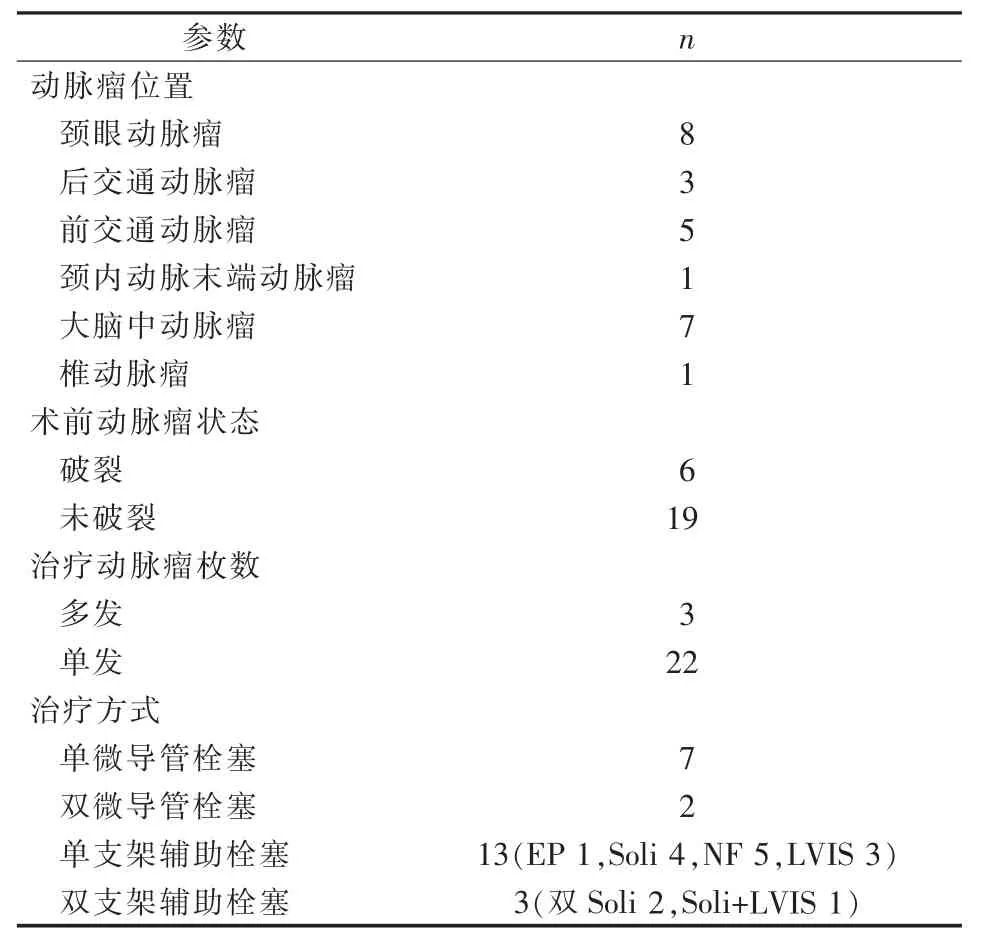
表1 术中症状性缺血并发症患者动脉瘤特征及治疗方式

图1 导管内血栓脱落至大脑中动脉上干分支栓塞影像
2.2 术后症状性缺血症并发症
12例中男5例,女7例,年龄(56.3±9.0)(43~74)岁,见表2。术后症状性缺血并发症发生原因:①载瘤动脉内血栓形成[7例,其中替罗非班应用不足3例,支架贴壁欠佳1例,支架串联重叠部位血栓形成1例(图2),弹簧圈致栓1例,重度贫血1例];②瘤颈部分支闭塞(1例,弹簧圈表面血栓形成)(图3);③远端分支栓塞或血栓形成(4例,均为球囊闭塞试验假阴性,前后交通代偿不足)。处理措施及预后:术后出现新发神经科体征,常规先行头颅CT平扫明确有无出血,无出血予以全身肝素化,症状持续则行急诊脑血管造影明确有无颅内血管内血栓形成或栓塞,发现血栓后按术中血栓形成处理,直至血栓消失或大部消失,观察30 min,复查造影前向血流通畅,远端灌注良好后结束手术,返回病房后继续替罗非班10μg/kg静脉微泵维持48~72 h,术后按急性脑梗死常规用药,常规复查头颅MRI。出院前6例患者mRS评分<2分,3分和2分各3例,术后6个月1例术前mRS评分3分脑梗死患者(患者3)恢复至2分,余患者评分均恢复同术前。
3 讨论
缺血是颅内动脉瘤介入治疗最常见并发症,发生率2.5%~28%[7]。本研究回顾942例患者(1 055枚颅内动脉瘤)中37例(3.9%,37/942)症状性缺血并发症,与文献报道发生率(4.3%)相近[8]。载瘤动脉血栓形成危险因素众多,如血小板抵抗、弹簧圈逃逸、重度贫血[9]等。支架应用及瘤颈部血管内皮损伤导致载瘤动脉内血栓形成[10-12]。术前制定详细手术策略包括合理选择分期手术[13],有助于减少手术操作时间进而减少血栓形成风险。本研究中10例载瘤动脉血栓形成考虑与为达到动脉瘤致密栓塞在瘤颈反复操作致局部内皮损伤相关,提示合理制定手术策略、减少瘤颈部反复操作可降低血栓形成风险。
支架辅助栓塞动脉瘤过度栓塞瘤颈是为了降低复发,但瘤颈部局部反复操作或后释放支架局部打开不良可导致血栓事件。本研究中3例前交通动脉瘤支架辅助栓塞治疗时过度栓塞载瘤动脉引起对侧A2段闭塞,因此对前交通动脉瘤栓塞应合理选择工作角度,避免过度栓塞对侧A2;其中1例颈眼宽颈动脉瘤过度栓塞致支架局部打开欠佳,因此采用支架后释放技术应根据术者经验及支架类型合理选择支架释放时机,以防支架打开不良。
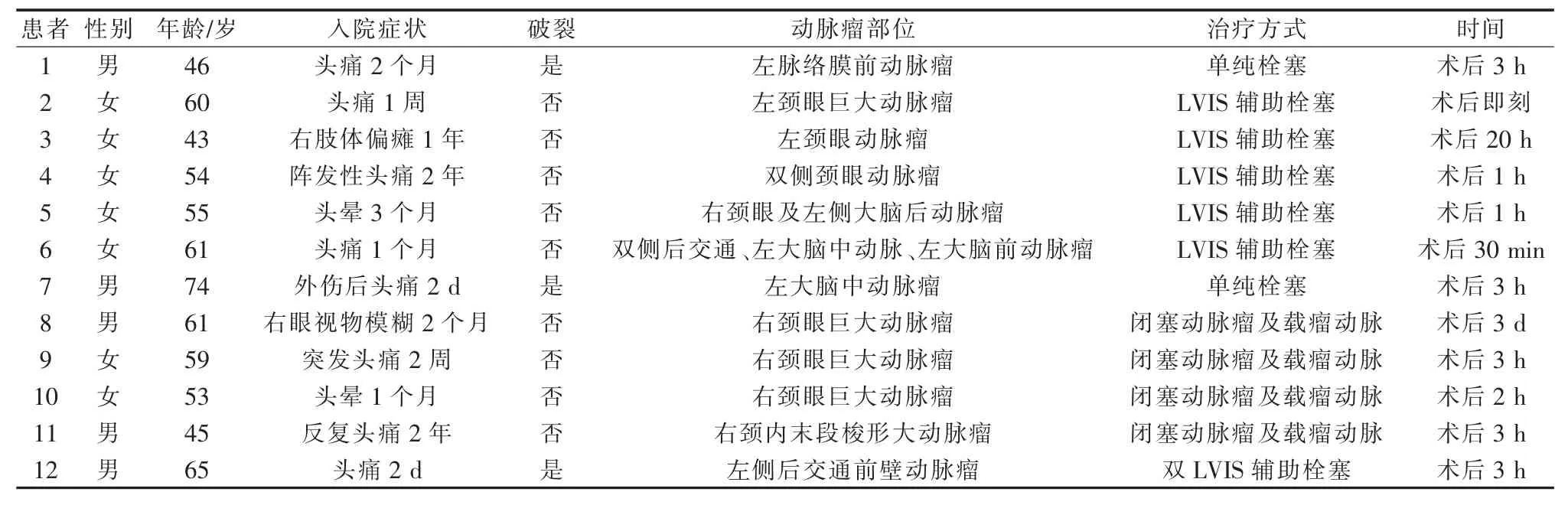
表2 术后症状性缺血并发症患者临床资料

(续表2)

图2 术后支架串联重叠部位血栓形成影像

图3 术后瘤颈部脉络膜前动脉闭塞影像
LVIS编织支架较激光刻蚀支架(Neuroform/Solitaire)致栓性更强[14]。本研究中缺血并发症患者支架辅助栓塞治疗占59.5%(22/37),其中LVIS占54.5%(12/22);2例LVIS局部贴壁欠佳致栓,因此应用LVIS时应在出血高危操作后,尽早行全身肝素化。由于本中心支架辅助患者术前不提前抗血小板准备,因此术后应及时给予足量替罗非班静脉维持,以预防支架内血栓形成。对载瘤动脉存在狭窄患者,必要时可给予球囊扩张。术中可应用DynaCT和非减影旋转造影判断支架贴壁情况[15],LVIS术后可行微导管配合微导丝按摩支架使其完全贴壁,减少支架内血栓形成风险。
抗血小板不足可增加缺血风险[16]。由于本中心术前常规不加用抗血小板药物,围手术期替罗非班应用尤为重要,其具有起效快、半衰期短、抗血小板作用可逆等优点[17],在破裂动脉瘤介入治疗中应用仍安全有效[18],本研究患者中与替罗非班应用不足相关的术后缺血事件有3例。目前指南未明确替罗非班在介入治疗颅内动脉瘤患者中的应用,报道剂量差异较大[19]。本中心采用替罗非班经验方案(术中导引导管内缓慢给予10μg/kg,术后10μg·kg-1·h-1静脉维持48~72 h)桥接双联抗血小板24~48 h,效果良好,但仍需多中心大数据研究进一步验证。
瘤颈部分支闭塞可由栓塞时分支血管保护不够、载瘤动脉局部内皮损伤、动脉瘤栓塞术后占位效应引起。对累及重要分支(如脉络膜前动脉、豆纹动脉)的动脉瘤,可采用微导丝、微导管及大圈技术进行保护[20];不要急于结束手术,应密切观察0.5~1 h,即使是单纯栓塞,术后仍需给予替罗非班,以预防血栓形成。
远端血管血栓形成或栓塞常见原因有近端血管痉挛、滴注系统不畅、多微导管系统等。机械性刺激是血管痉挛常见原因,常表现为近端血管变形伴远端动脉血液滞留,因此及时回撤导引导管解除机械刺激后,应同时经导引导管注入稀释尼莫地平抗血管痉挛[6]。本研究中导引导管内附壁血栓逃逸栓塞5例,滴注系统不畅是导致引导管内附壁血栓常见原因,因此术中应密切关注滴注系统通畅性。尤其是多微导管通过单个Y阀时,微导管间死腔可导致血栓形成[21]。对导引导管内附壁血栓形成,保持滴注系统通畅是关键,3 U/mL肝素0.9%氯化钠溶液经导引导管持续高压灌注可防止栓塞[21]。但本中心未采用之,主要考虑术中滴注速度和时间不一,局部肝素浓度不好控制,有导致致死性出血风险。若为近端载瘤动脉大附壁血栓形成,可直接行支架贴覆。
外科夹闭术后患者可能存在某些载瘤血管内皮损伤[11],易发生血管痉挛。本研究中1例大脑中动脉分叉部动脉瘤外科夹闭术后复发,再次Y型支架辅助栓塞,支架植入后载瘤动脉瘤痉挛明显并血栓形成,经术中常规处理后好转。对此类患者应尽量减少机械性刺激,必要时避免支架植入。
球囊闭塞试验假阴性可导致术后迟发性脑梗死[22]。本组患者中球囊闭塞试验假阴性4例,均为颈内动脉巨大或梭形大动脉瘤,考虑与代偿欠佳及未行加强试验(应用降压药将平均动脉压降至其基础值70%,维持20 min,观察耐受情况)相关。对需要闭塞载瘤动脉患者,其临床和影像学均应阴性,行加强试验明确后方可闭塞血管。若上述检测球囊闭塞试验均阴性患者闭塞载瘤动脉后出现迟发性缺血,可能与流体力学改变后血栓形成相关,术后扩容、抗血小板治疗可降低其发生率。
综上所述,颅内动脉瘤介入治疗相关症状性缺血并发症病因复杂,通过及时识别并联合应用抗凝、抗血小板、抗血管痉挛和机械碎栓等介入治疗,多数患者可获得良好预后。

