基于网络药理学研究麻黄-桂枝药对治疗支气管炎的关键成分及协同作用机制
倪清华,李春晖,杨具洁,李 强,孙继佳,都广礼,董志颖
(上海中医药大学,上海 201203)
支气管炎是由生物或非生物因素引起的支气管黏膜及其周围组织的急性或慢性特异性炎症,表现为咳嗽、咳痰不适等症状[1]。支气管炎发病周期长,易反复而迁延不愈,诱发的因素主要有两方面:一是气温下降、病毒感染、空气污染及过敏等外部因素影响机体;二是由呼吸道防御系统及免疫功能降低等内部因素引起[2]。目前在治疗上以抗菌、抗炎、抗病毒为主,常用到的西药有阿莫西林、头孢氨苄、美喘清等[3]。近年来,我国支气管炎患者数目不断增加,发病率逐渐上升,不少患者因治疗不及时,由慢性支气管炎发展为慢性阻塞性肺疾病,严重影响身体健康和生活质量。
支气管炎在中医学上属于“咳嗽”“喘证”“痰饮”的范畴,中药复方在治疗咳喘、支气管炎等肺部疾病方面有着几千年的治疗经验,一些中成药制剂已广泛用于不同类型的支气管炎疾病治疗[4-7]。麻黄汤是辛温解表的经典名方,具有发汗解表、宣肺平喘的功效。此方由麻黄、桂枝、甘草、杏仁四味药组成,其中,麻黄发汗解表、宣肺平喘、利水消肿,桂枝发汗解肌、温通经脉、助阳化气。现代药理学研究表明,麻黄的主要成分具有平喘、抗病毒及免疫抑制等多种作用[8],桂枝中的桂皮醛、桂皮酸等化学成分具有抗菌、抗炎、抗病毒等药理作用[9]。麻黄汤中麻黄与桂枝是方剂配伍中常用的药对,经辩证处方,两者相伍用药,在治疗支气管炎方面起到了关键作用[10-12]。
网络药理学利用生物学网络系统选取特定信号,展现药物分子、靶点、通路以及疾病基因之间的关系,从而预测药物成分的作用通路及机制[13]。本文尝试运用网络药理学、最小集合覆盖算法以及网络扰动分析方法,筛选麻黄与桂枝配伍治疗支气管炎的主要活性成分,预测其作用靶点,构建成分-组合-作用靶点网络,挖掘起协同治疗的组合成分,进一步探讨两药相伍治疗支气管炎的作用机制;同时,创新性地提出通过最小集合覆盖算法与网络扰动分析方法来挖掘药对中的核心成分以及发现药对中不同成分的协同治疗效应。
1 方法
1.1 成分数据的收集与ADMET 筛选 通过TCMSP(http:/ /tcmspw.com/tcmsp.php )[14]收集,收集麻黄(Ephedra Herba)和桂枝(Cinnamomi Ramulus)的主要化学成分,根据PubChem(https:/ /pubchem.ncbi.nlm.nih.gov)数据库[15-16]进行确认并收集每种成分的PubChem ID以及Canonical SMILES 等信息,以此建立麻黄-桂枝的化学成分数据库。利用ACD/Labs 软件[17],以Lipinski[18]、Solubility、Bioavailability、Metabolic Stability、Ames、hERG 为指标,对麻黄和桂枝的成分进行ADMET 筛选。其中,Lipinski 类药五规则是筛选类药分子的基本法则,在筛选时除去评价为“Bad”的成分;Solubility 为化合物溶解性指标,在筛选时除去“Highly insoluble”的成分;Bioavailability 为口服利用度预测,一般取其值高于90%(Dose 参数取mg =50)的化合物作为有效成分;Metabolic Stability 是衡量药物代谢稳定性的指标,在ADMET 评价中,除去“Unstable in HLM”;Ames 和hERG 分别是基因毒性和心脏毒性指标,筛选时去除具有明确毒性的成分。
1.2 有效成分的靶点预测与识别 利用SEA(http:/ /sea.bkslab.org/)[19]和 HitPick(http:/ /mips.helmholtzmuenchen.de/proj/hitpick)[20]数据库进行靶点预测。参数设置如下:Max Tc >0.6,Precision >50%。在DisGeNET(http:/ /disgenet.org/home/)[21]、GeneCards(https:/ /www.genecards.org/)[22]和 OMIM(https:/ /omim.org/)[23]数据库中收集与“Bronchitis”(支气管炎)相关的基因。运用Venny2.1.0 在线系统(https:/ /bioinfogp.cnb.csic.es/tools/venny/index.html),将3 个数据库收集到的相关支气管炎的基因与麻黄、桂枝有效成分的作用靶点通过取交集进行靶点识别,识别出的所有靶点再通过UniProt(https:/ /www.uniprot.org/)[24]数据库进一步确认。
1.3 PPI 网络构建与模块分析 将上述靶点导入STRING(https:/ /string-db.org/)数据库,设置Organism 参数为Homo Sapiens,将Combine Score 阈值取为0.7。采用Gephi0.9.2 软件构建靶点蛋白的PPI 网络并进行分析,通过Cytoscape 3.7.1 中的MODE 工具对PPI 网络进行模块挖掘,搜索PPI 网络中的核心子模块。
1.4 靶点GO 功能与KEGG 通路富集分析 采用DAVID 6.8(https:/ /david.ncifcrf.gov/)[25]对靶点蛋白进行GO功能与KEGG 通路富集分析,根据Pvalue <0.05、FDR<0.05 进行筛选。根据KEGG 通路富集分析结果建立数据文件,利用Cytoscape 3.7.1 软件构建靶点-通路网络。
1.5 基于SCP 算法的麻黄-桂枝药对治疗支气管炎的关键成分挖掘 最小集合覆盖问题(set covering problem,SCP)是组合优化和理论计算科学中的一类典型问题,它要求以最小代价将某个集合利用其若干子集合加以覆盖[26],已被证明是一个NP 最优化组合问题,不存在多项式时间精确算法,在实际应用中往往只设计求解近似算法,如贪心算法求得近似最优解。因此,本文利用基于贪心思想[27]的SCP 算法,可从已知成分-靶点作用关系中找到包含所有靶点、数量最少的麻黄与桂枝有效成分的集合,这些有效成分作用了与原来组分完全相同的靶点,可认为这个最小有效成分集合就是麻黄与桂枝配伍治疗支气管炎的核心组分,即关键成分集合。
1.6 基于PPI 网络扰动的药对关键成分的协同性分析 药物的靶点网络特征是指在人类蛋白质互作网络背景下,药物靶点蛋白之间所具有的网络特征。平均最短路径距离就是最常见的衡量特征之一,即在PPI 网络中,药物作用靶点之间所具有的最少节点个数。根据药物靶点之间的最短路径距离,可以体现药物靶点对疾病靶点网络的扰动大小,进一步衡量药物对疾病的治疗效果。因此,利用关键成分集CMG作用的靶点在“1.3”项下PPI 网络上的平均最短路径来计算麻黄与桂枝关键成分之间的不同组合对疾病PPI 网络的扰动程度,从而衡量两味中药中关键成分的协同组合治疗特性,以及对支气管炎PPI 网络的扰动程度。具体如下。

其中,dA∈CMG为麻黄中的关键成分,dB∈CMG为桂枝中的关键成分;S(dA,dB)为成分dA与成分dB作用靶点的平均最短路径;nA为成分麻黄dA的靶点个数,nB为桂枝dB的靶点个数。S(dA,dB)越大,表明2 种药物的成分组合对该疾病网络的扰动程度越大,即说明这2 种成分组合治疗效果越好。
本研究基于贪心思想的SCP 算法以及网络扰动计算,均采用课题组使用R 语言(3.6.2)开发的软件工具包完成。
1.7 分子对接验证 采用分子对接技术,对PPI 网络中Degree 值≥20 的核心靶点进行分子对接验证。从PubChem和PDB 数据库(http:/ /www.rcsb.org/)中下载靶点蛋白的pdb 结构文件,利用PyMOL 软件(https:/ /pymol.org/)对所有小分子和关键靶点蛋白进行预处理,去除水分子等杂质,将靶点蛋白输入POCASA 1.1 系统(http:/ /altair.sci.hokudai.ac.jp/g6/service/pocasa/)[28]并计算每个蛋白配体的最佳结合位点(区域),运用AutoDock Vina软件(http:/ /vina.scripps.edu/)[29]进行半柔性分子对接,计算所有小分子与其作用靶点的亲和力值affinity。
2 结果
2.1 麻黄-桂枝药对有效成分的ADMET 筛选 经ACD/Labs 软件筛选,总计得到310 种麻黄、桂枝中的有效成分,去除两者相同成分,最终纳入266 种类药性较好的有效成分。
2.2 疾病靶点的数据收集与靶点识别 通过对266 种有效成分进行靶点预测、筛选与整理,总共得到1 640 对成分-靶点作用关系,经进一步筛选,得到202 个有效成分以及315 个与成分相对应的潜在作用靶点。从DisGeNET、Gene-Cards、OMIM 数据库中分别查询得到65、1 036、52 个与支气管炎相关的疾病基因,经Venny2.1.0 在线系统的靶点识别,结果如图1 所示。通过取交集,得到麻黄与桂枝配伍抗支气管炎的110 个主要成分以及对应的85 个作用靶点,所有靶点通过Uniprot 数据库进行确认,结果如表1 所示。

图1 麻黄-桂枝药对治疗支气管炎预测作用靶点识别

表1 麻黄-桂枝药对治疗支气管炎的85 个潜在作用靶点
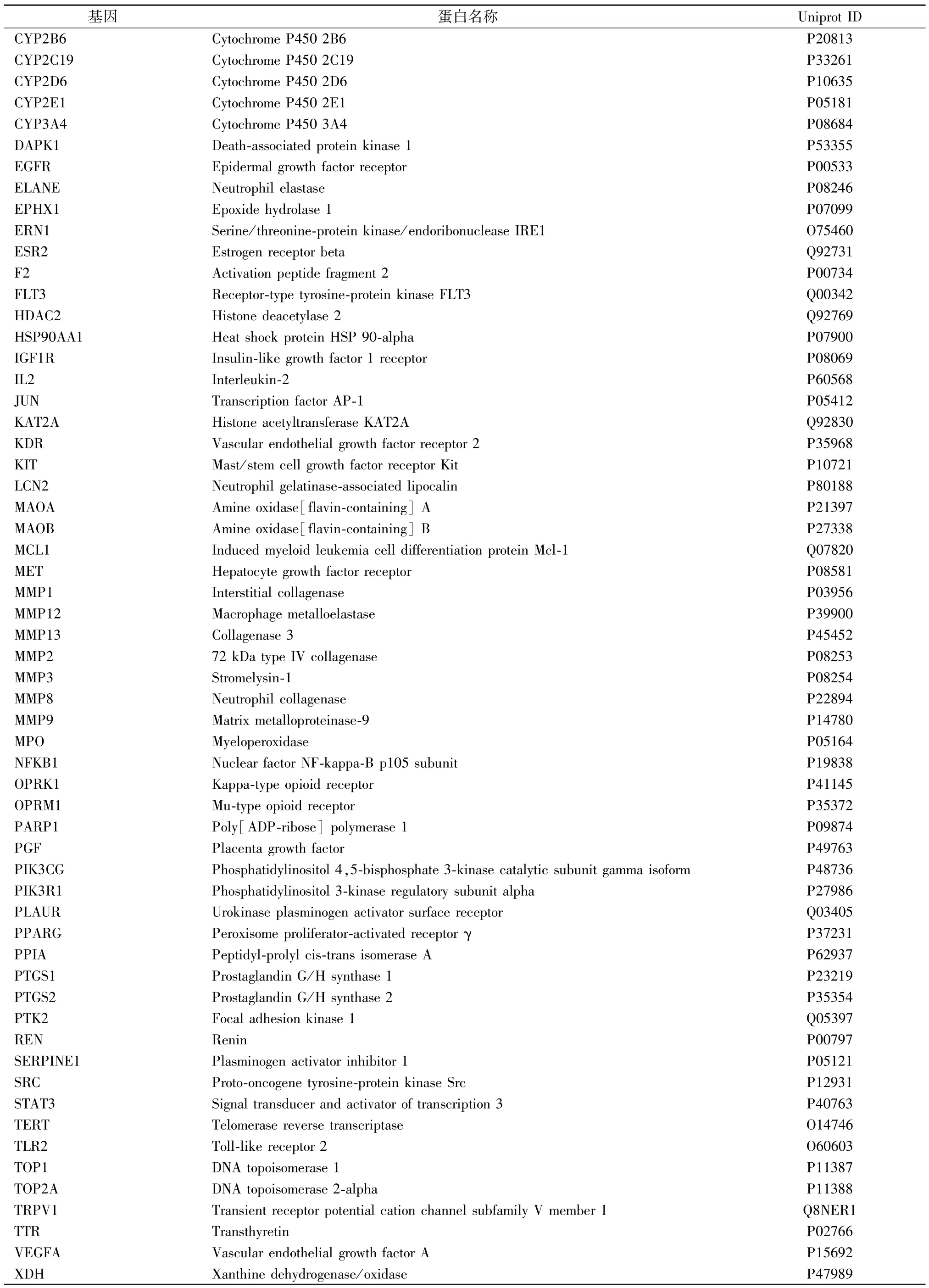
续表1
2.3 PPI 网络构建与模块分析 将上述85 个作用靶点导入STRING 数据库后得到PPI 网络,如图2 所示,每个靶点在PPI 网络中的度值(Degree)如图3 所示。由此可知,VEGFA、STAT3、PIK3R1、EGFR、AKT1、MMP9、SRC 等靶点蛋白度值较大(Degree≥20),表明这些靶蛋白与其他蛋白相互调控作用较强,是PPI 网络中的核心靶点集,也可称为Hub 节点集。
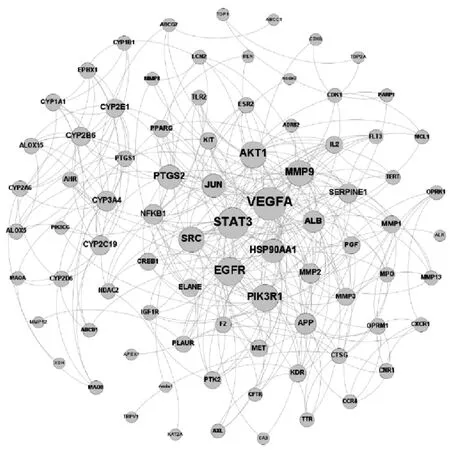
图2 麻黄-桂枝作用靶点的PPI 网络
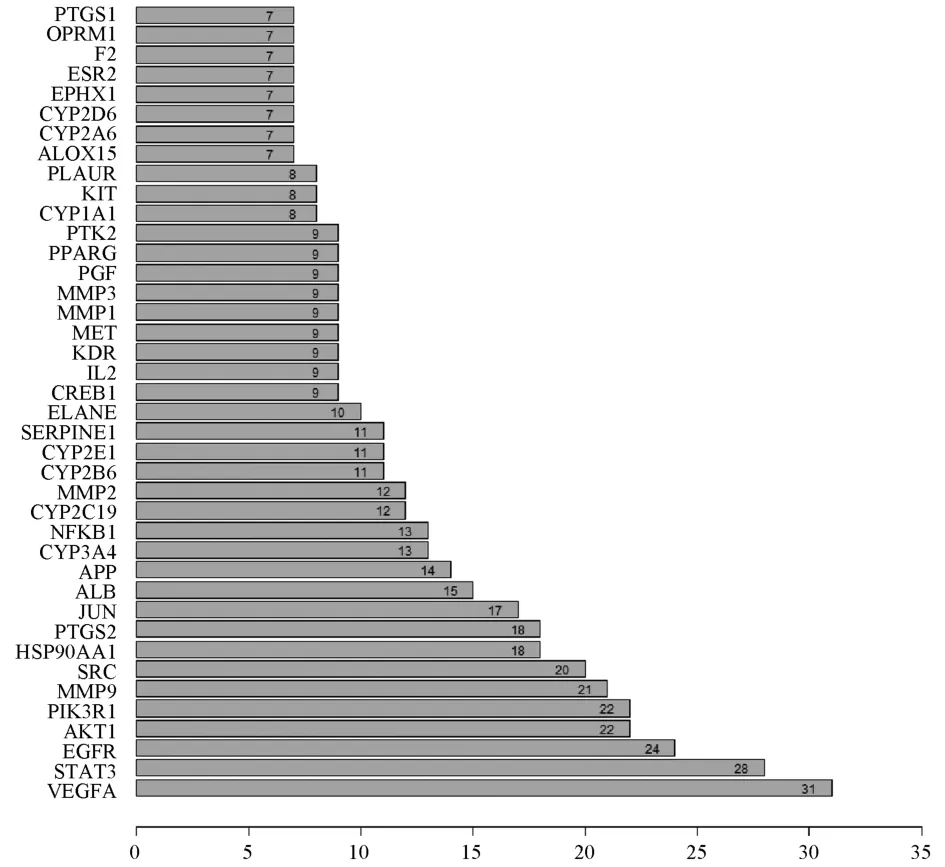
图3 PPI 网络节点度值(Degree)分布
通过MCODE 分析,选取Score>5.0 的子模块,得到2个高度连接的子网络,如表2、图4 所示,表明这些靶点蛋白调控的模块可能在治疗支气管炎的过程中起到重要作用。
2.4 靶点GO 功能与KEGG Pathway 富集分析 在DAVID 6.8 数据库中,对85 个靶点进行GO 功能(BP、CC、MF)、KEGG 信号通路筛选。GO 功能富集共得到33 个结果,其中生物过程(Biological Process,BP)有17 个,细胞定位(cellular component,CC)有2 个,分子功能(molecular function,MF)有14 个,主要涉及氧化还原过程、正向调控细胞增殖、细胞外区域、细胞器膜、ATP 结合以及血红素结合等,如图5 所示。

表2 PPI 网络中的核心子模块及靶点集

图4 核心子模块及靶点蛋白
KEGG Pathway 富集分析得到18 个相关信号通路,结果如图6 所示,表明麻黄与桂枝配伍用药的有效成分主要通过调节PI3K-Akt、TNF、HIF-1、VEGF 等信号通路来治疗支气管炎。具体作用靶点-通路网络关系如图7 所示。

图5 麻黄-桂枝药对治疗支气管炎作用靶点的GO 功能富集分析
2.5 关键成分挖掘及协同组合分析 利用基于贪心思想的SCP 算法,对麻黄、桂枝配伍治疗支气管炎的440 个成分-靶点作用关系进行计算,优化得到覆盖全部85 个靶点的22 个关键成分。其中,麻黄有11 种成分,桂枝有7 种成分,且两药存在4 种共有成分,如表3 所示。

图6 麻黄-桂枝药对治疗支气管炎作用靶点的KEGG Pathway 富集分析
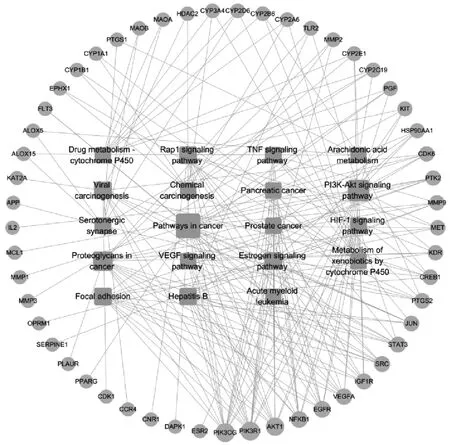
图7 麻黄-桂枝药对治疗支气管炎的靶点-通路网络
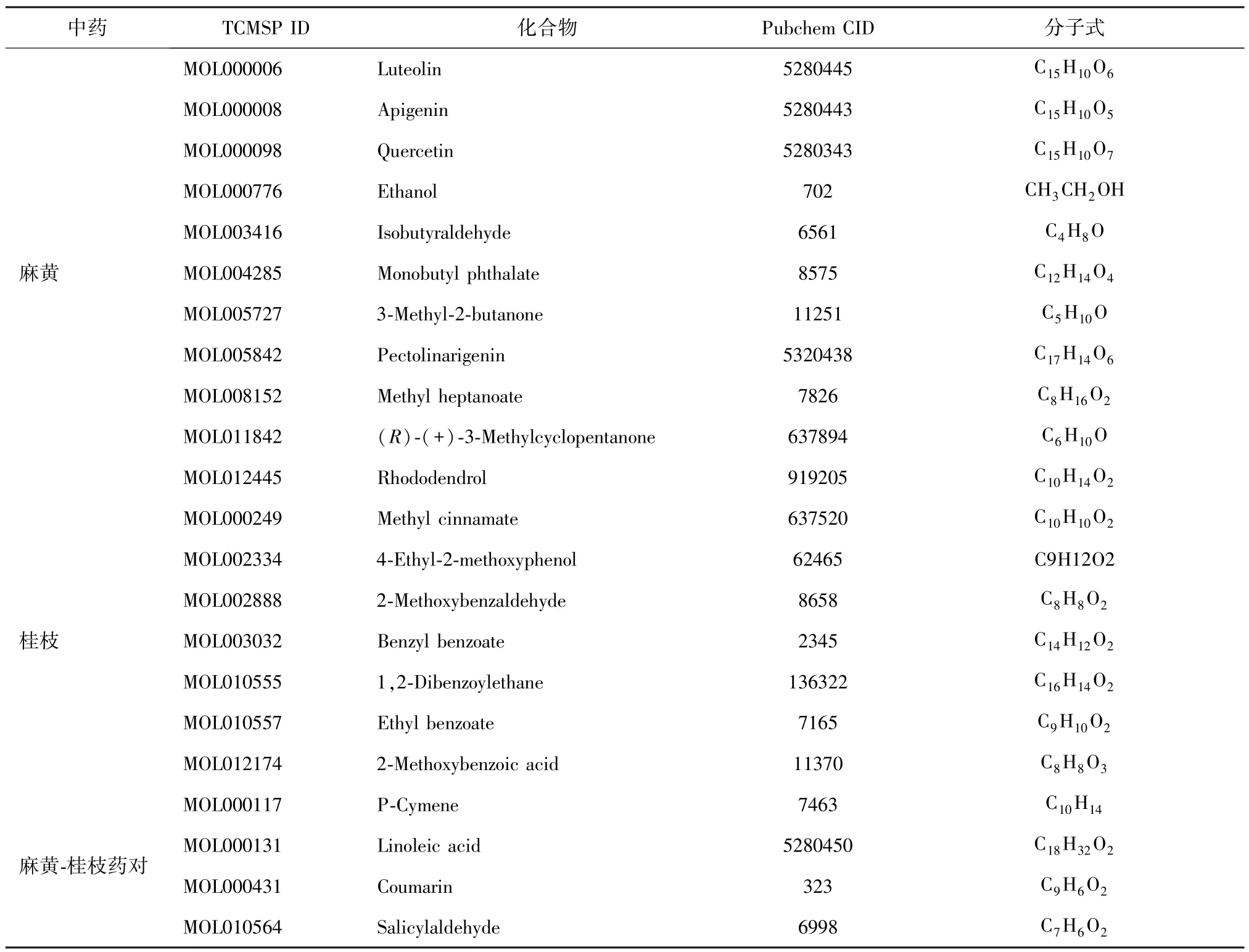
表3 基于贪心思想SCP 计算的麻黄-桂枝药对关键成分
采用“1.6”项下方法,对优化得到的22 个关键成分进行PPI 网络扰动分析,计算麻黄与桂枝不同成分之间的协同性评分值,以此探测不同成分之间可能存在的组合治疗效应。我们发现麻黄中的7 种成分与桂枝中的6 种成分之间存在42 对潜在协同治疗组合,具体协同评分值如图8所示。由此可知,麻黄中isobutyraldehyde(MOL003416)、3-methyl-2-butanone(MOL005727)与桂枝中1,2-dibenzoylethane(MOL010555)、benzyl benzoate(MOL003032)、4-ethyl-2-methoxyphenol(MOL002334)之间具有较高协同评分值,提示这些成分相互组合对PPI 网络的扰动程度较大,在治疗疾病的过程中可能通过这些成分组合之间的协同作用,促使麻黄、桂枝药对产生比简单药效叠加更大的潜在治疗作用。

图8 麻黄、桂枝中42 对核心成分协同评分值
再以Cytoscape 3.7.1 软件构建“成分-协同-靶点”作用网络,如图9 所示。

图9 关键成分-协同-靶点作用网络
2.6 分子对接验证 通过分子对接验证发现,麻黄、桂枝两药中的5 个有效成分2-Methoxybenzaldehyde、2-Methoxybenzoic acid、Apigenin、Luteolin、Quercetin 与7 个核心靶点(Hub 节点)均具有较好的亲和力值(affinity),说明这些有效成分能够通过调节这些核心靶点来治疗或改善支气管炎,如表4 所示。
3 讨论
本研究在网络药理学研究和分析的基础上,引入基于贪心思想的最小集合覆盖(SCP)算法,挖掘麻黄与桂枝配伍入药治疗支气管炎的核心成分组合。利用基于平均最短路径的网络扰动分析方法,探测麻黄与桂枝两味中药中的关键成分组合在治疗支气管炎中的协同作用。
利用AutoDock vina 软件对麻黄、桂枝两味中药中5 种关键有效成分(luteolin、apigenin、quercetin、2-methoxybenzaldehyde、2-methoxybenzoic acid)所作用的7 个核心靶点进行分子对接验证。木犀草素(luteolin)是一种包含多种药理活性的天然黄酮类化合物,具有抗炎、抗过敏、抗氧化等特性[30]。研究证实[31-33],木犀草素主要通过调节炎症介质来起到缓解炎症的作用,能够抑制与引发疾病相关的炎症因子TNF-α、LTB4 的生成,以及抑制NF-κB、组胺、转录因子GATA-3 等的表达来缓解支气管炎症。芹菜素被称为“植物雌激素”,药用价值极高,阚伟娟[34]等在芹菜素(apigenin)抗炎机制的研究中发现,芹菜素通过下调iNOS 蛋白表达水平,能显著抑制巨噬细胞对炎症因子TNF-α、IL-6 及炎症介质NO 的释放。槲皮素(quercetin)为一种具有多种生物学活性的多羟基黄酮类化合物,在抗炎、抗癌、抗氧化等方面均显示出极高的药用价值[35];研究显示[36],槲皮素可以通过下调气道上皮TLR4/NF-κB 的表达,从而起到缓解支气管炎症的作用。
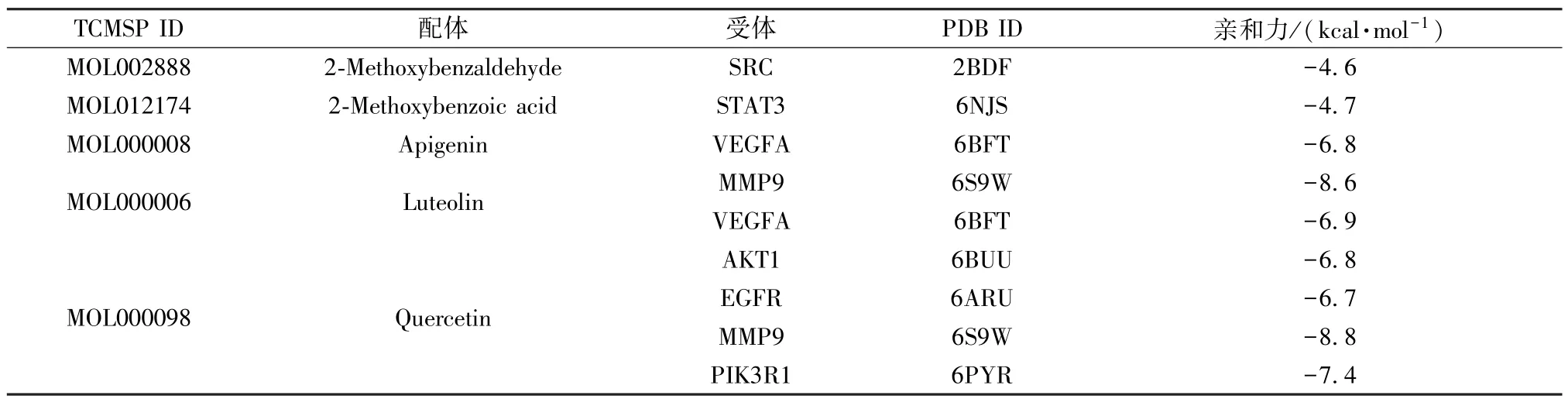
表4 关键成分-靶点分子对接结果
在PPI 网络模块挖掘中,我们发现了麻黄-桂枝药对作用的2 个核心子模块,并对其85 个作用靶点进行了GO 功能和KEGG Pathway 富集分析,结果显示麻黄与桂枝两味中药配伍使用涉及33 个GO 功能以及18 个信号通路。其中,VEGF 靶点及信号通路可直接参与对血管新生的调控,能明显促进全身各组织器官血管内皮细胞的增殖、迁移及趋化[37]。MMP3 能降解细胞外基质和基底膜,在炎症发生、伤口愈合、组织修复及重塑中有重要作用,其表达量增加会导致疾病发生[38]。有研究证明[38-40],木犀草素可以与MMP3 较好的结合,故推测木犀草素是通过下调MMP3 的表达量来缓解炎症反应。MMP9 通过降解内皮基底膜的Ⅳ型胶原成分,从而降低内皮的屏障功能,引发炎症。肿瘤坏死因子-α(TNF-α)通过激活p38 MAPK 信号通路发挥缓解支气管炎症的作用。有研究证明[41-42],MAPK 抑制剂可能是治疗支气管炎症的关键靶点,对揭示中药临床功效有实际意义。PI3K-Akt 信号通路受PTEN、CTMP、SHIP2等多种因子调节,是细胞生存的重要通路之一。研究显示[43-45],PI3K/Akt 可能通过靶向下调CD38 的表达,从而加速细胞周期、促进气道平滑肌的增殖。HIF-1 信号通路可在低氧环境下激活细胞中多种靶基因的转录,存在HIF-1 的巨噬细胞能抑制炎性细胞因子,往往表现出较好的吞噬能力和迁移能力[46-47]。
通过SCP 算法,优化得到麻黄、桂枝的22 个关键成分,结合基于平均最短路径的网络扰动分析方法,从定量分析角度研究两药中关键成分的内在协同机制,预测出麻黄中7 个成分与桂枝的6 个成分之间相互组合具有潜在协同效应,猜测两味中药相伍使用在治疗支气管炎过程中,可能通过这些成分之间的组合效应,产生了比简单药效叠加更大的潜在协同治疗作用。
综上所述,麻黄汤中的麻黄与桂枝配伍用药在对抗支气管炎中具有“多成分、多靶点、多途径”的分子协同机制和特点,利用本文提出的方法可以有效地从中药复方中挖掘核心成分,为深入开展常用中药药对的功效机理研究和开发应用建立理论和方法学途径,为进一步开展中医临床辨证施治、方剂配伍合理用药的深入研究和开发利用提供理论和方法学上的参考。

