HIF-2α 在不同年龄段牦牛肺脏中的表达及分布
陈树吾,杨 琨,姚一凡,张 兰,钟 文,乔自林,刘翊中*
(1.西北民族大学生命科学与工程学院,甘肃 兰州 730030;2.西北民族大学生物医学研究中心甘肃省动物细胞技术创新中心,甘肃 兰州 730030;3.西北民族大学生物医学研究中心生物工程与技术国家民委重点实验室,甘肃 兰州 730030)
青藏高原具有独特的高寒、低氧环境。长期暴露在高原缺氧环境中的哺乳动物,易患肺高血压、右心室肥大等高地疾病[1-2]。在低氧压力下,机体低氧诱导因子表现的稳定性提高。低氧诱导因子2α(HIF-2α)是肺血管对急性和慢性低氧做出反应的重要调节因子,具有调控血管再生的功能,包括细胞增殖、血细胞成熟、血管生成、肺血管发育和胚胎发育等[3-4]。HIF-2α 的表达调节以蛋白质水平为主,HIF-2α是调节低氧生理机制的重要中枢,在低氧性肺动脉高压的发病和进程中参与调节[5]。牦牛已在形态和生理上适应了青藏高原高寒、低氧环境。因此,本试验采用免疫组织化学方法检测了2 个年龄段牦牛肺脏HIF-2α 的表达,研究其分布特征,为了解高原低氧环境下的适应机制提供参考。
1 材料与方法
1.1 试验材料
样品于2019 年10 月份在甘肃省合作市屠宰场获取,为各3头份的3岁与6岁健康牦牛的肺脏组织,采用4%多聚甲醛溶液固定。
1.2 样品处理
取1 cm3肺脏组织制成石蜡切片,切厚度为4~5 μm样品贴附于载玻片,HE染色和免疫组织化学染色。
1.3 试验试剂
多克隆抗体HIF-2α(bs-1447R)和抗兔SP 试剂盒(SP-0023),均购自北京博奥森生物技术有限公司;DAB染色试剂盒(C02-04001),购自北京索莱宝科技有限公司。
1.4 试验方法
1.4.1 免疫组化检测
石蜡切片置于40 ℃烤炉30 min 烤化石蜡,经脱蜡复水,PBS 洗涤5 min,抗原修复后利用SP 试剂盒阻断封闭,滴加1∶100 比例稀释的HIF-2α 兔多克隆抗体4 ℃孵育过夜(阴性对照组抗体为山羊血清)。次日,擦除一抗PBS浸泡滴加二抗,DAB 显色液显色适宜即终止反应,蒸馏水冲洗,苏木精复染,封片。
1.4.2 图像采集及结果判定
利用光学显微镜观察拍摄染色组织切片图像,采用Image-Pro-Plus(6.0 版)定量检测HIF-2α 的阳性表达结果。测量参数包括面积和积分光密度(IOD),并根据所测的IOD和所测区域面积得到平均光密度。
1.5 数据统计与分析
数据采用GraphPad Prism 8软件进行统计学分析。对HIF-2α 平均IOD 值进行单因素方差分析,并对HIF-2α 进行方差分析平均,IOD 采用独立样本t 检验,结果以“平均值±标准差”表示。
2 结果与分析
2.1 牦牛肺脏的组织学结构(见图1)
由图1 可知,2 个年龄段牦牛肺脏的结构组织发育状况良好,未发现病变部位。切片中可观察到牦牛肺脏实质部分的组织分布明显,较易区分。
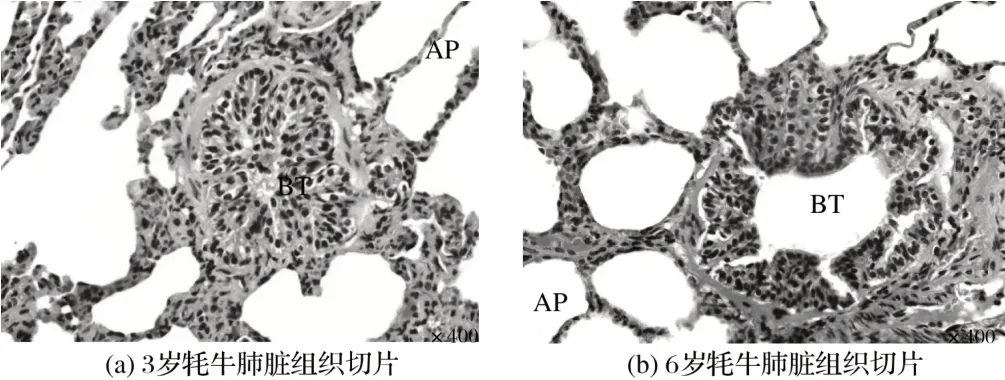
图1 牦牛肺脏的组织学结构Fig.1 Histological structure of yak lung
2.2 牦牛肺脏HIF-2α蛋白免疫组织化学染色(见图2)
由图2可知,3岁牦牛肺脏免疫组织化学染色中,末端支气管上皮细胞和肺泡上皮细胞中HIF-2α 蛋白呈阳性;HIF-2α 蛋白在6 岁牦牛肺脏的末端支气管上皮细胞和肺泡上皮细胞中呈强阳性,在肺血管和肌细胞中呈阳性。6 岁牦牛肺脏HIF-2α 在终末细支气管的免疫染色强度强于3岁牦牛。
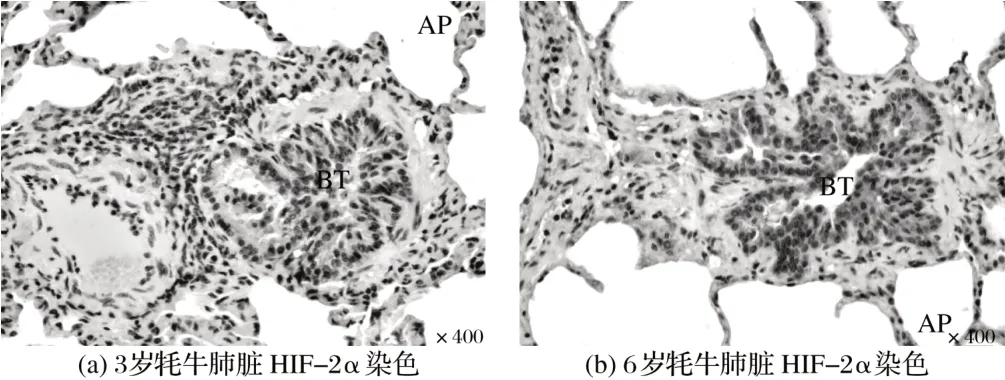
图2 牦牛肺脏HIF-2α蛋白免疫组织化学染色Fig.2 Immunohistochemical staining of HIF-2α protein in yak lung
2.3 牦牛肺脏HIF-2α的平均光密度(见图3、表1)
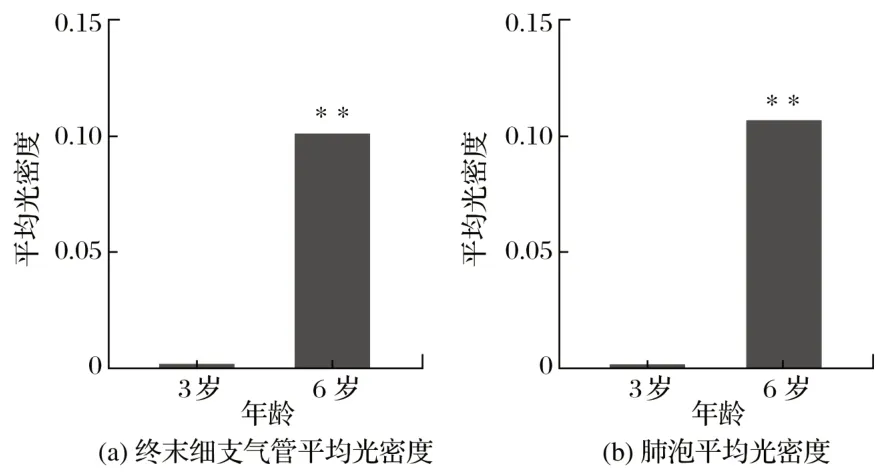
图3 牦牛肺脏HIF-2α的平均光密度Fig.3 Average optical density of HIF-2α in yak lungs
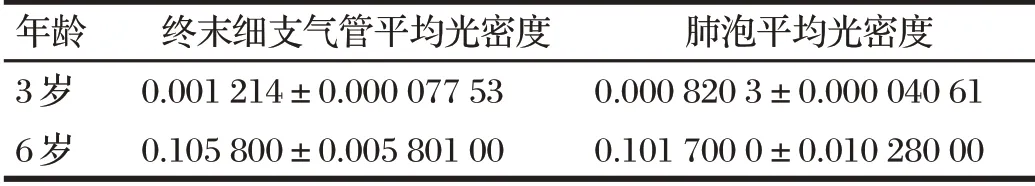
表1 牦牛肺脏HIF-2α的平均光密度Tab.1 Average optical density of HIF-2α in yak lungs
由图3、表1可知,6岁牦牛肺脏HIF-2α在终末细支气管的免疫染色强度相与3 岁牦牛差异极显著(P<0.01),HIF-2α 在肺泡中3 岁和6 岁免疫组化染色结果与终末细支气管中结果相似。
3 讨论
牦牛肺脏结构与黄牛不同。牦牛肺的肺血液空气屏障比黄牛更薄,有利于牦牛在高海拔低氧地区气体交换过程中促进氧气扩散[6]。低氧可迅速增加细胞内的HIF-2α蛋白含量,HIF-2α 可通过脯氨酸羟化酶和天冬酰胺羟化酶羟化途径被降解,因此其活性受含氧水平调节[7]。HIF-2α可激活下游部分靶基因如促红细胞生成素(EPO)、血管内皮生长因子(VEGF)等,低氧环境下EPO 与VEGF之间调节机体的生理病理反应有一定的功能相似性[5]。慢性低氧期还能够增强HIF-2α 的稳定性[8]。在高原低氧环境下,HIF-2α进化速率最快,并且能够调节下游靶基因和铁代谢,降低了哺乳动物慢性高原病的发病率[9-10]。低氧条件下血管内皮细胞、肺成纤维细胞和上皮细胞中的HIF-2α表达量明显高于常氧状态[11]。
本研究结果显示,6岁牦牛肺脏中HIF-2α的表达显著高于3 岁牦牛。Ebersole 等[12]研究发现,恒河猴的黏膜组织中HIF-1α和HIF-2α与衰老呈正相关,其结果与本研究结果相似。HIF-2α还可通过破坏代谢稳态和线粒体凋亡诱导细胞抵抗凋亡[13-14],也可能是因年龄增长,细胞凋亡增加而导致HIF-2α 表达量增加。正常环境中,HIF-2α 更多在一些组织器官胚胎发育时表达,在成人细胞中的表达量较少。姜华鹏等[15]研究表明,HIF-2α在细胞长期低氧适应性中起到重要作用,与本研究中随着年龄增长,牦牛在低氧条件下生活时间与HIF-2α表达量呈正相关的结果相一致。牦牛随着年龄的增长,肺脏中HIF-2α逐渐增加,迁移能力显著上升,其抗损伤能力也随之上升,以此满足细胞增生,应对牦牛所生活的高原环境。
4 结论
本试验通过在3 岁牦牛与6 岁牦牛肺脏中观察HIF-2α表达分布情况,发现该蛋白于3岁牦牛肺脏组织中在终末支气管上皮细胞和肺泡上皮细胞中为阳性表达;在6岁牦牛肺脏组织中在终末支气管上皮细胞和肺泡上皮细胞中为强阳性表达,在肺血管和肌细胞中为阳性表达。低氧能够促进HIF-2α 在牦牛肺脏中的表达,并随年龄增长而上升,进而推测HIF-2α 因子对牦牛适应高原低氧环境具有重要作用。

