肥胖型和非肥胖型PCOS患者血清中GLP-1变化水平及其与BMI、激素水平相关性研究
周青雪 董世雷 施晓春 孙龙 施新颜
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是一种内分泌疾病,主要症状为稀发排卵/无排卵、高雄激素血症、胰岛素抵抗以及卵巢多囊性病变[1~4]。据报道,约40%~80%的PCOS 患者超重[5,6],故治疗PCOS 的关键是减少高雄激素血症、改善体重和提高胰岛素敏感性[6,7]。胰高血糖素样肽1(glucagonlike peptide 1,GLP-1)是一种肠降血糖素激素,在调节食欲、减轻体重和能量摄入方面起着重要作用[8,9]。近年,PCOS 与GLP-1 的关系已成为现代生命科学领域研究热点之一,但有关PCOS 患者GLP-1分泌情况的报道至今尚不一致。
本研究通过比较PCOS 患者与健康体检女性血浆中GLP-1、激素和脂代谢水平的差异,分析GLP-1与PCOS 患者中不同激素水平间相关性,为PCOS 患者的治疗提供思路和理论依据。
1 资料与方法
1.1 一般资料 选取2017 年9月至2019 年10月在杭州市妇产科医院就诊的34例PCOS 患者纳入研究对象,纳入标准为:①PCOS 诊断标准参照2003 年美国生殖医学会和欧洲人类生殖与胚胎学会制定的鹿特丹诊断标准[10];②3个月内均未接受过任何药物或手术治疗;③超声检查卵巢无多囊样改变;④在评估前暂停口服避孕药至少3个月,并停止服用二甲双胍至少1个月,并且未接受已知会影响激素或代谢参数的药物治疗,排除其他内分泌疾病患者。按照世界卫生组织标准,将体重指数(body mass index,BMI)≥25 kg/m2者归为17例肥胖型PCOS 组,平均年龄(26.18±3.32)岁;将BMI<25 kg/m2者17例归为非肥胖型PCOS 组,平均年龄(26.12±3.67)岁。同时选择在我院同期体检的相同年龄段月经周期正常的16名健康女性作为对照组。
1.2 方法
1.2.1 内分泌及卵巢功能检查 所有受试对象均在月经第2~5天经阴道超声检查卵巢大小和每侧卵巢2~9 mm 的卵泡数目,并空腹抽取静脉血5 ml,离心后的血清立即进行上机检测或者暂时放置-80 °C 环境中保存备用。采用贝克曼库尔特DXI-800 自动化学发光免疫分析仪(由美国贝克曼库尔特有限公司生产)测定促卵泡激素(follicle stimulating hormone,FSH)、促黄体生成素(luteinizing hormone,LH)、睾酮(testosterone,T)、硫酸脱氢表雄酮(dehydroepiandrosterone sulfate,DHEAS)和性激素结合球蛋白(sex hormone-binding globulin,SHBG),计算游离雄激素指数(free androgen index,FAI),FAI=T/ SHBG×100[11]。采用酶联免疫(enzyme-linked immunosorbent assay,ELISA)法测定血清总GLP-1含量。
1.2.2 血糖、胰岛素和血脂类检查 抽取空腹及口服75 g 葡萄糖后1 h 及2 h 的静脉血5 ml,分离血浆,采用贝克曼库尔特AU5821 全自动生化分析仪(由美国贝克曼库尔特有限公司生产)测定空腹血糖(fasting plasma glucose,FPG)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)。空腹胰岛素(fasting insulin,FINS)采用贝克曼库尔特UniCel DxI 800 全自动免疫分析系统(由美国贝克曼库尔特有限公司生产)进行测定。稳态模型胰岛素抵抗指数(the homeostasis model assessment of insulin resistance,HOMA-IR)=FPG ×FINS/ 22.5[12]。
1.3 统计学方法 采用SPSS 22.0 软件进行统计学分析,计量资料以均数±标准差()表示,比较采用t检验,指标间的变量关系采用Pearson相关性分析。设P<0.05为差异有统计学意义。
2 结果
2.1 PCOS患者与对照组血清中GLP-1水平比较 PCOS患者GLP-1 水平平均为(6082.63±3626.64)pg/ml,明显高于对照组(3109.74±951.51)pg/ml,差异有统计学意义(t=3.21,P<0.05)。其中肥胖型PCOS 患者GLP-1 水平平均为(7457.80±4324.81)pg/ml,明显高于非肥胖型PCOS 患者(4707.46±2098.69)pg/ml,差异有统计学意义(t=2.36,P<0.05)。
2.2 PCOS患者与对照组不同生理指标比较见表1
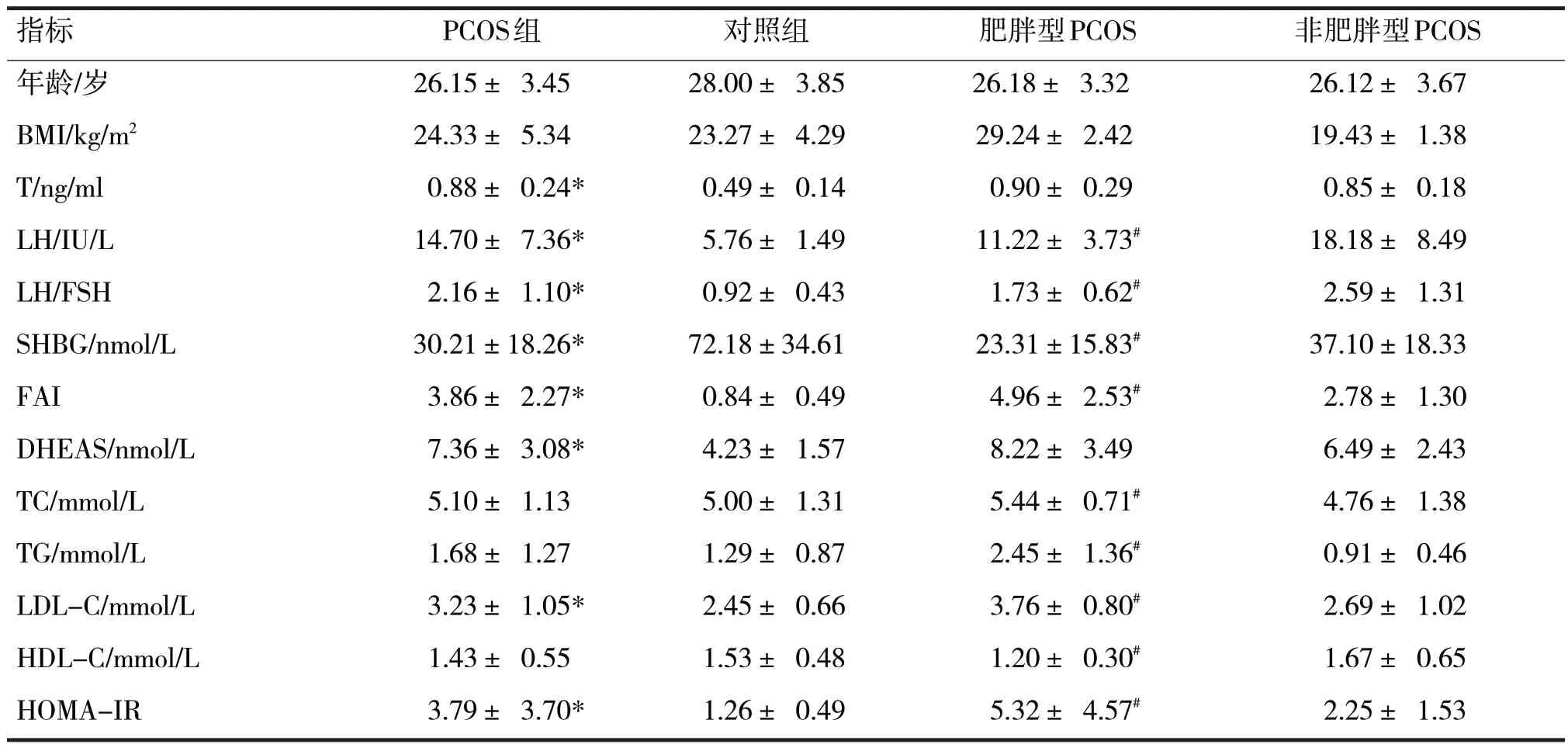
表1 PCOS患者和对照组不同生理指标的比较
由表1 可见,PCOS 组和对照组的年龄、BMI、TC、TG 和HDL-C 水平均无明显差异(t分别=-1.71、0.70、0.27、1.10、-0.60,P均>0.05),而PCOS 组血清T、LH、LH/FSH、FAI、DHEAS、LDL-C和HOMA-IR水平均明显高于对照组(t分别=6.10、4.79、4.35、5.24、3.82、2.69、2.71,P均<0.05),SHBG 水平明显低于对照组(t=-5.64,P<0.05)。
肥胖型PCOS 患者血清中LH、LH/FSH、SHBG和HDL-C 浓度水平明显低于非肥胖型PCOS 患者(t分别=-0.31、-2.44、-2.35、-2.70,P均<0.05),而FAI、TC、TG、LDL-C 和HOMA-IR 水平则明显高于非肥胖型PCOS 患者(t分别=3.18、1.83、4.43、3.41、2.62,P均<0.05),但两种类型的PCOS 患者的年龄、血清中T 和DHEAS 水平比较,差异无统计学意义(t分别=0.05、0.61、1.67,P均>0.05)。
2.3 PCOS 患者血清GLP-1水平与BMI或激素水平间的相关性分析 在PCOS患者中,血清GLP-1水平与BMI 和LH/FSH 具有明显相关性(r分别=0.38、-0.34,P均<0.05),而与T、LH、SHBG、FAI、DHEAS及HOMA -IR 无明显相关性(r分别=-0.09、-0.32、-0.28、0.11、0.22、-0.02,P均>0.05)。
3 讨论
PCOS是一种内分泌紊乱和代谢障碍综合征,常表现为糖代谢异常和不同程度的胰岛素抵抗。GLP-1可通过抑制胰腺α细胞分泌胰高血糖素并增加β 细胞数量刺激胰岛素分泌而发挥作用[13],与IR密切相关。本研究结果显示PCOS 患者空腹血浆中GLP-1浓度明显高于正常健康妇女,与Lin等[14]研究结果一致,进一步分析后发现肥胖型PCOS 患者血清中GLP-1 浓度明显高于非肥胖型PCOS 患者,且血清GLP-1 水平与BMI 具有较高相关性,故研究PCOS 患者GLP-1分泌特点,分析其与IR 代谢紊乱的相关性,将有助于研发新型PCOS 针对性治疗药物。
本次研究结果显示,PCOS 患者血清中T、LH、LH/FSH、FAI、DHEAS、LDL-C 和HOMA-IR 较健康人群明显升高,SHBG 水平明显降低,提示高雄激素水平是PCOS 最主要的内分泌特征,与以往报道一致[2]。空腹状态下,PCOS 患者HOMA-IR 指数明显升高,且肥胖型PCOS 患者HOMA-IR 指数明显高于非肥胖型PCOS 患者,提示脂肪组织在PCOS 胰岛素抵抗中可能发挥一定作用。
据文献报道,GLP-1 可诱导血浆中LH 浓度增加[15~17],在雄性大鼠第三脑室内以单剂量注射GLP-1可导致血浆中LH浓度迅速升高[17],本次研究结果显示,PCOS 组血清LH 和GLP-1 浓度水平均明显高于健康对照组,且血清GLP-1 水平与LH/FSH 具有明显相关性,故PCOS 中血浆LH 浓度升高可能由GLP-1水平升高引起。
本次研究结果发现PCOS 患者血清LDL-C 和HOMA-IR 水平明显高于对照组,且肥胖型PCOS 患者TC、TG、LDL-C 和HOMA-IR 水平更高,与非肥胖型PCOS 患者具有显著差异,该结果与Chen 等[18]报道的PCOS 患者具有41.5%的血脂异常发生率相吻合,提示PCOS 患者存在脂代谢异常,且肥胖型PCOS 患者存在更严重的脂代谢紊乱,故肥胖型PCOS患者更易同时患有生殖疾病和代谢疾病,控制PCOS患者体重在预防糖尿病、代谢疾病等并发症方面可能具有重要意义。但本次研究仍存在局限性,如PCOS 患者受试人数较少,在后续研究中建议扩大样本量进一步评估GLP-1 与PCOS 患者中脂类代谢异常和激素紊乱之间的关系,为PCOS 的治疗提供理论依据。

