QuEChERS-HILIC-MS/MS测定禽蛋中利巴韦林及其代谢物残留量
余鹏飞,赵月钧,杨鲁琼,洪琳,董叶箐,何晓明*
绿城农科检测技术有限公司(杭州 310052)
利巴韦林(Ribavirin)是一种人工合成的广谱类抗病毒药物[1],其主要的作用是在生物体内抑制单磷酸次黄嘌呤核苷转变成乌苷酸,阻碍多种病毒核酸的合成,因此具有抗病毒作用[2]。利巴韦林目前大范围应用在人类流感疾病、丙型肝炎[3-4]及畜禽疫病的防治中[1,5]。但根据研究表明,利巴韦林具有一定的毒副作用,长期摄入该药物会使人体产生不同程度的耐药性,从而诱使新型耐药病毒的产生[6]。另外,利巴韦林可以通过食物链进入人体内,长期积累会损害人体脏器及血管[7],对人体造成危害,因此,该类药物被美国FDA和我国农业部列为禁用兽药。虽然早在2005年我国农业部发布的第560号公告[8]中明确规定该类药物禁止使用在养殖业中,但鉴于我国的养殖现状,违规使用该类药物的情况还是时有发生,特别是2019年国家市场监督管理局在2月1日发布的食品安全监督抽查计划通知中新增了利巴韦林参数的检测。为了监管的需要,建立一种准确、快速、灵敏、高效检测利巴韦林及其代谢物的检测方法是有必要的。
目前利巴韦林原药的检测方法主要有高效液相色谱(HPLC)法[9]、液相色谱串联质谱(HPLC-MS/MS)法[10-13]、放射免疫(RIA)法、毛细管电泳(HPCE)法[14]、紫外分光光度法[15]等。其中,液相色谱-质谱/质谱法以其特异性强、灵敏度高、效率高和重现性好的特点,成为目前兽药检测首选方法。研究表明,利巴韦林在蛋鸡等禽类中代谢较快,其主要代谢物为1, 2, 4-三氮-3-甲酰胺(TCONH2)和1-β-D-呋喃基核糖-三氮唑-3-羧酸(RTCOOH)[16-17],现有的国家检测标准都是通过磷酸酯酶的水解作用将利巴韦林代谢物水解成利巴韦林原药之后经三氯乙酸-乙腈混合溶液提取、苯硼酸基弱阳离子(PBA)固相萃取柱净化后使用液相色谱串联质谱仪进行检测[18-19]。然而该方法整个过程繁琐,需要配制大量不同pH的溶液,耗时较长,且成熟的PBA固相萃取柱的价格成本较高,不利于大批量检测利巴韦林样品。此次试验省去酶解的过程,不需将利巴韦林代谢物水解成原药,而通过直接提取禽蛋中的利巴韦林与其主要代谢物,然后利用QuEChERS法[20-23]净化后利用液相色谱-质谱/质谱仪进行定量检测。该方法操作简单、耗时短、成本低、回收率及其稳定性好,能够满足日常检测。
1 试验部分
1.1 材料与试剂
利巴韦林(CAS No.36791-04-5,纯度98.6%,美国CATO公司);三氮唑核苷羧酸TCONH2(CAS No.39925-19-4,纯度95.1%,加拿大TRC公司);1,2, 4-三氮唑-3-甲酰胺RTCOOH(CAS No.3641-08-5,纯度99.4%,德国CNW公司);利巴韦林-13C5(CAS No.1646818-35-0,纯度98.1%,加拿大TRC公司);甲酸(色谱纯,阿拉丁);乙腈(色谱纯,美国Thermo公司);甲醇(色谱纯,美国Thermo公司);无水NaSO4(分析纯,上海凌峰);粒径0.037~0.120 mm石墨化碳黑粉末(Graphitized carbon black,德国CNW公司,下缩写GCB表示);40~60 μm C18(艾杰尔);QuEChERS净化盐包(2 g无水NaSO4、100 mg GCB和50 mg C18,实验室自制);实验室用水为一级水;其余试剂均为分析纯(上海凌峰化学试剂有限公司);0.22 μm尼龙滤膜(艾杰尔)。
1.2 仪器与设备
液相色谱三重四极杆-质谱/质谱仪(LC-MS 8050,日本Shimadzu公司);超声波清洗器(KQ-500E,昆山市超声仪器有限公司);超纯水机(Milli-Q,美国Millipore公司);多管涡旋混合仪(DMT-2500,杭州米欧仪器有限公司);氮吹仪(RayKol AutoEVA-60,睿科);离心机(Micro 17R美国Thermo公司)。
1.3 试验方法
1.3.1 标准溶液配制
准确称取适量的标准品,用甲醇分别配制质量浓度为100 mg/L的标准储备液,于-18 ℃冰箱避光保存。
1.3.2 样品处理
准确称取5 g(精确至0.01 g)经过混匀的禽蛋样品于50 mL聚四氟乙烯离心管中,加入100 μL 50 μ g/L利巴韦林-13C5同位素内标,再加入10 mL乙腈,以2 500r/min涡旋振荡混匀,超声提取15 min。以4 000 r/min离心5 min,将上清液至另一50 mL离心管中,残渣再用10 mL乙腈重复提取一次,合并上清液。
在上清液中加入QuEChERS净化盐包进行净化,以8 000 r/min离心3 min,取10 mL上清液氮吹至近干,加1 mL水复溶,涡旋1 min,超声3 min,再加入1 mL水饱和正己烷去脂,以10 000 r/min离心3 min,取下层清液过0.22 μm滤膜后待测。
1.3.3 仪器条件
1.3.3.1 色谱条件
色谱柱,ZIC@-HILIC(150 mm×4.6 mm,3.5μm);进样量,5 μL;柱温,40 ℃;流动相:A为0.2%甲酸5 mmol乙酸铵水溶液,B为0.2%甲酸乙腈溶液;流速为0.6 mL/min;采用梯度洗脱的分离程序,洗脱程序见表1。

表1 洗脱程序
1.3.3.2 质谱条件
电喷雾离子源:正离子模式(ESI+);加热块温度400 ℃,毛细管电压4 000 V;雾化气流量3.0 L/min;干燥气流量10.0 L/min;加热气流量10.0 L/min;定性与定量离子对、碰撞能量等参数见表2。
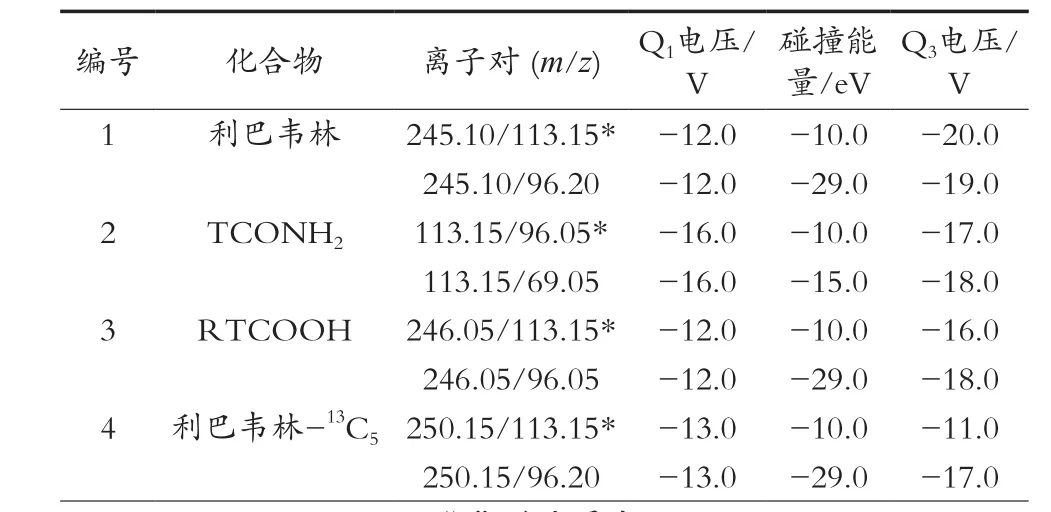
表2 利巴韦林、TCONH2、RTCOOH、利巴韦林-13C5质谱参数
2 结果与分析
2.1 提取试剂的选择
利巴韦林及其代谢物属于强极性物质,分子结构中存在酰胺基、羟基等基团,易溶于水、甲醇、乙腈等试剂中。目前,在非衍生的方法中用于利巴韦林的提取试剂主要有0.1%甲酸乙腈水溶液(1∶9,V/V)、乙腈-水(9∶1,V/V)、0.1%甲酸20 mmol/L甲酸铵水溶液-甲醇(9∶1,V/V)。由于试验采用QuEChERS法,考虑到提取完之后需要进行浓缩以保证方法的定量限满足检测需求,需要去除提取液中的水,所以提取试剂中不能含有较多的水分。试验比较了乙腈、乙腈-水(9∶1,V/V)、甲醇、0.1%甲酸20 mmol/L甲酸铵-甲醇(1∶9,V/V)、乙酸乙酯5种提取剂的提取效果。
图1表明,乙腈和乙腈-水(9∶1,V/V)对于目标物的提取效果较好且效果相近。甲醇相对于乙腈更容易提取出蛋液中利巴韦林及其代谢物相对分子质量相同的核苷类似物,影响目标物质在仪器中的响应;乙酸乙酯的提取效率最低,可能是因为利巴韦林及其代谢物易溶于水中,导致乙酸乙酯不易提取目标物。考虑到禽蛋中已经含有大量的水分,为方便净化环节去除提取液中的水分,故选择乙腈作为最终的提取试剂。

图1 不同提取试剂的提取效率
2.2 QuEChERS净化盐包的成分选择
目前,利巴韦林及其代谢物测定方法中大多采用固相萃取技术(SPE)[24]进行净化,用到的固相萃取柱有MCX柱、NH2柱、PBA柱、HLB柱等,国标方法、地方标准中[18-19]中使用的是PBA柱,然而PBA固相萃取柱成本较高,会大幅增加试验成本。试验借鉴QuEChERS的原理,结合HPLC-MS/MS高灵敏度、高抗干扰性的优点,使用净化盐包对提取液进行直接净化,而不采用固相萃取柱。试验考察了目前检测中最常用的3种基质固相分散剂PSA(N-丙基乙二胺固相吸附剂)、C18和GCB对利巴韦林及其主要代谢物回收率的影响。
图2表明,PSA对于目标物具有较大的吸附能力,C18和GCB对于目标物的吸附较小。PSA的化学结构中含有两个氨基,其pKa为10.26±0.19,对于有机酸具有较强的吸附能力,而利巴韦林及其代谢物均呈酸性,易被PSA吸附,从而影响目标物质的回收率,因此选择C18和GCB作为吸附剂。另外,为了缩短浓缩时间,在浓缩环节前加除水步骤,试验考察了无水硫酸镁和无水硫酸钠,两者之间的差距不大,但无水硫酸钠价格相对低廉,因此选择无水硫酸钠作为净化盐包中的除水剂。无水硫酸钠的使用量可根据样品的含水量进行适当增减。

图2 不同净化剂对回收率的影响
2.3 色谱条件优化
利巴韦林分子结构中含有呋喃糖环和1个酰胺基团,见图3,属于强极性物质,在常规的C18柱上很难进行保留。亲水作用色谱(HILIC)对于分离强极性化合物具有较好的作用。试验考察了Agilent HILIC Plus、Waters BEH HILIC色谱柱和ZIC@-HILIC三款HILIC柱,结果表明单纯的HILIC(Agilent HILIC Plus、Waters BEH HILIC)色谱柱不能将利巴韦林保留,需要使用带有酰胺基基团的HILIC色谱柱才能保留物质且能够达到分离目标物质、重现性好的目的。最终选择ZIC@-HILIC作为试验所使用的色谱柱。另外,试验比较了0.1%甲酸水-0.1%甲酸乙腈和0.2%甲酸5 mmol/L乙酸铵溶液-0.2%甲酸乙腈两种流动相体系对目标物的分离、峰型。结果表明,0.1%甲酸5 mmol/L乙酸铵溶液-0.1%甲酸乙腈效果的峰型及分离效果好,而不加盐,目标峰较宽,且很难将目标物与杂质分离。可能是HILIC色谱柱在酸性及低缓冲盐的环境中性能更好。因此选择0.2%甲酸5 mmol/L乙酸铵溶液-0.2%甲酸乙腈体系作为最终流动相。

图3 利巴韦林结构图
2.4 特异性考察
利巴韦林是一种核苷类似物,在鸡蛋等禽蛋中大量存在与利巴韦林及其代谢物相对分子质量相同的核苷类似物(尿苷,MW=244.2)[25],该杂质与目标物的特征碎片离子完全一致。目前的净化方法无法将该杂质去除掉,因此只能通过改变色谱方法达到将两者分离的目的。从图4可以看到,利巴韦林、TCONH2、RTCOOH出峰时间分别为7.794,5.834和4.762 min,内源性物质尿苷出峰时间为7.598 min。根据色谱分析中关于分离度的规定,分离度R>1.5即可认为两者分离,从图4可以看出利巴韦林与尿苷的分离度R>1.5,满足规定要求。
2.5 基质效应
基质效应在质谱分析中普遍存在,共流出干扰物会对目标物的电离过程产生离子抑制或增强效应,可能会对定量结果产生较大的影响。试验采用先提取后添加法,测定鸡蛋空白基质提取液与纯溶剂中同浓度目标化合物的响应值,通过两者的比值来评价基质效应(ME)。若ME<0.8,说明基质对目标物产生较强的抑制作用;ME>1.2,则说明有较强的增强作用;0.8<ME<1.2,表明基质效应可以忽略。结果表明,该方法在禽蛋中基质效应不明显,见表3,说明在QuEChERS净化盐包能有效地去除脂肪等大分子物质,减弱基质效应。试验还参照国家标准采用利巴韦林-13C5作为内标进行校正,因此无须使用基质匹配的标准曲线进行测定,从而提高该方法在日常检测中的效率。
2.6 方法学验证
2.6.1 线性范围、检出限及定量限
用水配制6个不同浓度的混合标准溶液,使利的巴韦林及其代谢物的质量浓度分别为2,5,10,25,50和100 μg/L,利巴韦林-13C5的质量浓度为25 μ g/L。以标样质量浓度(X,μg/L)为横坐标,目标化合物响应值与内标物响应值的比值(Y)为纵坐标,绘制标准曲线。由表3可知,目标化合物在2.00~100 μg/L范围内线性相关性良好,相关系数均>0.999。根据检出限为3倍信噪比、定量限为10倍信噪比的计算方法,利巴韦林及其代谢物的检出限为0.146~0.763 μg/kg,定量限为0.438~2.26 μg/kg。
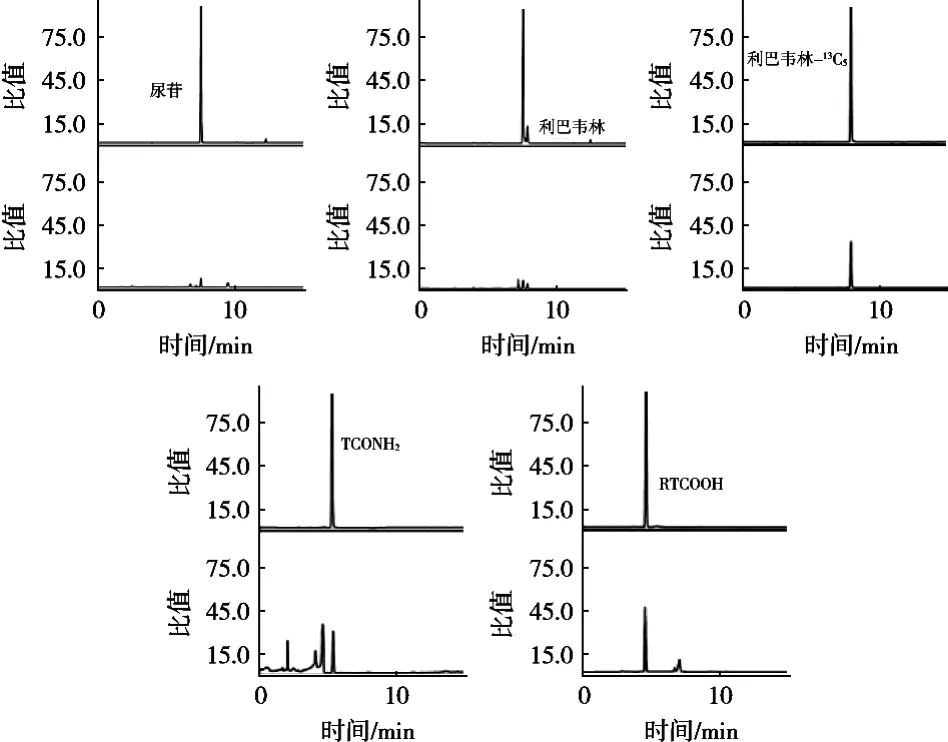
图4 利巴韦林及其代谢物、同位素、干扰物图谱

表3 利巴韦林及其代谢物基质效应、线性方程、相关系数、检出限、定量限
2.6.2 加标回收试验
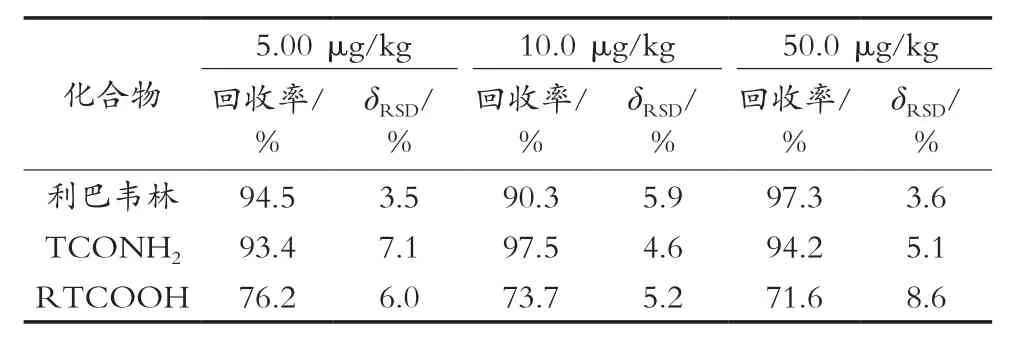
表4 精密度和回收率测定结果
在空白禽蛋样品中分别添加三水平的混合标准溶液,每个水平测定6次,计算平均回收率及相对标准偏差。表4表明,利巴韦林及其代谢物的平均加标回收率范围为71.6%~97.3%,相对标准偏差(δRSD)为3.5%~8.6%,符合兽药残留测定的要求。
3 结论
基于QuEChERS法提取净化,结合HILIC-MS/MS,建立测定禽蛋中利巴韦林及其代谢物的方法,对提取试剂、净化盐包的成分、色谱柱、流动相体系进行了优化。该方法操作简单快速,精密度和准确性较好,成本低,可用于大批量禽蛋样品中利巴韦林及其代谢物的快速筛查。
4 展望
目前该方法的前处理过程结合了QuEChERS法,提高了处理效率的同时降低了成本,但限于实验室的现状,无法对色谱柱进行进一步的优化,后续可以考虑试验粒径、直径更小、长度更短的HILIC色谱柱,以达到缩短进样时间、提高进样效率的目的。

