老年营养风险指数在老年胃肠肿瘤围术期的应用
李 梅,邱文才,高 琦,杨 俊,贾震易
(上海交通大学附属第六人民医院胃肠外科,上海 200233)
营养不良是老年住院病人常见的合并症之一。研究显示,存在营养不良的老人住院期间死亡率、并发症发生率、住院时间及住院费用均高于无营养不良病人[1-2]。老年营养风险指数(geriatric nutritional risk index,GNRI)是美国肠外肠内营养学会(ASPEN)推荐用于老年住院病人营养风险筛查的工具之一。Bouillanne等[3]的研究显示,GNRI可较准确地预测内科住院老年病人的发病率和死亡率。外科领域的研究发现,GNRI可预测老年胰腺肿瘤病人早期死亡率和食管肿瘤术后并发症[4-5]。为进一步验证其临床价值,本研究分析老年胃肠肿瘤病人围术期GNRI的应用,研究其对术前营养支持合理实施的参考作用。
资料与方法
一、一般资料
采用连续抽样方法,收集2019年4月至2019年8月在我院外一病区行胃肠肿瘤手术老年病人(≥60岁)的病例资料,排除急诊手术、经肛门局部切除及肿瘤姑息性手术的病例。共纳入150例,其中男 86 例,女 64 例,平均年龄为(68.83±7.84)(60~95)岁,其中≥70岁有56例。
二、营养筛查
病人入院后24 h内应用GNRI完成老年营养风险状况筛查。GNRI=[1.489×白蛋白(g/L)]/[41.7×(实际体重/理想体重)]。理想体重根据洛伦兹方程计算:男性为身高-100-[(身高-150)/4],女性为身高-100-[(身高-150)/2.5]。如果实际体重超过理想体重,则将实际体重/理想体重设置为1。GNRI≤98定义为存在老年营养风险[3]。同时应用通用型工具营养风险筛查2002(nutritional risk screening 2002,NRS 2002)。当NRS 2002≥3定义为有营养风险。
三、研究内容
(1)基线资料:年龄、性别、疾病种类(胃肿瘤、结肠直肠肿瘤或小肠肿瘤)、体质量指数(body mass index,BMI)、血清白蛋白、手术时间及手术方式(是否腹腔镜手术)。
(2)术前营养支持:定义为术前持续营养治疗≥3 d,达到每日营养需求目标量80%以上。营养需求目标量:热能 104.5 kJ/(kg·d),蛋白质 1.2 g/(kg·d)。
(3)临床结局指标:包括术后住院时间、术后并发症发生率。并发症按照Clavien-Dindo标准[6]判断。
四、统计学分析
应用SPSS 22.0软件进行分析。计量资料以均数±标准差表示,采用t检验。计数资料以频数(构成比)表示,采用卡方检验或Fisher精确检验。应用麦克尼马(McNemar)检验对GNRI和NRS 2002评价的营养风险进行差异分析,并应用Kappa检验分析其一致性。均采用双侧检验。P<0.05为差异有统计学意义。
结 果
一、营养筛查
采用GNRI评价的老年营养风险发生率为60.00%(90/150),采用 NRS 2002 评价的营养风险发生率为40.67%(61/150),两者评价的营养风险发生率显著不同(P=0.001)(见表 1)。一致性检验提示Kappa 值为 0.062(P=0.415)。对于≥70 岁的病人,老年营养风险发生率为66.07%(37/56);而营养风险发生率为 100%(56/56)(见表 2)。
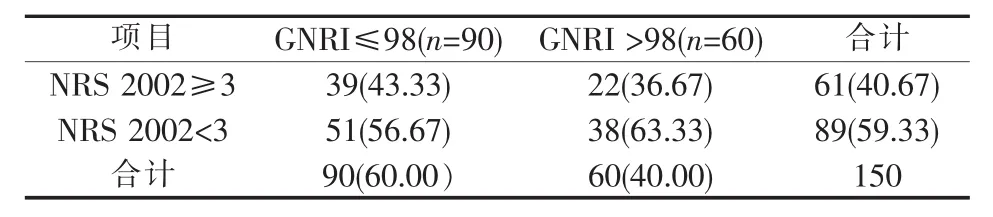
表1 采用GNRI评价的老年营养风险与NRS 2002评价的营养风险对比[n(%)]

表2 ≥70岁病人采用GNRI评价的老年营养风险与NRS 2002评价的营养风险对比[n(%)]
二、基线资料
(1)有老年营养风险病人的平均年龄明显高于无老年营养风险者[(70.06±8.65)岁比(66.98±6.03)岁,P=0.017 8]。有老年营养风险病人的BMI和血清白蛋白水平显著低于无老年营养风险者[(22.76±3.58)比(24.15±2.85),P=0.012 8;(33.00±4.07)g/L 比(41.92±2.80)g/L,P<0.000 1]。两组的性别、疾病种类、手术时间、手术方式及术前营养支持率和类型差异均无统计学意义(见表3)。
(2)有营养风险病人的平均年龄明显高于无营养风险者[(76.30±6.80)岁比(63.70±2.75)岁,P<0.000 1]。有营养风险病人的血清白蛋白水平则显著低于无营养风险者[(35.13±6.00)g/L 比(37.55±5.25)g/L,P=0.010 7]。有营养风险者术前营养支持率明显高于无营养风险者[63.93%(39/61)比 41.57%(37/89),P=0.007]。两组的性别、疾病种类、手术时间、手术方式差异均无统计学意义(见表3)。
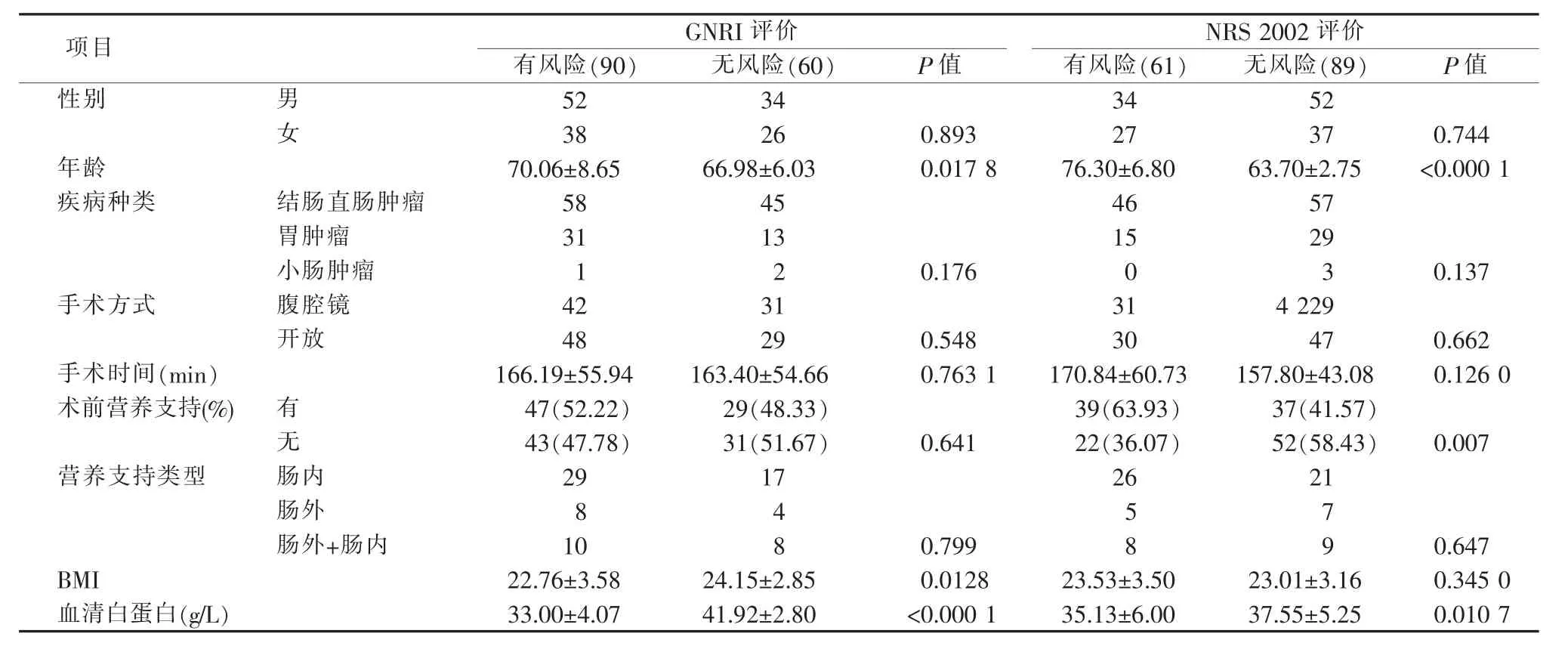
表3 基线资料比较
三、营养风险与临床结局
有老年营养风险者术后并发症发生率和术后住院时间分别为 13.33%(12/90)和(10.37±4.66) d,与无老年营养风险者 23.33%(14/60) 和(11.80±6.36) d 相比,差异无统计学意义(P>0.05)。有营养风险者术后并发症发生率和术后住院时间分别为13.11%(8/61)和(10.56±4.58)d,与无营养风险者的20.22%(18/89)和(11.20±5.95)d 相比,差异亦无统计学意义(P>0.05)(见表 4)。
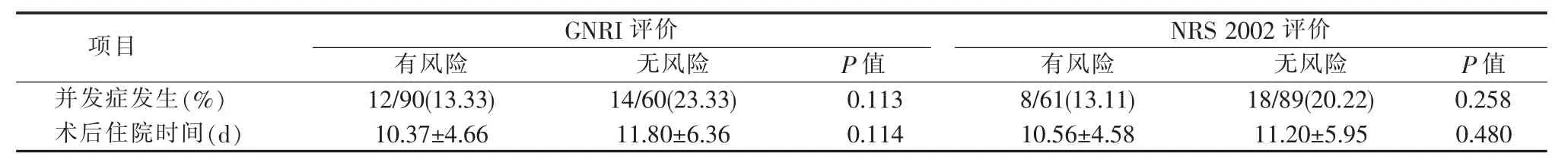
表4 老年营养风险/营养风险与临床结局
四、术前营养支持与临床结局
有老年营养风险的病人中,接受术前营养支持者的术后并发症发生率和术后住院时间分别为6.38%(3/47)和(8.85±2.58) d,显著低于未接受术前营养支持者的 20.93%(9/43) 和(12.02±5.78) d(P<0.05)。无老年营养风险的病人中,接受术前营养支持病人的术后并发症发生率和术后住院时间与未接受术前营养支持者差异无统计学意义(P>0.05)(见表5)。有营养风险的病人中,接受术前营养支持者的术后并发症发生率和术后住院时间与未接受术前营养支持者差异无统计学意义(P>0.05)。无营养风险病人中,接受营养支持者的术后并发症发生率和术后住院时间与未接受术前营养支持者差异亦无统计学意义(P>0.05)(见表 6)。
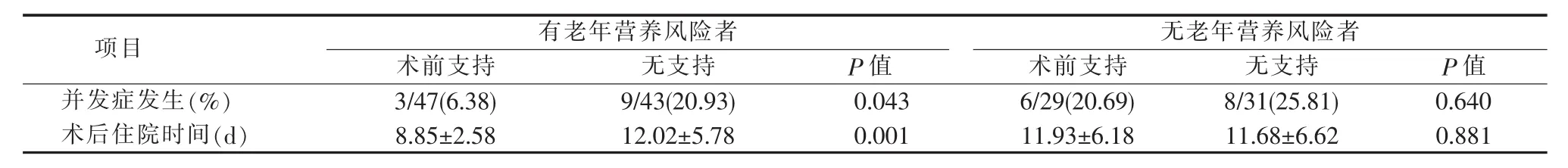
表5 术前营养支持对有无老年营养风险病人临床结局的的影响

表6 术前营养支持对有无营养风险病人临床结局的的影响
讨 论
GNRI通过采集血清白蛋白、身高和体重的数据并计算出具体的数值来评价老年病人的营养风险,其易于计算和解释,减少水化状态对营养状况评价的干扰[3]。本研究结果显示,GNRI评价的老年营养风险与目前临床通用的NRS 2002评价的营养风险并不一致。总体上,采用GNRI评价的老年营养风险发生率高于采用NRS 2002评价的营养风险,但对于≥70岁的病人则低于NRS 2002。笔者认为,对于老年人群,由于存在年龄加分项,NRS 2002评分一般均≥3分,无法区别实际存在的个体差异。此时,采用GNRI评价的老年营养风险可在一定程度上作补充和判断。
围术期营养风险的意义不仅在于评估病人的营养状态,也可预测营养相关的不良结局。国内、外已有研究显示GNRI与病人临床结局存在相关性。笔者[7]基于全美外科数据库的回顾性队列研究显示,GNRI评价的老年营养风险是老年急诊外科术后死亡率和并发症升高的独立危险因素。栗志磊等[8]研究发现,老年肝癌病人术后并发症发生组的GNRI明显低于无并发症发生组[(97.32±7.65)比(102.02±6.71),P<0.05]。当 GNRI<94.36 时,老年肝癌病人术后出现严重并发症的机会大幅升高。胡思聘等[9]评估术前GNRI评分是否可作为胰十二指肠切除术后胰腺导管腺癌病人预后的评价指标。结果显示,GNRI与病人总体生存率显著关联(P=0.009)。此外,还有研究比较GNRI与微型营养评估(mini nutrition assessment,MNA)两种评价老年病人营养状况的方法。结果显示,GNRI在对住院老年病人的营养状况进行分类和识别营养相关并发症发生方面优于MNA[10]。本研究发现,有老年营养风险和营养风险病人的术后并发症发生和术后住院时间均低于无老年营养风险或无营养风险者,但未表现出统计学差异。这可能与本研究样本量较小有关。另外从基线数据分析,有老年营养风险和营养风险病人术前营养支持率相对较高,也是原因之一。
采用NRS 2002评价的营养风险可作为术前营养支持的参考依据,已被指南推荐[11-12],但该标准对于特定的老年病人群体研究尚少。GNRI是否可作为术前营养治疗启动的参考依据,尚无研究报道。本研究对此作了初步观察。结果显示,采用GNRI评价的老年营养风险病人术前营养支持可显著降低术后并发症发生,并缩短术后住院时间;对于无老年营养风险的病人,术前营养支持则不能改善这两项结局。采用NRS 2002评价的营养风险病人和非营养风险病人术前营养支持均不能显著降低术后并发症发生和缩短术后住院时间。本研究结果提示,对于老年胃肠肿瘤病人,以GNRI评价的老年营养风险作为术前营养启动的参考指标,可能优于NRS 2002。
综上所述,GNRI作为评价老年营养风险的方法之一,简单易行。对于≥70岁病人,GNRI较通用型营养风险工具NRS 2002能更好地判断营养状况。在老年胃肠肿瘤病人围术期,GNRI可单独或与NRS 2002联合应用。此外,鉴于老年营养风险评分对于术前营养治疗启动有一定的参考作用,今后可通过更大样本和更多病种的临床研究,进一步验证GNRI的临床应用价值。

