miR-3174在直肠癌组织中的表达水平及意义
史文超 唐 强 包增涛 高善廷
目前,结直肠癌是全球范围内发病率居第3位的恶性肿瘤,也是肿瘤相关死亡的第4大原因[1]。结直肠癌患者中约有30%为直肠癌患者[2]。近年来随着新的诊疗方法的发展,直肠癌的发病率和病死率均有所降低,但情况仍不容乐观[3]。目前,根治性手术切除是治疗直肠癌的主要方法,但术后仍有40%~50%的直肠癌会复发或转移,最终导致患者死亡[4]。探寻用于直肠癌预后评估的生物标志物是目前的研究热点。微RNA(miRNA)是一种由20~22个核苷酸组成的、不具备编码蛋白质功能的RNA[5]。有多项研究表明,miRNA可通过调控细胞增殖、迁移、自噬及凋亡等过程参与疾病的发生、发展,并且有部分miRNA可预测病情及患者预后情况[6-7]。有报道指出,miR-3174可参与胃癌的发病,其可靶向Rho GTP酶激活蛋白10,调控胃癌细胞凋亡和自噬性细胞死亡[8]。此外,有研究表明miR-3174可靶向蝶呤-4α-甲醇胺脱水酶2,加速直肠癌细胞周期进程,并抑制直肠癌细胞凋亡[9]。目前关于miR-3174与直肠癌患者的临床病理学特征及预后关系的报道较少,本文对此展开研究,以期为直肠癌患者的预后评估提供参考。
1 资料与方法
1.1 一般资料
选取2013年3月至2018年2月在连云港市第一人民医院确诊的86例直肠癌患者作为研究对象。纳入标准:(1)病理确诊为直肠腺癌;(2)直肠癌组织和匹配的癌旁组织(距离肿瘤边缘5 cm)标本均保存完好;(3)能够配合完成随访;(4)签署了知情同意书;(5)术后接受辅助化学治疗(FOLFOX方案)。排除标准:(1)随访3个月内死亡;(2)取病理组织前接受过抗肿瘤治疗;(3)临床信息不完整。86例直肠癌患者中男性57例,女性29例;年龄36~73岁,平均年龄为(58.42±9.26)岁;肿瘤直径≤5 cm者35例,>5 cm者51例;TNM分期为Ⅰ~Ⅱ期有48例,Ⅲ期有38例;分化程度为低分化者10例,中、高分化者76例;有淋巴结转移者38例;浸润深度为T1+T2者37例,T3+T4者49例。
1.2 直肠癌组织中miR-3174的表达水平检测
采用实时荧光定量PCR法检测直肠癌组织和癌旁组织中miR-3174的表达水平[10]。步骤如下:(1)应用总RNA提取试剂盒提取各组中的总RNA,使用紫外分光光度计检测其纯度;(2)使用反转录试剂盒对提取的总RNA进行反转录反应,生成cDNA;(3)使用PCR扩增仪进行扩增反应,扩增条件为95 ℃ 10 min预变性,之后95 ℃ 45 s,60 ℃ 45 s,72 ℃ 45 s,共40个循环。以GAPDH为内参,采用2-ΔΔCt表示直肠组织中miR-3174的相对表达量。引物序列见表1。

表1 引物序列
1.4 预后随访
采用电话随访及复诊方式了解患者的生存情况。患者出院后1周开始随访,每月随访1次,了解其生存、复发及转移等情况,随访终点为患者死亡或末次随访时间(2019年12月5日)。中位随访时间为60个月(14~60个月)。
1.5 统计学分析
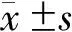
2 结果
2.1 miR-3174在直肠癌组织和癌旁组织中的表达水平
miR-3174在直肠癌组织中的相对表达量为1.04±0.13,高于癌旁组织(0.23±0.05),差异有统计学意义(t=52.231,P<0.001)。见图1。

图1 miR-3174在直肠癌组织和癌旁组织中的表达水平
2.2 miR-3174与直肠癌患者临床病理学特征的关系
以miR-3174在直肠癌组织中表达的中位水平(1.04)为界值,将患者分为高表达组和低表达组。结果显示,miR-3174的表达水平与直肠癌患者的肿瘤大小、TNM分期、淋巴结转移和浸润深度有关(P<0.05),而与年龄、性别、分化程度无关(P>0.05)。见表2。

表2 miR-3174与直肠癌患者临床病理学特征的关系/例(%)
2.3 miR-3174预测直肠癌患者预后的价值
随访显示miR-3174高表达组生存率为40.91%(18/44),低于低表达组[76.19%(32/42)],差异有统计学意义(χ2=9.589,P=0.002)。miR-3174高表达组的平均生存时间为43.14(95%CI:37.80~48.48)个月,低于低表达组[52.64(95%CI:48.36~56.92)个月],差异有统计学意义(P=0.001)。见图2。
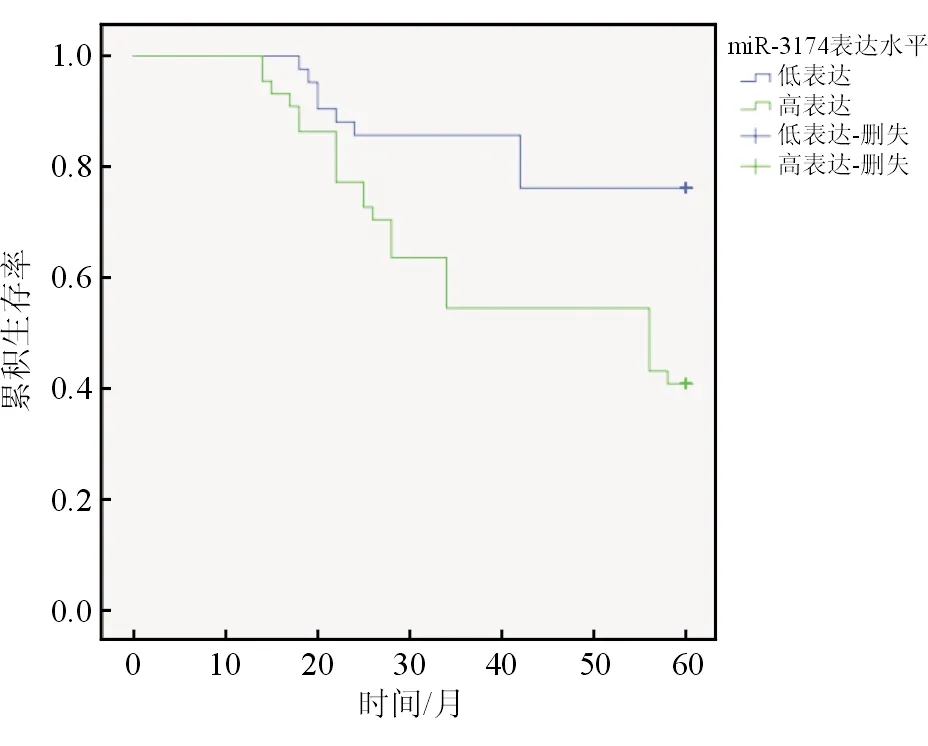
图2 miR-3174表达水平与直肠癌患者预后的生存曲线
将直肠癌患者的预后情况作为因变量,将年龄、性别、肿瘤大小、TNM分期、分化程度、淋巴结转移、浸润深度和miR-3174表达水平作为自变量纳入Cox单因素分析,结果显示TNM分期、淋巴结转移、浸润深度和miR-3174表达水平与直肠癌患者的预后有关(P<0.05)。按照纳入标准α≤0.1,将可能影响直肠癌患者预后的因素,包括TNM分期、淋巴结转移、浸润深度和miR-3174表达水平纳入Cox多因素分析,结果显示TNM分期和miR-3174表达水平与直肠癌患者的预后密切相关(P<0.05)。见表3。
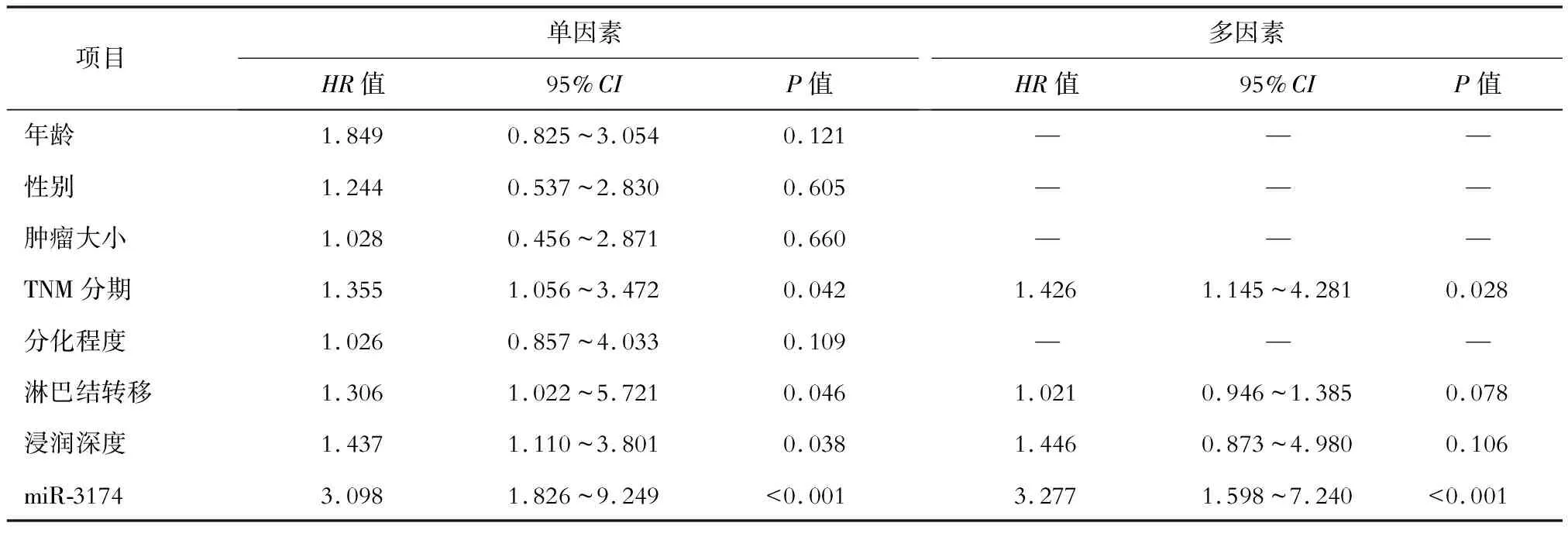
表3 直肠癌患者预后的Cox回归分析
3 讨论
全球每年约有100万人被诊断为直肠癌,预估每年有71.5万人因直肠癌而死亡[11]。虽然部分患者接受了直肠癌根治性切除手术治疗,但仍有约半数复发或转移,严重威胁着患者的生命安全[12-15]。因此,探寻敏感度、特异度均较高的生物标志物用于评估直肠癌患者的预后情况具有重要意义。
miR-3174位于染色体15q26.1上,可在人胃癌组织[8]、直肠癌组织[9]和乳腺癌脑转移组织[16]中特异性表达。目前细胞学实验已证实miR-3174可调控胃癌细胞、直肠癌细胞的凋亡[8-9]。本研究结果指出,直肠癌组织中miR-3174的表达水平高于癌旁组织,提示miR-3174可能参与了直肠癌的发病。本研究进一步比较了miR-3174高表达组和低表达组的临床病理参数,结果显示miR-3174高表达于肿瘤大小>5 cm、TNM分期为Ⅲ期、有淋巴结转移和浸润深度较深的直肠癌组织中,表明其与直肠癌患者的肿瘤大小、TNM分期、淋巴结转移和浸润深度有关,提示miR-3174参与了直肠癌的发病和进展过程。
本研究进一步比较了miR-3174高表达组和低表达组患者的生存情况,结果显示高表达组的生存率和平均生存时间均低于低表达组,提示miR-3174的表达水平与直肠癌患者的预后有关。本研究采用Cox回归方法分析影响直肠癌患者预后的相关因素,结果显示TNM分期和miR-3174与直肠癌患者的预后密切相关。已有多项研究表明TNM分期与直肠癌术后患者的预后密切相关[17-20],与本研究的结果相符。此外,miR-3174的表达水平与直肠癌患者预后有关,推测原因是miR-3174可通过调控蝶呤-4α-甲醇胺脱水酶2抑制直肠癌细胞凋亡[9],增大肿瘤体积,进而影响直肠癌患者的预后,但具体的病理生理机制仍有待进一步研究阐明。
综上所述,miR-3174在直肠癌组织中高表达,且与肿瘤大小、TNM分期、淋巴结转移、浸润深度有关。miR-3174高表达提示直肠癌患者的死亡风险较高。因此,检测直肠癌组织中miR-3174的表达水平有助于评价患者的预后情况。本研究仍存在一定不足,下一步将开展多中心研究,避免因个体差异影响试验结果;同时开展基础性研究,分析miR-3174影响直肠癌预后的病理生理机制。

