miR-448在溃疡性结肠炎组织中的表达水平及意义
罗 鹏 丁 云 刘有理
溃疡性结肠炎(UC)是一种慢性肠道炎性疾病,其发病率呈逐年上升趋势[1]。UC具有病程长、复发率高、并发症多的特点,临床特征常表现为便血、腹痛及高热等[2-3]。随着UC病情进展,患者可出现肠道狭窄、梗阻、穿孔等结构性损伤,严重时可诱发UC相关结直肠癌[4-5]。因此,早期评估UC疾病活动度及预后情况,及时采取有效措施控制病情,对于改善患者预后具有重要意义。目前,临床常通过肠道炎性反应状态评估肠黏膜愈合情况,但存在一定不足。改良Mayo评分及Truelove-Witts分级等临床评分可反映UC患者的主观症状,但有部分缓解期UC患者可能存在持续的黏膜炎性反应[6]。部分常用的生物学标志物受外界因素干扰较大,判断肠道炎性反应状态的特异度较差[7]。结肠镜检查是目前界定UC患者肠道黏膜状况的金标准,但其为侵入性检查,且在评估患者黏膜病变时存在滞后性[8],难以在临床上广泛应用。因此,亟需探寻客观、准确的生物学指标用于判定UC疾病活动度及患者预后情况。核因子-κB(NF-κB)可调节多种参与肠道免疫反应及炎性反应的细胞因子的表达水平,进而参与UC的发生、发展过程[9],而miR-448可通过丝裂原活化蛋白激酶和磷脂酰肌醇3激酶/丝氨酸苏氨酸蛋白激酶途径,诱导NF-κB的活化[10],由此推测miR-448可能与UC的发生、发展存在联系。本研究对miR-448与UC疾病活动度及患者预后的关系进行分析,以期为临床评估提供参考。
1 资料与方法
1.1 一般资料
前瞻性选取2015年7月至2017年7月宣城市人民医院收治的67例UC患者作为研究对象,设为UC组。UC患者均参照《中国炎症性肠病诊断治疗规范的共识意见》[11]中的标准确诊。67例UC患者经结肠镜检查发现,24例处于缓解期,43例处于活动期。纳入标准:(1)首次确诊为UC;(2)入组前未服用免疫抑制剂、非甾体类抗炎药等药物;(3)签署知情同意书。排除标准:(1)伴有恶性肿瘤;(2)伴有全身感染性疾病;(3)伴有中毒性结肠扩张等;(4)妊娠期或哺乳期妇女;(5)随访失联。选取同期在本院行结肠息肉切除术的60例受试者作为对照组。UC组男性40例,女性27例,年龄19~43岁,平均年龄为(28.57±3.19)岁,平均体质量指数(BMI)为(20.69±3.28)kg/m2。对照组男性35例,女性25例,年龄为22~43岁,平均年龄为(29.05±3.37)岁,平均BMI为(21.42±3.15)kg/m2。两组在性别(χ2=0.025,P=0.876)、年龄(t=0.824,P=0.411)、BMI(t=1.276,P=0.204)方面比较,差异均无统计学意义(P均>0.05),具有可比性。本研究获得医院医学伦理委员会批准。
1.2 方法
收集患者的年龄、性别、BMI、吸烟、饮酒、病变范围、肠道损伤、肠切除术史、不典型增生、肛周病变(肛裂、肛周脓肿、肛瘘)、家族史、基底浆细胞增多等资料。67例患者中有13例肛周病变,其中肛裂3例,肝周脓肿6例,肛瘘4例。
抽取受试者入组次日清晨空腹肘静脉血5 mL,室温下4 000 r/min离心10 min,分离上层血清,置于-20 ℃冰箱待测。采用免疫比浊法检测血清C反应蛋白(CRP)表达水平,试剂盒购自南京基蛋生物科技有限公司。采用MC-600Vet全自动血细胞分析仪(购自深圳市库贝尔生物科技股份有限公司)测定血液红细胞沉降率(ESR)、血红蛋白表达水平。采用化学发光免疫分析法检测血清白细胞介素-15(IL-15)表达水平,试剂盒购自北京普朗医疗有限公司。
采用实时荧光定量PCR(real-time PCR)法检测UC患者的miR-448相对表达量,试剂盒购自德国罗氏公司。在无菌条件下取得患者的黏膜组织,30 min内将保存组织的冻存管置于液氮罐中保存。检测时在无菌条件下将UC黏膜组织及结肠息肉组织置于液氮中研磨,之后4 000 r/min离心15 min,分离上层清液置于EP管中,待验。应用TRIzol试剂提取总RNA,紫外分光光度计检测RNA的纯度及浓度。应用核酸蛋白仪和琼脂糖凝胶电泳对提取的RNA进行分析。取2 μL总RNA置于反转录试剂盒中进行反转录反应,合成cDNA。最后用PCR扩增仪进行扩增,反应条件为:94 ℃ 5 min预变性,之后95 ℃ 15 s,60 ℃ 30 s,共40个循环。以GAPDH为内参,采用2-ΔΔCt表示miR-448的相对表达量。引物序列见表1。

表1 引物序列
1.3 UC疾病活动度
采用改良Mayo评分评估UC疾病活动度,主要从排便、便血、内镜及医师总体评价4个方面进行评估[11],评分标准见表2。Mayo评分≤2分且无单个分项评分>1分为缓解期,>2分为活动期,其中3~5分为轻度,6~10分为中度,11~12分为重度。

表2 UC疾病活动度划分
1.4 随访
采用复诊方式对患者进行随访,随访起始时间为2015年7月18日,截止时间为2019年8月6日。记录患者预后情况,本研究将复发、行结肠手术、UC相关黏膜异型增生及UC相关结直肠癌定义为预后不良[12]。复发指经药物治疗进入缓解期后,UC相关症状再次出现,并有实验室炎性指标、内镜检查及影像学检查的疾病活动证据。
1.5 统计学方法
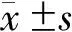
2 结果
2.1 两组miR-448相对表达量比较
UC组miR-448的相对表达量为1.42±0.36,高于对照组(0.81±0.19),两组比较差异有统计学意义(t=11.739,P<0.001)。
2.2 不同病变部位miR-448相对表达量比较
67例患者中病变位于直肠有18例,左半结肠30例,广泛结肠19例。直肠组、左半结肠组和广泛结肠组中miR-448的相对表达量分别为1.38±0.33、1.43±0.35、1.44±0.38,3组比较差异无统计学意义(F=0.163,P=0.855)。
2.3 不同疾病活动度UC患者miR-448相对表达量比较
67例患者中,缓解期24例,活动期43例,其中轻度12例、中度16例、重度15例。缓解期、轻度组、中度组、重度组UC患者miR-448的相对表达量分别为1.11±0.18、1.29±0.21、1.55±0.28、1.88±0.30,4组比较差异有统计学意义(F=34.098,P<0.001)。缓解期miR-448相对表达量低于轻度组、中度组及重度组(q=2.985,P<0.05;q=7.992,P<0.05;q=13.715,P<0.05),轻度组低于中度组及重度组(q=3.991,P<0.05;q=8.931,P<0.05),中度组低于重度组(q=5.383,P<0.05)。
2.4 miR-448与UC患者预后的关系
67例UC患者随访期间预后不良发生率为41.79%(28/67),其中复发23例(34.33%),肠腔狭窄行结肠切除术1例(1.49%),肠梗阻反复发作行肠切除术2例(2.99%),UC相关黏膜异型增生2例(2.99%)。预后不良组miR-448的相对表达量为1.52±0.39,高于预后良好组(1.34±0.31),差异有统计学意义(t=2.103,P=0.039)。miR-448评估UC患者预后的AUC、敏感度、特异度、最大约登指数、最佳截断点分别为0.854(95%CI:0.747~0.929)、75.00%、92.31%、0.673、1.55。见图1。
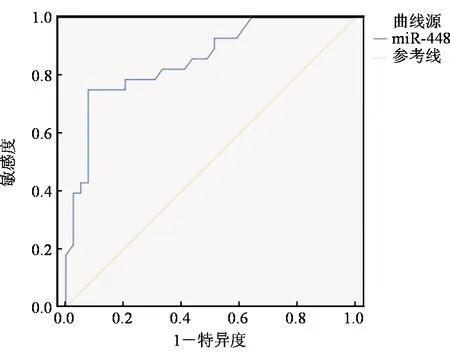
图1 miR-448评估UC患者预后的ROC曲线
2.5 预后不良组与预后良好组的基本资料比较
预后不良组与预后良好组在年龄、性别、BMI、吸烟、饮酒、病变范围、肠道损伤、肠切除术史、不典型增生、CRP、ESR、IL-15、血红蛋白、治疗方案方面比较,差异均无统计学意义(P均>0.05);而在肛周病变、家族史、基底浆细胞增多方面比较,差异均有统计学意义(P均<0.05)。见表3。

表3 预后不良组与预后良好组的基本资料比较
2.6 影响UC患者预后的相关因素
根据miR-448评估UC患者预后的最佳截断点(1.55)将其转换为二分类变量。将肛周病变(无=0,有=1)、家族史(无=0,有=1)、基底浆细胞增多(无=0,有=1)、miR-448(<1.55=0,≥1.55=1)作为自变量,α入=0.05,α出=0.10,将UC患者的预后情况(预后良好=0,预后不良=1)作为因变量纳入多因素Logistic回归模型,结果显示肛周病变、miR-448与UC患者预后密切相关。见表4。
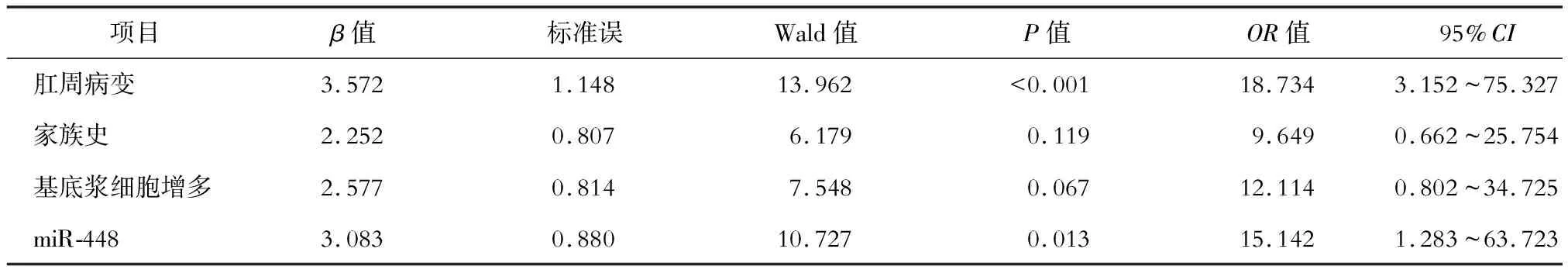
表4 影响UC患者预后的因素
3 讨论
微RNA(miRNA)是由约22个核苷酸组成的内源性非编码RNA,在进化上趋于保守,通过以序列特异性方式结合靶基因的特定区域,从而调节转录后基因的表达[13-14]。近年来研究表明miRNA与多种疾病的病理生理过程密切相关,已成为临床研究的热点[15-16]。miR-448为miRNA家族一员,有研究表明其可参与结直肠癌、心肌病等的发生、发展过程[17-18]。有报道指出,miR-448可诱导NF-κB的活化[10],而NF-κB过表达可诱发肠道免疫性疾病[9]。目前关于miR-448在UC中的表达水平及其与UC疾病活动度、患者预后关系的报道较少。
本研究结果显示,UC患者miR-448相对表达量高于对照组,提示miR-448可能与UC的发生有关。本研究比较了缓解期与活动期患者miR-448的相对表达量,结果显示活动期患者miR-448相对表达量高于缓解期,重度组miR-448相对表达量高于中度组及轻度组,中度组miR-448相对表达量高于轻度组,以上结果提示miR-448与UC疾病活动度可能相关。此外,本研究对UC患者的随访发现,预后不良组患者miR-448相对表达量高于预后良好组,提示检测miR-448相对表达量有助于评估UC患者预后。本研究构建了miR-448评估UC患者预后的ROC曲线,结果显示miR-448评估UC患者预后的AUC大于0.8,提示miR-448评估UC患者预后的效能较高。本研究采用多因素Logistic回归分析影响UC患者预后的相关因素,结果显示肛周病变、miR-448与UC患者预后密切相关,结果与既往研究相符[19-20]。
NF-κB的活性状态与肠道炎性反应密切相关。机体处于稳态时,NF-κB与其抑制因子IκB单体耦联,以无活性复合体形式存在于细胞质中,受到细胞外信号刺激后IκB磷酸化后降解,NF-κB释放并移入核内与靶基因序列上特定的结合位点结合[21],启动或调节肿瘤坏死因子-α及黏附因子-1的基因转录,介导炎性细胞因子的活化、趋化、浸润,参与UC的发生、发展过程[22]。有细胞实验表明,miR-448表达变化可引起双向调节因子及表皮生长因子水平升高,进而介导NF-κB的激活[10]。由此推测,miR-448可能通过诱导NF-κB的活化,参与UC的疾病进展。
综上所述,miR-448与UC疾病活动度及患者预后关系密切,检测miR-448表达水平有助于评估患者预后情况。本研究今后将进一步分析miR-448参与UC疾病活动度及预后的病理生理机制。

