白斑狗鱼StAR基因克隆及其表达分析
张俊杰 李菁 赵瑞阳 古丽帕日·艾克拜





白斑狗魚StAR基因克隆及其表达分析
张俊杰,李 菁,赵瑞阳,古丽帕日·艾克拜
(新疆农业大学生命科学学院,乌鲁木齐 830052)
摘要:【目的】克隆白斑狗鱼(Esox lucius)类固醇激素合成急性调节蛋白(StAR)基因(ElStAR)并分析其组织表达差异,为开展StAR基因生物学功能研究及揭示白斑狗鱼性腺发育机制提供基础资料。【方法】根据GenBank已公布的白斑狗鱼基因组测序结果(NC_047581.1)设计特异性引物,采用RT-PCR克隆ElStAR基因cDNA序列,通过ClustalX、ExPASy、TargetP 1.1、TMHMM 2.0和SignalP 5.0等在线软件进行生物信息学分析,并采用实时荧光定量PCR进行ElStAR基因组织表达定量分析。【结果】ElStAR基因cDNA序列长度1485 bp,其开放阅读框(ORF)为864 bp,共编码287个氨基酸残基;ElStAR氨基酸序列与北极红点鲑StAR氨基酸序列的相似性最高(93.33%),与海鳟、条纹鲈鱼、金头鲷、大菱鲆、斑马鱼、半滑舌鳎的相似性均高于75.00%,而与小家鼠的相似性最低(59.15%);基于StAR氨基酸序列相似性构建的系统发育进化树也显示白斑狗鱼与北极红点鲑和海鳟等鲑科鱼类处于同一分支。ElStAR蛋白相对分子量为32.23 kD,理论等电点(pI)为8.98,为不稳定的亲水性蛋白;具有START结构域,无信号肽及跨膜结构,符合线粒体靶向肽的基本特征。ElStAR蛋白二级结构由α-螺旋(占40.77%)、无规则卷曲(占35.89%)、延伸链(占18.12%)和β-折叠(占5.23%)组成,其三级结构是由α-螺旋配合多个β-折叠卷曲盘旋而成。ElStAR基因在白斑狗鱼精巢、卵巢、头肾、肝脏、肌肉及脑组织中均有不同程度的表达,且在精巢中的相对表达量极显著高于在卵巢中的相对表达量(P<0.01),呈明显的性别二态性表达模式。【结论】ElStAR基因编码蛋白结构和功能十分保守,具有典型的START结构域,对胆固醇的运输和调节起重要作用。ElStAR基因在白斑狗鱼精巢及卵巢中的表达存在极显著差异,可能在维持白斑狗鱼精巢的发育形成中发挥重要作用。
关键词:白斑狗鱼;StAR基因;START结构域;胆固醇;性腺组织
中图分类号: S965.199 文献标志码: A 文章编号:2095-1191(2021)11-3093-09
Cloning and expression analysis of StAR gene in Esox lucius
ZHANG Jun-jie, LI Jing, ZHAO Rui-yang, Gulpari·Akbar
(College of Life Sciences, Xinjiang Agricultural University, Urumqi 830052, China)
Abstract:【Objective】The aim of this study was to clone the steroidal hormone synthesis acute regulatory protein (StAR) gene(ElStAR) and analyze its expression in tissues, so as to provide basic data for studying the biological function of StAR gene and revealing gonadogenesis mechanism of Esox lucius. 【Method】Specific primers were designed based on the genomic sequence of E. lucius in GenBank(NC_047581.1), and the cDNA sequence of ElStAR gene was cloned by RT-PCR. Bioinformatics analysis was carried out by online softwares such as ClustalX,ExPASy,TargetP 1.1,TMHMM 2.0 and SignalP 5.0, and the tissue expression of ElStAR gene was analyzed by real-time fluorescence quantitative PCR. 【Result】The cDNA sequence of ElStAR gene was 1485 bp in length and its open reading frame(ORF) was 864 bp, and encoded 287 amino acids. Amino acid sequence of StAR had the highest similarity with Salvelinus alpinus (93.33%), higher than 75.00% with Salmo trutta, Morone saxatilis, Sparus aurata, Scophthalmus maximus, Danio rerio and Cynoglossus semilaevis, and the lowest similarity with Mus musculus (59.15%). The phylogenetic tree based on StAR amino acid sequence similarity also showed that pike was in the same branch as Salmonidae fish such as Salvelinus alpinus and Salmo trutta. ElStAR protein had a relative molecular weight of 32.23 kD and a theoretical isoelectric point (PI) of 8.98. It was an unstable hydrophilic protein. It had START domain, no signal peptide and transmembrane structure, which was consistent with the basic characteristics of mitochondrial targeting peptide. The secondary structure of ElStAR protein was composed of α- helix (40.77%), random coil (35.89%), extended chain (18.12%) and β- fold (5.23%), and its tertiary structure was composed of α- helix fit multiple β- fold with curling and circling. ElStAR gene was expressed in testis, ovary, head kidney, liver, muscle and brain of E. lucius. The relative expression in testis was extremely significantly higher than that in ovary (P<0.01), and showed the expression pattern of gender dimorphism. 【Conclusion】ElStAR gene encodes a protein with very conservative structure and function, with a typical START domain, and plays an important role in the transportation and regulation of cholesterol. There are extremely significant differences in the expression of ElStAR gene in testis and ovary of E. lucius, the gene may play an important supporting role in maintaining the development and formation of testis of pike.
Key words: Esox lucius; StAR gene; START domain; cholesterol; gonadal tissue
Foundation item:National Natural Science Foundation of China(31660739); Scientific Research Project of the Higher Education Institution of Xinjiang (XJEDU2016I021); College Student Innovation Project of Xinjiang Agricultural University (201910758040)
0 引言
【研究意义】白斑狗鱼(Esox lucius)隶属于鲑形目(Salmoniformes)狗鱼科(Esocidae),广泛分布在世界各大水域(Cejko et al.,2018),在我国主要分布于新疆额尔齐斯河流域(郭焱,2012)。白斑狗鱼摄食范围广,主要以自然水域的中小型鱼类为食,且适宜生存水温范围较广,营养价值高,但其雌雄个体的生长速率存在明显差异(Bry,1996)。因此,研究白斑狗鱼的性别相关基因对实现其单性养殖具有重要意义。【前人研究进展】类固醇激素合成急性调节蛋白(Steroidogenic acute regulatory protein,StAR)是类固醇激素急性调节蛋白相关的脂质转移域家族(START)成员之一,在脊椎动物中对类固醇激素的调节至关重要。StAR蛋白结构主要由α-螺旋和β-折叠组成(Soccio and Breslow,2003),可与疏水胆固醇结合,广泛参与生物体的脂质代谢与转运、生物信号接收传递及调控转录。StAR是一种位于线粒体上的转运蛋白,在类固醇合成时能将胆固醇从线粒体外膜转运至内膜,使胆固醇在酶的作用下发生裂解等系列变化,完成类固醇激素合成过程中至关重要的限速步骤(Stocco and Clark,1996;Tsuchiya et al.,2003)。在脊椎动物中,StAR基因在神经组织、生殖腺及肾上腺组织均有表达(Patchev et al.,2007;Tkachenko et al.,2011;Zempo et al.,2012)。在鱼类中,针对StAR基因的研究主要集中在基因克隆及其组织表达分析等方面,在鳕鱼(Gadus morhua)(Goetz et al.,2004)、虹鳟(Oncorhynchus mykiss)(Nakamura et al.,2005)、细须石首鱼(Micropogonias undulatus)(Nunez and Evans,2007)、青鳉(Oryzias latipes)(Nakamoto et al.,2012)及半滑舌鳎(Cynoglossus semilaevis)(朱颖等,2014)等硬骨鱼类中已有StAR基因的相关研究报道,发现StAR基因主要是在性腺和肾脏中表达,且在精巢和卵巢中的表达存在显著差异。蔡静(2018)研究发现,在尼罗罗非鱼中存在StAR1和StAR2基因,StAR1基因突变会推迟精子发育,StAR2基因突变缺失则导致卵巢体细胞出现雄性化特征,但不会出现性逆转。Shang等(2019)研究证实,斑马鱼(Danio rerio)StAR基因发生突变会导致卵母细胞的性成熟受到阻滞。刘倩等(2020)研究表明,中华鳖(Pelodiscus sinensis)StAR基因在性腺组织中的表达存在明显差异,表现为精巢的相对表达量显著高于卵巢。【本研究切入点】近年来,有关白斑狗鱼的研究主要集中在生物学功能及激素诱导性别发育等方面(Neumann et al.,2011;张俊杰等,2018),其性腺发育早期呈现精巢与卵巢共存现象(李飞等,2018;张俊杰等,2018),但白斑狗鱼的性别分化机制至今尚未明确,关于StAR基因在其性腺发育过程中的研究也鲜见报道。【拟解决的关键问题】通过RT-PCR克隆白斑狗鱼ElStAR基因(ElStAR),运用在线软件进行生物信息学分析,并采用实时荧光定量PCR检测StAR基因在白斑狗鱼不同组织中的表达情况,以期为开展StAR基因生物学功能研究及揭示白斑狗鱼性腺发育机制提供基础资料。
1 材料与方法
1. 1 试验材料
试验用魚为新疆农业大学生命科学学院水产实验室人工繁殖的白斑狗鱼仔鱼,繁殖亲鱼为乌鲁木齐北园春市场的乌伦古湖野生白斑狗鱼。白斑狗鱼仔鱼饲养于新疆农业大学生命科学学院水产实验室,分别在180日龄(体重300±30 g,体长25±3 cm)和320日龄(体重600±30 g,体长52±3 cm)取雌鱼和雄鱼各3尾,剖解后取其性腺、肝脏、头肾、肠道、肾脏、肌肉及鳃等组织装入无菌冻存管中,迅速置于液氮中, -80 ℃保存备用。反转录试剂盒PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)及TaKaRa TaqTM PCR试剂盒购自宝生物工程(大连)有限公司,TRIzol试剂购自Invitrogen公司,实时荧光定量PCR检测试剂盒购自天根生化科技(北京)有限公司。
1. 2 试验方法
1. 2. 1 引物设计与合成 根据GenBank已公布的白斑狗鱼基因组测序结果(NC_047581.1),采用Primer 5.0设计特异性引物StAR-F和StAR-R(表1),用于ElStAR基因扩增。特异性引物委托生工生物工程(上海)股份有限公司合成。
1. 2. 2 总RNA提取及cDNA合成 白斑狗鱼组织经液氮研钵充分研磨后,采用TRIzol法提取总RNA,全程操作在冰上进行,以DEPC处理的ddH2O溶解得到白色沉淀(总RNA),-80 ℃保存备用。采用紫外分光光度计检测总RNA的OD,并以1.0%琼脂糖凝胶电泳检测其完整性。然后按PrimeScriptTM RT reagent Kit with gDNA Eraser反转录试剂盒说明,以500 ng总RNA为模板反转录合成cDNA,-20 ℃保存备用。
1. 2. 3 ElStAR基因克隆 PCR扩增以精巢cDNA为模板(3.0 μL),加入dNTP Mixture(2.5 mmol/L)4.0 μL、10×PCR Buffer 5.0 μL、StAR-F/StAR-R各2.0 μL,TaqTM DNA聚合酶(5 U/μL)0.5 μL,ddH2O补足至50.0 μL。扩增程序:94 ℃预变性5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,进行35个循环;72 ℃延伸10 min,4 ℃终止扩增程序。以1.5%琼脂糖凝胶电泳检测PCR扩增产物,并送至生工生物工程(上海)股份有限公司测序。
1. 2. 4 ElStAR基因生物信息学分析 采用DNAMAN 6.0对测序获得的cDNA序列进行拼接,使用NCBI的ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi)分析ElStAR基因序列的开放阅读框(ORF),推导出对应的氨基酸序列后进行BLAST比对分析,利用ClustalX进行StAR氨基酸序列多重对比分析,并以MEGA 5.1中的邻接法(Neighbor-joining,NJ)构建系统发育进化树;使用ExPASy中的PROSITE(http://prosite.expasy.org/)搜索ElStAR蛋白功能结构域(赵婧微等,2020),利用ProtParam(https://web.expasy. org/protparam/)分析其理化性质;采用TargetP 1.1(http://www.cbs.dtu.dk/services/TargetP-1.1/index.php)、TMHMM 2.0(http://www.cbs.dtu.dk/services/TMHMM-2.0/)、SignalP 5.0(www.cbs.dtu.dk/services/SignalP/)、PSORT II Prediction(https://psort.hgc.jp/form2.html)、NetPhos 3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)分別预测ElStAR蛋白的亚细胞定位、跨膜结构域、信号肽及其潜在磷酸化位点等,并利用SOMPA和SWISS-MODEL在线预测ElStAR蛋白的二、三级结构。
1. 2. 5 ElStAR基因在白斑狗鱼不同组织中的表达分析 采用SYBR Green I荧光染料在Bio-Rad CFX96定量PCR仪器上进行ElStAR基因组织表达定量分析。以反转录合成的cDNA为模板、β-actin基因为内参基因,采用实时荧光定量PCR检测ElStAR基因在不同组织中的表达情况,每个样品设3个重复。实时荧光定量PCR反应体系20.0 μL:2×SuperReal PreMix Plus 10.0 μL,正、反向引物各0.6 μL,cDNA模板1.0 μL,RNase Free dH2O 7.8 μL。扩增程序:95 ℃预变性5 min;95 ℃ 30 s,59 ℃ 30 s,进行39个循环;95 ℃延伸30 s。根据ElStAR基因和β-actin基因在各组织中扩增得到的Ct值,通过2-ΔCt法换算白斑狗鱼各组织中ElStAR基因的相对表达量。采用SPSS 21.0进行单因素方差分析(One-way ANOVA)及LSD多重比较。
2 结果与分析
2. 1 ElStAR基因扩增结果
PCR扩增产物经1.5%琼脂糖凝胶电泳检测,发现在1500 bp附近有单一清晰的目的条带,且片段大小与预期结果相符。采用DNAMAN 6.0对测序片段进行拼接,获得ElStAR基因cDNA序列长度1485 bp。经ORF Finder查询发现,ElStAR基因ORF为864 bp,共编码287个氨基酸残基(图1)。
2. 2 同源比对分析结果
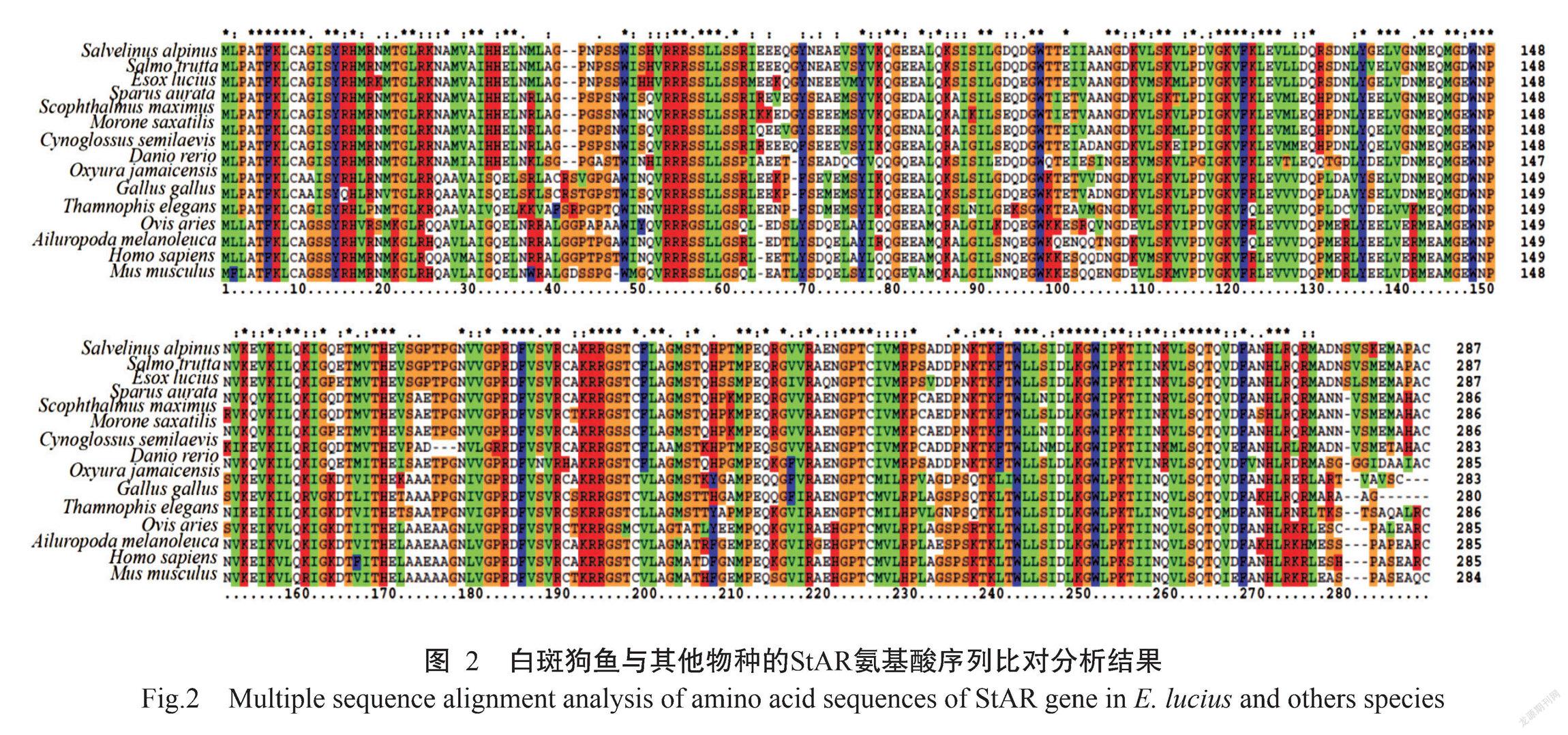
通过BLAST对ElStAR蛋白进行氨基酸序列同源比对分析,结果发现该蛋白与NCBI已公布其他物种的StAR氨基酸序列具有较高的相似性,其中与北极红点鲑(Salvelinus alpinus,XP_023857022.1)的相似性最高,达93.33%;与海鳟(Salmo trutta,XP_029- 572335.1)、条纹鲈鱼(Morone saxatilis,XP_035514- 562.1)、金头鲷(Sparus aurata,XP_030271932.1)、大菱鲆(Scophthalmus maximus,XP_035495069.1)、斑马鱼(Danio rerio,NP_571738.1)、半滑舌鳎(Cynoglossus semilaevis,AIB06798.1)的相似性分别为90.03%、85.02%、82.58%、81.53%、79.09%和76.66%;而与棕硬尾鸭(Oxyura jamaicensis,XP_0352010- 15.1)、家鸡(Gallus gallus,NP_990017.1)、束带蛇(Thamnophis elegans,XP_032086010.1)、人类(Homo sapiens,AAB88174.1)、大熊猫(Ailuropoda melanoleuca,XP_002917276.1)、绵羊(Ovis aries,NP_001- 009243.1)及小家鼠(Mus musculus,AAB94783.1)的相似性相对较低,分别为69.90%、68.17%、63.67%、64.31%、63.32%、60.90%和59.15%。说明StAR蛋白在鱼类中进化十分保守,白斑狗鱼与隶属于鲑科的北极红点鲑和海鳟等鱼类在StAR氨基酸序列上具有较高的相似性。
2. 3 系统发育进化分析结果
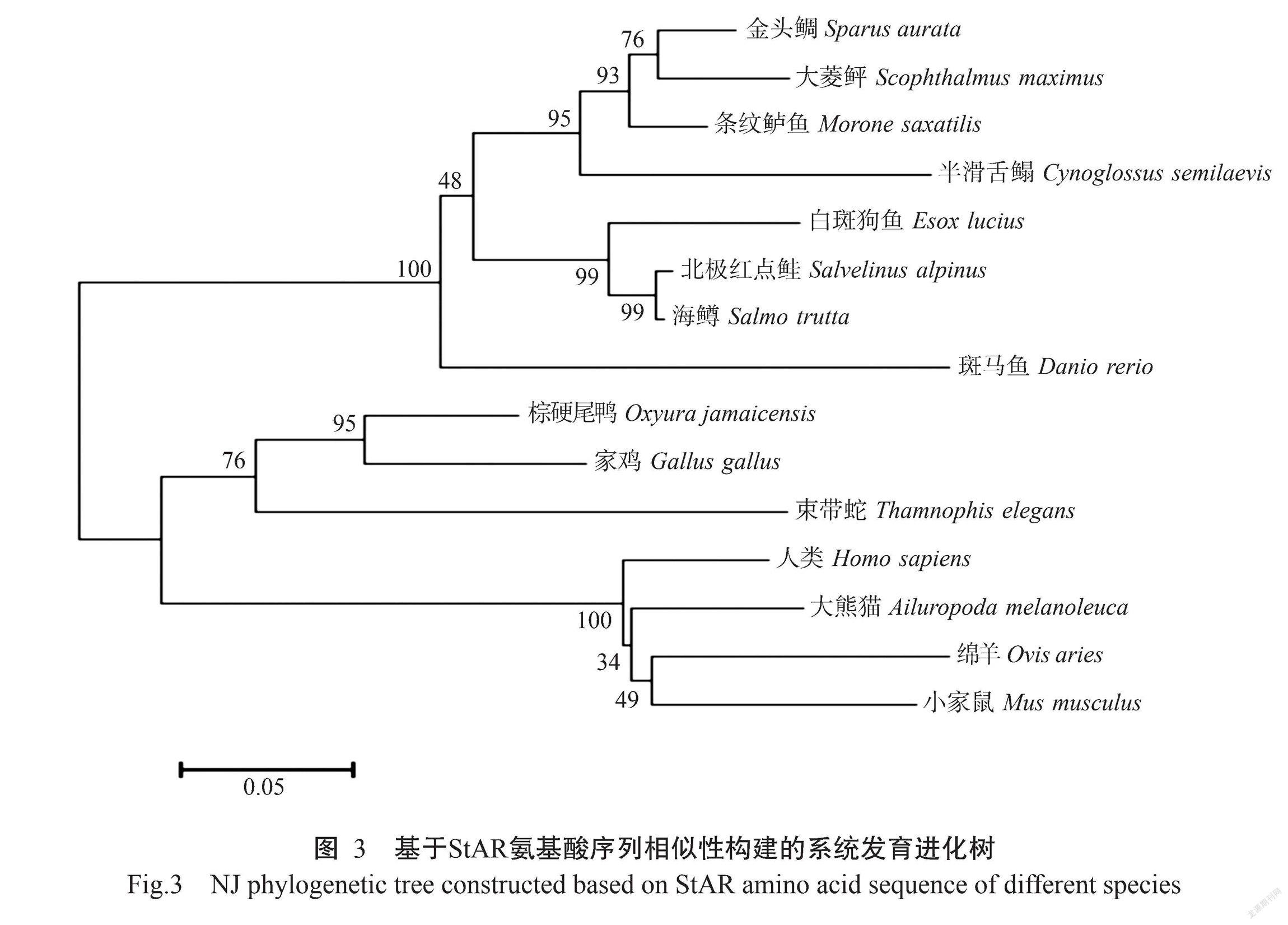
基于StAR氨基酸序列相似性,通过MEGA 5.1的NJ法构建上述15个物种的系统发育进化树,分析处于不同分类地位(哺乳类、鸟类、爬行类及鱼类)的StAR氨基酸序列,结果(图3)发现,鸟类先与爬行类聚在一起,再与哺乳类聚为一支,最后与鱼类聚在一起。在鱼类分支中,北极红点鲑与海鳟先聚为一小分支,再与白斑狗鱼聚在一起,表明白斑狗鱼与鲑科的北极红点鲑和海鳟的亲缘关系最近,而与哺乳类的亲缘关系最远,符合传统的自然物种进化理论。
2. 4 ElStAR蛋白理化性质预测分析结果
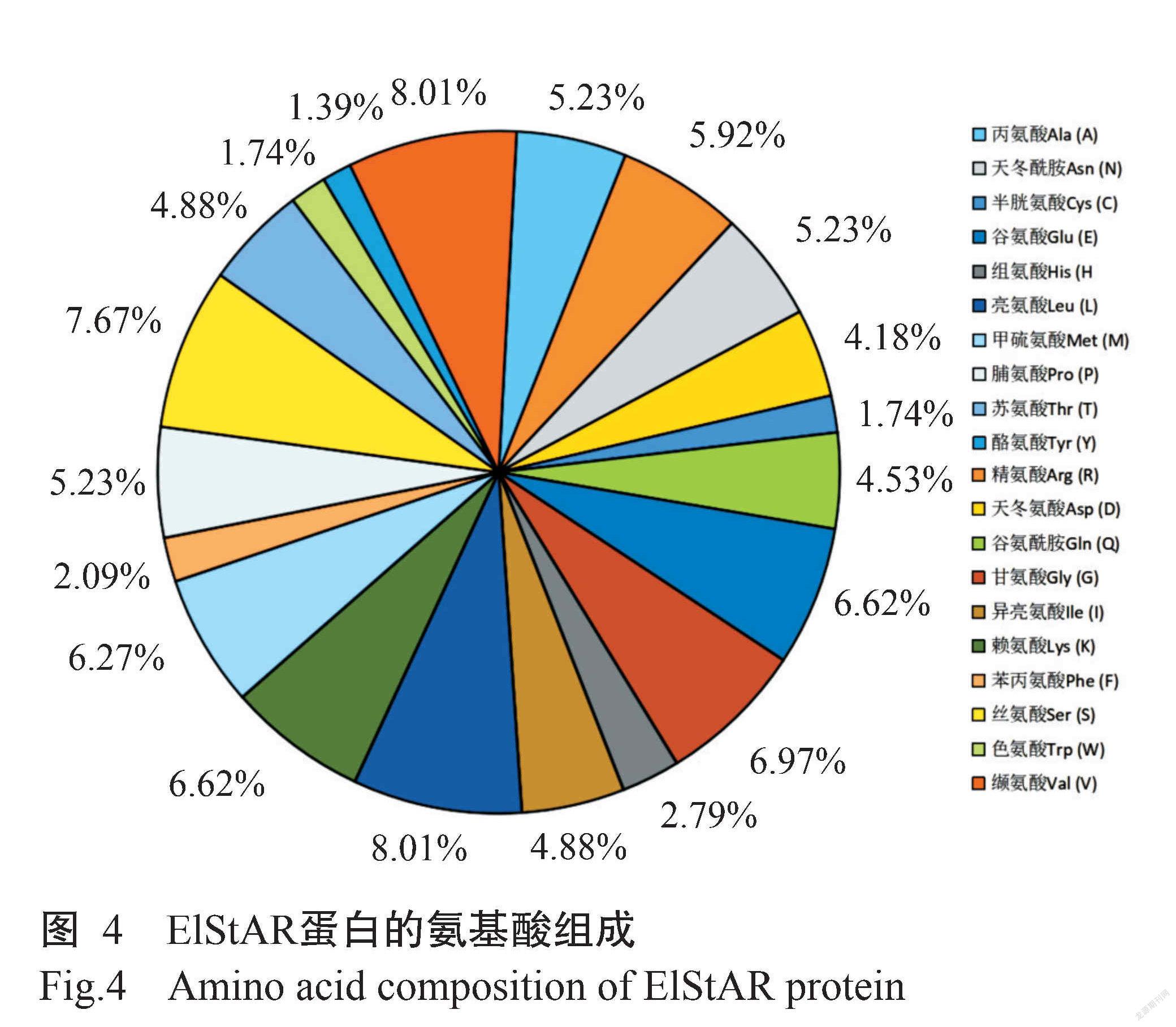
通过ProtParam和ProtScale等在线软件预测ElStAR蛋白理化性质,结果显示,ElStAR蛋白分子式为C1401H2266N406O418S23,相对分子量为32.23 kD,理论等电点(pI)為8.98,属于碱性蛋白。ElStAR蛋白中含量最多的氨基酸为缬氨酸(8.01%)和亮氨酸(8.01%),而酪氨酸含量最少(1.40%)(图4),其中带正电荷的氨基酸残基总数36个,带负电荷的氨基酸残基总数31个。ElStAR蛋白不稳定指数为43.97,推测该蛋白为不稳定蛋白,在哺乳动物网状细胞及体外的半衰期为30 h。该蛋白的脂肪系数为78.75,总平均亲水性(GRAVY)为-0.39,属于亲水性蛋白(图5)。
2. 5 ElStAR蛋白磷酸化位点、信号肽及亚细胞定位预测结果
运用NetPhos 3.1预测ElStAR蛋白潜在磷酸化位点,结果发现存在26个磷酸化位点(图6),包括16个丝氨酸磷酸化位点(分别位于第45、54、55、58、59、85、109、185、194、206、207、229、243、260、278和280位氨基酸处)、7个苏氨酸磷酸化位点(分别位于第21、97、173、195、203、239和262位氨基酸处)及3个络氨酸磷酸化位点(分别位于第67、74和133位氨基酸处)。SignalP 5.0预测结果显示,ElStAR蛋白不存在信号肽;TMHMM2.0预测结果显示,ElStAR蛋白也无跨膜结构域。ElStAR蛋白亚细胞定位预测结果表明,ElStAR氨基酸序列中含有线粒体靶向肽mTP(74.4%)及分泌途径信号肽SP(6.8%),符合线粒体靶向肽的基本特征。PSORT II Prediction预测分析也发现,ElStAR蛋白亚细胞分布于线粒体的概率为47.8%,分布于细胞核的概率为26.1%,分布于细胞质的概率为17.4%,进一步证实ElStAR蛋白是线粒体中的转运蛋白。
2. 6 ElStAR蛋白二、三级结构预测结果
通过SOMPA在线预测ElStAR蛋白二级结构,结果(图7)表明,ElStAR蛋白二级结构中占比最高的是α-螺旋(占40.77%),其次是无规则卷曲(占35.89%)和延伸链(占18.12%),β-折叠的占比仅为5.23%。采用ExPASy的PROSITE预测ElStAR蛋白功能结构域,发现在第91~279位氨基酸处存在1个保守结构域(图8),即START结构域。SWISS-MODEL预测结果(图9)显示,ElStAR蛋白三级结构是由α-螺旋配合多个β-折叠卷曲盘旋而成。
2. 7 ElStAR基因在白斑狗鱼不同组织中的表达情况
由图10和图11可看出,ElStAR基因在白斑狗鱼的精巢、卵巢、头肾、肝脏、肌肉及脑组织中均有不同程度的表达,而在肠道、肾脏和鳃组织中几乎不表达。ElStAR基因在白斑狗鱼性腺中表达存在明显的二态性。在180日龄,ElStAR基因在精巢中的相对表达量最高,极显著高于在卵巢中的相对表达量(P<0.01,下同);雄性个体头肾的ElStAR基因相对表达量也极显著高于雌性个体,其余组织间的相对表达量不存在性别差异;同性别不同组织间对比发现,ElStAR基因在精巢中的相对表达量是头肾中的2.61倍,是肌肉中的20.89倍。在320日龄,ElStAR基因在精巢中的相对表达量也极显著高于在卵巢中的相对表达量,在雄性个体头肾的相对表达量也极显著高于雌性个体;同性别不同组织间对比发现,ElStAR基因在精巢中的相对表达量是头肾中的10.77倍。此外,对比不同时期同一组织间的ElStAR基因表达情况可知,320日龄白斑狗鱼精巢的相对表达量约是180日龄的6.01倍,说明随着精巢的生长发育ElStAR基因表达呈增长趋势。
3 讨论
StAR蛋白最初是在小鼠MA-10 Leydig细胞株中克隆获得(Clark et al.,1994),其结构十分保守,N端均由疏水氨基酸构成,C端则有1个START保守结构域(Ponting and Aravind,1999)。类固醇激素在合成前以胆固醇的形式存在于生物体内,START结构域对胆固醇具有很高的亲和性,因此StAR蛋白对胆固醇具有很高的亲和力,能降低巨噬细胞的脂质含量和炎症状态,对胆固醇的协同转运发挥重要作用。有关人类StAR蛋白晶体结构的研究发现,START结构域有明显的α-螺旋和β-折叠,在蛋白内部形成疏水管道,可与胆固醇分子结合(Tsujishita and Hurley,2000)。本研究发现ElStAR蛋白具有相似的C端、N端及START保守结构域,说明StAR蛋白的结构和功能十分保守,在不同生物体中广泛参与胆固醇的传导运输过程(郭华和刘洪涛,2001)。本研究的StAR氨基酸序列同源比对分析结果表明,ElStAR氨基酸序列与北极红点鲑StAR氨基酸序列的相似性最高(93.33%),与海鳟的相似性也非常高(90.03%),而与小家鼠的相似性相对较低(59.15%),说明StAR蛋白在不同鱼类中甚至不同脊椎动物中十分保守(郭华和刘洪涛,2001);基于StAR氨基酸序列相似性构建的系统发育进化树也显示,白斑狗鱼与北极红点鲑和海鳟等鲑科鱼类处于同一分支,遗传距离较近,并与金头鲷、大菱鲆、条纹鲈鱼、半滑舌鳎及斑马鱼等鱼类聚为一支,而与鸟类、爬行类和哺乳类处于不同的分支,遗传距离较远,符合传统的自然物种进化理论。
StAR蛋白在加工形成过程中存在3种不同的形式,其对应的相对分子量分别为37.0、32.0和30.0 kD。其中,相对分子量为37.0 kD的StAR蛋白首先在信号肽引导下定位于线粒体内膜,然后被蛋白酶切除信号肽形成相对分子量为32.0 kD的StAR蛋白,再通过线粒体内的酶类去除靶向序列,形成具有稳定活性、相对分子量为30.0 kD的StAR蛋白(Stocco and Clark,1996)。本研究通过预测ElStAR蛋白的理化性质、信号肽及亚细胞定位,结果发现ElStAR蛋白主要由20种氨基酸组成,其理论分子量为32.23 kD,存在线粒体靶向信号肽,亚细胞定位主要分布于线粒体内。ElStAR蛋白二、三级结构预测结果显示其存在β-折叠及与氨基酸C端连接的α-螺旋,与Mathieu等(2002)研究发现StAR蛋白结构中包含1个由β-折叠环和C端α-螺旋组成疏水管道的结论一致,且该疏水管道正是StAR蛋白与线粒体外膜相联系的位置(Yaworsky et al.,2005)。ElStAR蛋白的GRAVY为-0.39,属于亲水性蛋白,作为转运调节蛋白对胆固醇的运输起重要作用。
在哺乳类动物中,StAR蛋白主要存在于类固醇激素相关的组织(肾上腺、前脑和性腺)中(Chi et al.,2014),而在非哺乳类动物中其表达部位无明显规律。StAR基因只在半滑舌鳎精巢中表达,在其卵巢中不表达(Stocco,2001);在虹鳟的精巢、卵巢、肠道及肾脏等组织中均有StAR基因表达,并证实StAR基因是卵巢发育的关键基因(Kusakabe et al.,2002;Nakamura et al.,2005);StAR基因在鲶鱼(Clarias gariepinus)的性腺、肾脏、肝脏、大脑及肠道等多种组织均有表达,其中以卵巢产卵前期的表达量较高,在产卵准备期、产卵期和回归期的表达量较低,而在精巢中的最高表达量出现在准备阶段(Sreenivasulu et al.,2009);StAR基因在美国牛蛙(Rang catesbeiana)精巢、皮肤及脑组织中均有不同程度的表达(Paden et al.,2010);在尼罗罗非鱼中存在2种StAR基因(StAR1和StAR2),其中,StAR1基因主要在头肾和性腺组织中表达,而StAR2只在精巢和卵巢中表达(于祥国,2013)。可见,StAR基因在鱼类的性腺发育过程中发挥着重要作用。本研究通过实时荧光定量PCR分析ElStAR基因在白斑狗鱼雌雄成鱼不同组织间的差异表达,结果表明,ElStAR基因主要是在精巢、头肾和肝脏中表达,且在精巢中的相对表达量极显著高于在卵巢中的相对表达量,说明ElStAR基因可能对白斑狗鱼精巢的生长发育具有一定维持作用。
4 结论
ElStAR基因编码蛋白结构和功能十分保守,具有典型的START结构域,对胆固醇的运输和调节起重要作用。ElStAR基因在白斑狗鱼精巢及卵巢中的表达存在极显著差异,可能在维持白斑狗鱼精巢的发育形成中发挥重要作用。
参考文献:
蔡静. 2018. StAR在尼罗罗非鱼性腺分化和配子发生过程中的功能研究[D]. 重庆:西南大学. [Cai J. 2018. Functional studies of StAR during gonadal differentiation and gametogenesis in Nile tilapia[D]. Chongqing:Southwest University.]
郭华,刘洪涛. 2001. StAR——类固醇激素合成急性调节蛋白[J]. 国外医学(内分泌学分册),21(5):266-268. [Guo H,Liu H T. 2001. StAR—Steroidogenic acute regulatory protein[J]. Foreign Medical Sciences(Section of Endocrinology),21(5):266-268.] doi:10.3760/cma.j.issn.1673-4157.2001.05.016.
郭焱. 2012. 新疆鱼类志[M]. 乌鲁木齐:新疆科学技术出版社:19-23. [Guo Y. 2012. Fish records of Xinjiang[M]. Urumqi:Xinjiang Science and Technology Press:19-23.]
李飞,胡琼,张俊杰. 2018. 17α-甲基睾丸酮诱导白斑狗鱼性逆转初步研究[J]. 淡水渔业,48(1):3-8. [Li F,Hu Q,Zhang J J. 2018. Preliminary research on Esox lucius sex revesal induced by 17 alpha-methyl testosterone[J]. Freshwater Fisheries,48(1):3-8.] doi:10.3969/j.issn.1000-6907.2018.01.001.
刘倩,马晓,岑双双,田雪,王璐明,吴利敏,刘慧芬,李学军. 2020. 中华鳖StAR基因的克隆、表达及多克隆抗体制备[J]. 水产学报,44(11):1813−1823. [Liu Q,Ma X,Cen S S,Tian X,Wang L M,Wu L M,Liu H F,Li X J. 2020. Molecular cloning,expression analysis and polyclonal antibody preparation of StAR gene in Chinese soft-shelled turtle (Pelodiscus sinensis)[J]. Journal of Fisheries of China,44(11):1813-1823.] doi:10.11964/jfc.201910 12034.
于祥国. 2013. 尼罗罗非鱼类固醇激素合成关键基因3β-HSD和StAR的相关研究[D]. 重庆:西南大学. [Yu X G. 2013. Study on key genes 3β-HSD and StAR of the steroidgenesis in Nile tilapia[D]. Chongqing:Southwest University.]
張俊杰,胡琼,管潇萌,李飞,王明坤,李胜忠. 2018. 白斑狗鱼雌性化诱导和雌雄同体现象[J]. 水产学报,42(4):557-564. [Zhang J J,Hu Q,Guan X M,Li F,Wang M K,Li S Z. 2018. Feminization induction and hermaphroditism of northern pike (Esox lucius)[J]. Journal of Fisheries of China,42(4):557-564.] doi:10.11964/jfc.20170410813.
趙婧微,孙瑜彤,李武峰. 2020. 广灵驴CAPN1基因克隆、生物信息学分析及表达研究[J]. 中国畜牧兽医,47(3):655-665. [Zhao J W,Sun Y T,Li W F. 2020. Cloning,bioinformatics and expression analysis of CAPN1 gene in Guangling donkey[J]. China Animal Husbandry & Vete-rinary Medicine,47(3):655-665.] doi:10.16431/j.cnki. 1671-7236.2020.03.002.
朱颖,孟亮,胡乔木,王晓夏,常亚青,陈松林. 2014. 半滑舌鳎StAR基因克隆及其在不同组织的时空表达分析[J]. 水产学报,38(9):1221-1229. [Zhu Y,Meng L,Hu Q M,Wang X X,Chang Y Q,Chen S L. 2014. Molecular clo-ning and temporal expression analysis of StAR gene in different tissues of half-smooth tongue sole(Cynoglossus semilaevis)[J]. Journal of Fisheries of China,38(9):1221-1229.] doi:10.3724/SP.J.1231.2014.49088.
Bry C. 1996. Role of vegetation in the life cycle of pike[J]. Fish and Fisheries Series,19:45-67. doi:10.1007/978-94-015-8775-4_3.
Cejko B I,Krejszeff S,Daniel Ż,Judycka S,Targońska K,Kucharczyk D. 2018. Effect of carp pituitary homogenate (CPH) and sGnRHa (Ovaprim) on northern pike (Esox lucius) spermiation stimulation and its effect on quantity and quality of sperm[J]. Animal Reproduction Science,193:217-225. doi:10.1016/j.anireprosci.2018.04.073.
Chi M L,Wen H S,Ni M,He F,Li J F,Qian K,Zhang P,Chai S H,Ding Y X,Yin X H. 2014. Molecular identification of genes involved in testicular steroid synthesis and characterization of the responses to hormones stimulation in testis of Japanese sea bass (Lateolabrax japonicas)[J]. Steroids,84:92-102. doi:10.1016/j.steroids. 2014.03.014.
Clark B J,Wells J,King S R,Stocco D M. 1994. The purification,cloning,and expression of a novel luteinizing hormone-induced mitochondrial protein in MA-10 mouse leydig tumor cells. Characterization of the steroidogenic acute regulatory protein (StAR)[J]. Journal of Biological Chemistry,269(45):28314-28322. doi:10.1016/S0021-9258(18)46930-X.
Goetz F W,Norberg B,McCauley L A R,Iliev D B. 2004. Characterization of the cod (Gadus morhua) steroidogenic acute regulatory protein (StAR) sheds light on StAR gene structure in fish[J]. Comparative Biochemistry and Physiology. Part B:Biochemistry and Molecular Biology,137(3):351-362. doi:10.1016/j.cbpc.2003.12.006.
Kusakabe M,Todo T,McQuillan H J,Goetz F W,Young G. 2002. Characterization and expression of steroidogenic acute regulatory protein and MLN64 cDNAs in trout[J]. Endocrinology,143(6):2062-2070. doi:10.1210/endo. 143.6.8672.
Mathieu A P,Fleury A,Ducharme L,Lavigne P,LeHoux J G. 2002. Insights into steroidogenic acute regulatory protein (StAR)-dependent cholesterol transfer in mitochondria:Evidence from molecular modeling and structure-based thermodynamics supporting the existence of partially unfolded states of StAR[J]. Journal of Molecular Endocrinology,29(3):327-345. doi:10.1677/JME.0.0290327.
Nakamoto M,Fukasawa M,Tanaka S,Shimamori K,Suzuki A,Matsuda M,Kobayashi T,Nagahama Y,Shibata N. 2012. Expression of 3β-hydroxysteroid dehydrogenase (hsd3b),star and ad4bp/sf-1 during gonadal development in medaka (Oryzias latipes)[J]. General & Comparative Endocrinology,176(2):222-230. doi:10.1016/j.ygcen. 2012.01.019.
Nakamura I,Evans J C,Kusakabe M,Nagahama Y,Young G. 2005. Changes in steroidogenic enzyme and steroidoge-nic acute regulatory protein messenger RNAs in ovarian follicles during ovarian development of rainbow trout (Oncorhynchus mykiss)[J]. General & Comparative Endocrinology,144(3):224-231. doi:10.1016/j.ygcen.2005. 06.004.
Neumann R M,Willis D W,Sammons S M. 2011. Seasonal growth of northern pike (Esox lucius) in a South Dakota Glacial Lake[J]. Journal of Freshwater Ecology,9(3):191-196. doi:10.1080/02705060.1994.9664886.
Nunez B S,Evans A N. 2007. Hormonal regulation of the steroidogenic acute regulatory protein (StAR) in gonadal tissues of the Atlantic croaker (Micropogonias undulatus)[J]. General & Comparative Endocrinology,150(3):495-504. doi:10.1016/j.ygcen. 2006.11.011.
Paden N E,Carr J A,Kendall R J,Wages M,Smith E E. 2010. Expression of steroidogenic acute regulatory protein (StAR) in male American bullfrog (Rang catesbeia-na) and preliminary evaluation of the response to TNT[J]. Chemosphere,80(1):41-45. doi:10.1016/j.chemosphere.2010.03.049.
Patchev A V,Fischer D,Wolf S S,Herkenham M,Götz F,Gehin M,Chambon P,Patchev V K,Almeida O F X. 2007. Insidious adrenocortical insufficiency underlies neuroendocrine dysregulation in TIF-2 deficient mice[J]. The FASEB Journal,21(1):231-238. doi:10.1096/fj.06-69 52com.
Ponting C P,Aravind L. 1999. START:A lipid-binding domain in StAR,HD-ZIP and signalling proteins[J]. Trends in Biochemical Sciences,24(4):130-132. doi:10.1016/s0968-0004(99)01362-6.
Shang G H,Peng X Y,Ji C,Zhai G,Ruan Y L,Lou Q Y,Jin X,He J Y,Wang H,Yin Z. 2019. Steroidogenic acute regulatory protein and luteinizing hormone are required for normal ovarian steroidogenesis and oocyte maturation in zebrafish[J]. Biology of Reproduction,101(4):760-770. doi:10.1093/biolre/ioz132.
Soccio R E,Breslow J L. 2003. StAR-related lipid transfer (START) proteins:Mediators of intracellular lipid metabo-lism[J]. Journal of Biological Chemistry,278(25):22183-22186. doi:10.1074/jbc.R300003200.
Sreenivasulu G,Sridevi P,Sahoo P K,Swapna I,Ge W,Kirubagaran R,Dutta-Gupta A,Senthilkumaran B. 2009. Cloning and expression of StAR during gonadal cycle and hCG-induced oocyte maturation of air-breathing catfish,Clarias gariepinus[J]. Comparative Biochemistry and Physiology. Part B:Biochemistry and Molecular Biology,154(1):6-11. doi:10.1016/j.cbpb.2009.04.010.
Stocco D M,Clark B J. 1996. Role of the steroidogenic acute regulatory protein (StAR) in steroidogenesis[J]. Bioche-mical pharmacology,51(3):197-205. doi:10.1016/0006-2952(95)02093-4.
Stocco D M. 2001. StAR protein and the regulation of steroid hormone biosynthesis[J]. Annual Review of Physiology,63:193-213. doi:10.1146/annurev.physiol.63.1.193.
Tkachenko I V,Jääskeläinen T,Jääskeläinen J,Palvimo J J,Voutilainen R. 2011. Interleukins 1α and 1β as regulators of steroidogenesis in human NCI-H295R adrenocortical cells[J]. Steroids,76(10-11):1103-1115. doi:10.1016/j.steroids.2011.04.018.
Tsuchiya M,Inoue K,Matsuda H,Nakamura K,Mizutani T,Miyamoto K,Minegishi T. 2003. Expression of steroidogenic acute regulatory protein (StAR) and LH receptor in MA-10 cells[J]. Life Sciences,73(22):2855-2863. doi:10.1016/s0024-3205(03) 00698-2.
Tsujishita Y,Hurley J H. 2000. Structure and lipid transport mechanism of a StAR-related domain[J]. Nature Structural & Molecular Biology,7:408-414. doi:10.1038/75192.
Yaworsky D C,Baker B Y,Bose H S,Best K B,Jensen L B,Bell J D,Baldwin M A,Miller W L. 2005. pH-dependent Interactions of the carboxyl-terminal helix of steroidoge-nic acute regulatory protein with synthetic membranes[J]. Journal of Biological Chemistry,280(3):2045-2054. doi:10.1074/jbc.M410937200.
Zempo B,Kanda S,Okubo K,Akazome Y,Oka Y. 2013. Anatomical distribution of sex steroid hormone receptors in the brain of female medaka[J]. The Journal of Comparative Neurology,521(8):1760-1780. doi:10.1002/cne. 23255.
收稿日期:2020-11-25
基金項目:国家自然科学基金项目(31660739);新疆高校科研计划项目(XJEDU2016I201);新疆农业大学大学生创新项目(201910758040)
第一作者:张俊杰(1973-),https://orcid.org/0000-0002-9102-1688,博士,副教授,主要从事鱼类生物学研究工作,E-mail:zhangjuji@sina.cn

