微生物法检测乳粉中叶酸的优化研究
文/苏妙仪 严家俊 张 娟
(广东产品质量监督检验研究院)
维生素是人体神经系统最重要的营养素,包括维生素A、B、D、E等,其中B族维生素又是重要的神经营养类维生素。如果长期缺乏某种维生素,就会引起生理机能障碍而发生某种疾病。维生素摄入可能降低肝癌的发病风险,特别是维生素E和叶酸的效果更显著[1]。叶酸属于水溶性B族维生素,通常储存于绿叶蔬菜、水果及动物肝脏中,在蛋白质代谢、维持人体机能等方面发挥着不可或缺的作用[2]。欧盟建议成年人每日叶酸推荐摄入量为400 μg,孕期和哺乳期妇女每日叶酸推荐摄入量为400~600 μg。我国食品安全国家标准对婴幼儿配方乳粉中强化维生素的含量有严格要求,对于婴儿叶酸含量一般要求在2.5~12.0 μg/100 kJ之间,较大婴儿和幼儿最低含量为1 μg/100 kJ[3,4]。叶酸能够促进婴儿身体器官的发育,增加婴儿的免疫力等。因此,育龄期女性合理补充叶酸,是促进优生优育的重要措施[5]。研究表明,叶酸摄入量不足或代谢通路受阻会增加脑卒中的发病风险[6],叶酸水平低可能是阿尔兹海默病发生的危险因素[7],维持较好的叶酸水平对降低高血压、预防和控制心脑血管疾病具有重要意义[8]。因此食品中叶酸含量的准确测定十分关键,对指导人们日常饮食、预防疾病具有重要意义。
目前,叶酸的检测方法主要包括色谱法[9~13]、荧光法[14~17]、微生物法[18~19]、电化学法[20]和酶联免疫法[21,22]等。在众多检测方法中,微生物法由于灵敏度高、不需要复杂设备仪器及成本低等优点[25],在最新的第十七版官方分析化学家协会AOAC(Association of Official Analytical Chemists)和美国谷物化学家协会分析方法中,被列为食品叶酸的第一分析方法,其定量分析原理为微生物生长需要生长因子,而叶酸是鼠李糖乳酸杆菌(Lactobacillus caseisub sp. Rhamnosus ATCC7469)生长所必需的因子,并具有专一性。在一定条件下,鼠李糖乳酸杆菌的生长繁殖速度与溶液中叶酸的含量成正比关系,从而定量计算出叶酸的含量。但是微生物法也存在试验周期长,步骤繁琐,对试验人员和试验室的要求较高,结果重复性差等局限性。因此本文在GB 5009.211-2014基础上,对菌株冷冻制备保存,菌悬液浓度以及培养时间进行摸索,以缩短接种液制备时间,从而缩短整个试验周期,以应对日益增长的检测需求,对促进婴幼儿乳粉中叶酸含量的研究具有一定的指导意义。
1 试验材料与方法
1.1 试验材料
试验样品:5 组婴幼儿配方乳粉,随机购于各大超市;SRM 1849a质控样品购于美国NIST。
试验菌株:鼠李糖乳酸杆菌(Lactobacillus caseispp.rhamnosus)ATCC7469,购于环凯微生物科技有限公司。
1.2 仪器试剂
仪器:AC2-6S1生物安全柜,新加坡ESCO公司;GHP-9160隔水式恒温培养箱,上海一恒科技有限公司;UV-1900紫外可见分光光度计,岛津(中国)有限公司。
试剂:叶酸测定用培养基,乳酸杆菌肉汤培养基,乳酸杆菌琼脂培养基,均购于北京陆桥技术股份有限公司;叶酸标准品,购于德国Dr.Ehrenstorfer公司;相关标准溶液的配制参照GB 5009.211-2014。
1.3 试验方法
1.3.1 接种液优化
将鼠李糖乳酸杆菌冻干粉接种到乳酸杆菌肉汤培养基上,(37±1)℃培养20~24 h。再转种2 ~3 代增强活力。将活化后的菌液以8000 r/min离心5 min,弃去上清液,加入10 mL 生理盐水,混匀。重复洗脱3次,确保无残留培养基。预先用50 mL含有25%甘油的叶酸测定用培养基混匀制成菌悬液并分装1.0mL至菌株保存管,-70 ℃冻存备用。每次试验前从-70℃冰箱中取出适量的菌株储备液,充分混匀。
1.3.2 适宜菌悬液浓度与培养时间的探索试验
使用0.85%生理盐水对同一批次制成的菌株储备液进行稀释,调节透光率成4 种浓度测试菌液:30%、50%、70%、90%,分别加入50 μL到叶酸含量为0.00 ng和1.00 ng的试管中,一式三份。培养16 h、20 h、24 h、28 h、32 h、36 h、40 h、44 h、48 h和60 h,同时以叶酸含量为0.00ng作为空白对照管,540 nm下分别测定其余试管的吸光度,比较各浓度测试菌悬液的生长规律。
1.3.3 试样制备方法的优化[23]
试样的制备方法参考G B 5009.211-2014并进行优化,取试样约1.0 g至50 mL离心管中,加入约30 mL纯水,摇匀,定容至40 mL。95 ℃水浴30 min,其间振荡至少5 次,迅速冷却至室温,使用0.22 μm 滤膜过滤除菌后,稀释相应倍数,使叶酸稀释液浓度落在标准曲线范围内,备用。
1.3.4 准确性试验
以SRM 1849a质控样品中叶酸含量为基准,按1.3.3试样制备的优化方法处理试样,并采用1.3.2试验所得的最适菌悬液浓度和培养时间的关系,进行6 次平行试验。同时与国标微生物法的测定结果进行比较。
1.3.5 重复性试验
随机选取5 组婴幼儿配方乳粉,按1.3.3试样制备的优化方法处理试样,并采用1.3.2试验所得的最适菌悬液浓度和培养时间的关系对每个试样进行6 次重复性试验。
2 结果与分析
2.1 适宜菌悬液浓度与培养时间关系的确定
以测定试管的培养时间为横坐标,不同时间测得的吸光度值为纵坐标,绘制不同浓度测试菌液的生长曲线,见图1~4。
由图1~4结果可知,营养物充足的情况下,随着透光率的降低,菌悬液浓度增大,菌体进入稳定生长期越快,时间越短。图1试管由于菌悬液浓度低,适应期较长,在培养16~36 h之间处于适应调整期,生长缓慢,吸光度值从0.098到0.298变化较小,测得吸光度值较图2、3、4试管明显偏低;图2试管菌体经过一段时期适应后在16~40 h之间以最快的速度进行繁殖进入对数期,吸光度值变化明显,在该时期内营养物质的浓度影响菌的生长速率和总生长量,在40 h之后增速缓慢,到60h测得吸光度值无明显变化,处于稳定生长期;图3、4试管由于菌悬液浓度较高,短时间内16 h分别测得吸光度值0.686和0.759,直接处于对数生长期,且两组试管分别在36 h和28 h进入稳定期,到60 h之后增速缓慢,测得吸光度值无明显变化。
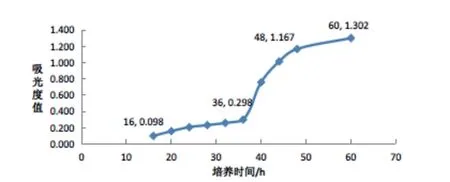
图1 透光率90%浓度的测试菌悬液生长曲线

图2 透光率70%浓度的测试菌悬液生长曲线

图3 透光率50%浓度的测试菌悬液生长曲线

图4 透光率30%浓度的测试菌悬液生长曲线
从该试验结果得知,图2、3、4试管由于菌悬液浓度的逐步增大,菌体进入稳定生长期时间越短,分别在40 h、36 h和28 h进入稳定生长期,当生长因子叶酸耗尽,鼠李糖乳酸杆菌停止增长,不管培养时间的延长,测得吸光度值无明显变化,因此可以利用终点法测定叶酸的含量。试验中还发现,由于标准系列管中低浓度叶酸含量很低,如果菌悬液浓度较高(图3、4 试管),会在短时间内进入对数生长期、稳定生长期甚至是衰老期,从而导致鼠李糖乳酸杆菌在标准系列管中均处于不同生长期,测得吸光度值有变化,最终影响试验结果。因此本次试验结果表明,该批次菌株储备液用于叶酸测定时,将测定菌悬液透光率稀释在70%、培养时间在40 h以上可以保证试验的可行性与稳定性。
2.2 接种液优化
GB 5009.211-2014中接种液的制备:先将储备菌株连续传种2~3 代以保证细菌活力(耗时3~4天)并且每月至少传代1 次。试验前活化后的菌株再接种至琼脂培养基中(37±1)℃培养20~24 h后,备用。然后试验前一天,取2 mL叶酸标准工作溶液和4 mL叶酸测定用培养液混匀,分装于2 支5 mL离心管中,塞好棉塞,于121 ℃高压灭菌15 min后即为种子培养液。冷却后用接种环将活化的菌株转至2支种子培养液中,于(37±1) ℃恒温培养箱中培养20~24 h。试验当天取出后将种子培养液混悬,无菌操作下用无菌注射器吸取0.5 mL转接至另两支已消毒但不含叶酸的培养液中,于(37±1) ℃培养6 h,振荡混匀,制成接种液,立即使用。完成接种液制备,整个过程需要耗时4~5 天,操作繁琐,制备时间长,并且由于菌株代数不同,活力不同,导致浓度也不易把握。再加上试验培养时间和最终吸光度测定,完成一批样品检测总耗时6~7天。检验时间过长,不利于大批量、任务紧急的检测。
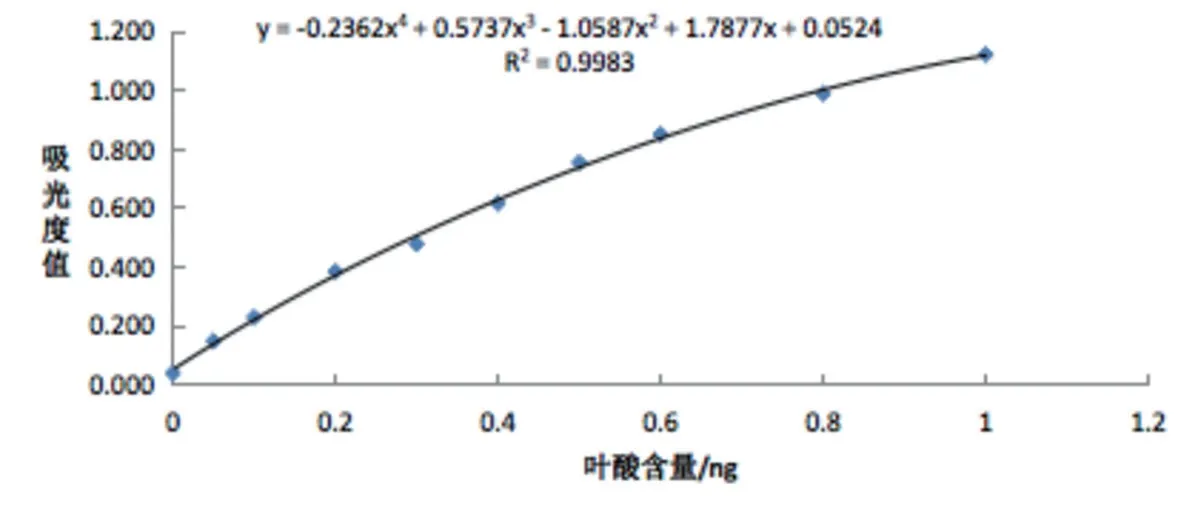
图5 标准曲线-国标微生物法

图6 标准曲线-优化方法
本研究方法是将活力增强2~3代后的菌株预先用50 mL含有25%甘油的叶酸测定用培养基混匀制成菌悬液并分装1.0mL至菌株保存管,-70 ℃冻存备用。每次试验时只需要拿出该批次菌株储备液一支,冻融后,用0.85%生理盐水稀释至测定菌悬液透光率在70%可直接作为接种液使用,试验当天可完成,节省了接种液的制备时间。其中甘油作为防冻剂防止冰晶对细胞造成伤害。
2.3 标准曲线比较
确定该批次菌株储备液适宜的菌悬液浓度为透光率T=70%、培养时间在40h以上,比较国标微生物法和优化方法所作标准曲线的差异,结果见图5、6。
由图5和图6结果可知,两种方法标准曲线线性关系较好,效果相当,R2值可达到0.99以上。国标微生物法是将试验用菌浓度和培养时间限定在一定范围内,但由于菌的生长规律存在一定的偏差,不同代数的菌株活力不同,因此使用相同菌浓度和培养时间往往不适用于不同代数的菌株生长,易造成结果不稳定。而优化方法固定同一批次菌株储备液的菌悬液浓度为T=70%、接种量50 μL、37 ℃培养40 h以上,基本确保同一批次菌株的活力从而保证试验的稳定性。
2.4 准确性与重复性试验比较
本研究拟对样品进行简单的水浴提取、稀释,优化样品的提取步骤,结合菌株制备的优化方法,对微生物法测定叶酸的含量进行优化,并将优化方法应用于检测婴幼儿乳粉中叶酸的含量。以质控样品SRM 1849a为基准,使用优化方法处理样品,并选择最适菌浓度和培养时间进行6 次试验,比较优化方法与国标微生物法所测得结果的差异,结果见表1;同时,选取了5 种不同的婴幼儿配方乳粉样品,使用优化方法对每个样品进行6 次重复性试验,结果见表2。以此对优化方法进行验证,为缩短检验周期,提高试验效率。
由表1结果可知,两种方法所测结果都与SRM 1849a中叶酸含量为229.3±6.2 ug/100 g标示值相符,准确性良好。相对于国标微生物法,优化方法结果更准确,6 次平行试验的相对标准偏差RSD较小,可达1.61%。由表2结果可知,5组不同婴幼儿配方乳粉中叶酸含量的RSD分别为1.74%、3.67%、4.36%、5.85%和4.00%。表明该方法重复性良好。
3 总结
GB 5009.211-2014微生物法检测婴幼儿乳粉中叶酸含量从菌种制备、试样提取到接种培养等步骤繁琐、复杂,存在易受外部因素干扰等问题,导致试验周期长,结果稳定性、重现性差。而微生物法测定维生素的关键因素是试验菌株,多次传代易造成菌株活力不同从而导致试验稳定性不可控。本研究在GB 5009.211-2014基础上作了两点优化:(1)优化接种液制备,菌株储备液预先分装到菌株保存管中,通过比较菌株的生长规律,得出该批次菌株储备液的适宜浓度和培养时间,确保同一批次的菌株活力基本一致,可以有效控制试验中接种液的浓度、添加量和培养时间。达到制备一次菌液可多次使用的目的。由原来的6~7 天缩减至2~3天,既节省了每次试验制备接种液时间,实现来样当天检测,又保证了试验的稳定有效。(2)试样提取,国标微生物法中对于婴幼儿乳粉可采用直接提取法,但是也需要加入80 mL氢氧化钠乙醇溶液,超声振荡2~4 h,至试样完全溶解或分散,然后用水定容至刻度等步骤。本研究表明,婴幼儿乳粉直接用纯水定容,经95 ℃水浴30 min提取稀释后可直接检测叶酸,缩短了试样制备需要超声2~4 h。
综上所述,本文对关键试验条件优化研究,解决了接种液制备耗时长的问题;简化试样提取步骤,从而简便了操作流程,缩短了检验周期,减少多方面的干扰,具有良好的准确性和重复性,保证了试验的稳定有效。该优化方法提高工作效率,降低检验成本,适合在实验室推广和使用,对实验室开展微生物法检测乳粉中叶酸的含量具有一定的指导意义。

