维持性血液透析患者腹主动脉钙化的影响因素分析
吴恒兰 高燕红 郭银凤 陈建祥 芮艳霞 石 超 张 敏
血管钙化(vascular calcification,VC)在慢性肾脏病(chronic kidney diseases,CKD)尤其是维持性血液透析(maintenance hemodialysis,MHD)患者中普遍存在,与心血管疾病(cardiovascular diseases,CVD)的发生率及死亡率密切相关[1-2]。腹主动脉钙化(abdominal aortic calcification,AAC)是评估血液透析患者VC 的常用指标。AAC 与MHD 患者CVD 死亡率相关,可以预测未来冠状动脉疾病的发生[3-5]。本研究旨在探讨AAC 发生的相关危险因素,为ACC 的早期预防提供一定参考依据。
1 资料与方法
1.1 一般资料 选取2018 年6 月—2019 年12 月在浙江省嘉兴市第一医院肾内科接受规律血液透析治疗的164 例患者作为研究对象。本研究经医院伦理委员会审核批准(审批号:LS2020-347)。
1.2 纳入及排除标准 纳入标准:(1)年龄>18 岁;(2)MHD 治疗>3 个月,病情平稳;(3)肾小球滤过率(GFR)<15mL/(min·1.73m2)。排除标准:(1)有先天性心脏疾病、近期行心脏介入治疗或心脏瓣膜置换术;(2)近3 个月出现严重心脑血管意外;(3)合并其他严重疾病如恶性肿瘤、严重感染患者。
1.3 方 法
1.3.1 调查内容(1)采用自制一般资料记录表收集患者年龄、性别、身高、体质量、血压、糖尿病史、透析龄等基本情况,并计算体质量指数(BMI)。(2)实验室检查:透析日清晨空腹采集静脉血,检测患者血红蛋白(HB)、白蛋白(Alb)、血磷、血钙(Ca)、血清肌酐(Scr)、中性粒细胞计数、淋巴细胞计数、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDLC)、低密度脂蛋白胆固醇(LDL-C)、甲状旁腺激素(PTH)、25 羟维生素D3[25-hydroxyvitamin D3,25(OH)D3]等,计算中性粒细胞-淋巴细胞比率(neutrophils-to-lymphocytes ratio,NLR)(NLR=中性粒细胞计数/淋巴细胞计数)。
1.3.2 AAC 检测与分组 所有MHD 患者在空腹状态下进行腹部侧位片的检查,检查范围以平T12-L1、L4-L5椎间隙为界评估腹主动脉的钙化情况,由两位主治以上资历的放射科医生按照Kauppila 的评分[6]标准分别对L1-L4每个节段主动脉前壁、后壁的钙化程度进行评分,取两者平均值。根据是否存在钙化,将患者分为非钙化组(n=89)、钙化组(n=75)。
1.4 统计学方法 采用SPSS 23.0 软件进行分析。正态分布的定量资料用均数±标准差()表示,两组间比较采用独立样本t 检验;定性资料用频数(n)和百分比(%)描述,组间比较采用卡方检验。运用二元Logistic 回归分析法进行AAC 危险因素分析。P<0.05 为差异有统计学意义。
2 结果
2.1 MHD 患者AAC 单因素分析 共纳入164 例MHD 患者,AAC 发生率45.73%(75/164),单因素分析显示:钙化组年龄、透析龄、血磷、钙磷乘积、血PTH、TC、Scr、NLR、糖尿病占比高于非钙化组(P<0.05),而HDL-C、舒张压、25(OH)D3 水平明显低于非钙化组(P<0.05)。两组性别、BMI、血Ca、TG、LDLL、ALb、HB、收缩压比较无明显差异(P>0.05)。见表1。
2.2 MHD 患者AAC 的Logistic 多因素分析 以MHD 患者是否发生AAC 为因变量(0=否,1=是),将单因素分析中有统计学差异的指标作为自变量进行Logistic 回归分析,结果显示,年龄(OR=1.065)、NLR(OR=2.096)、PTH(OR=1.402)、血磷(OR=3.581)、糖尿病(OR=1.103)为MHD 患者腹主动脉钙化的危险因素(P<0.05),HDL-C(OR=0.043)、25(OH)D3(OR=0.854)为患者腹主动脉钙化的保护因素(P<0.05)。见表2。
表1 维持性血液透析患者腹主动脉钙化单因素分析()
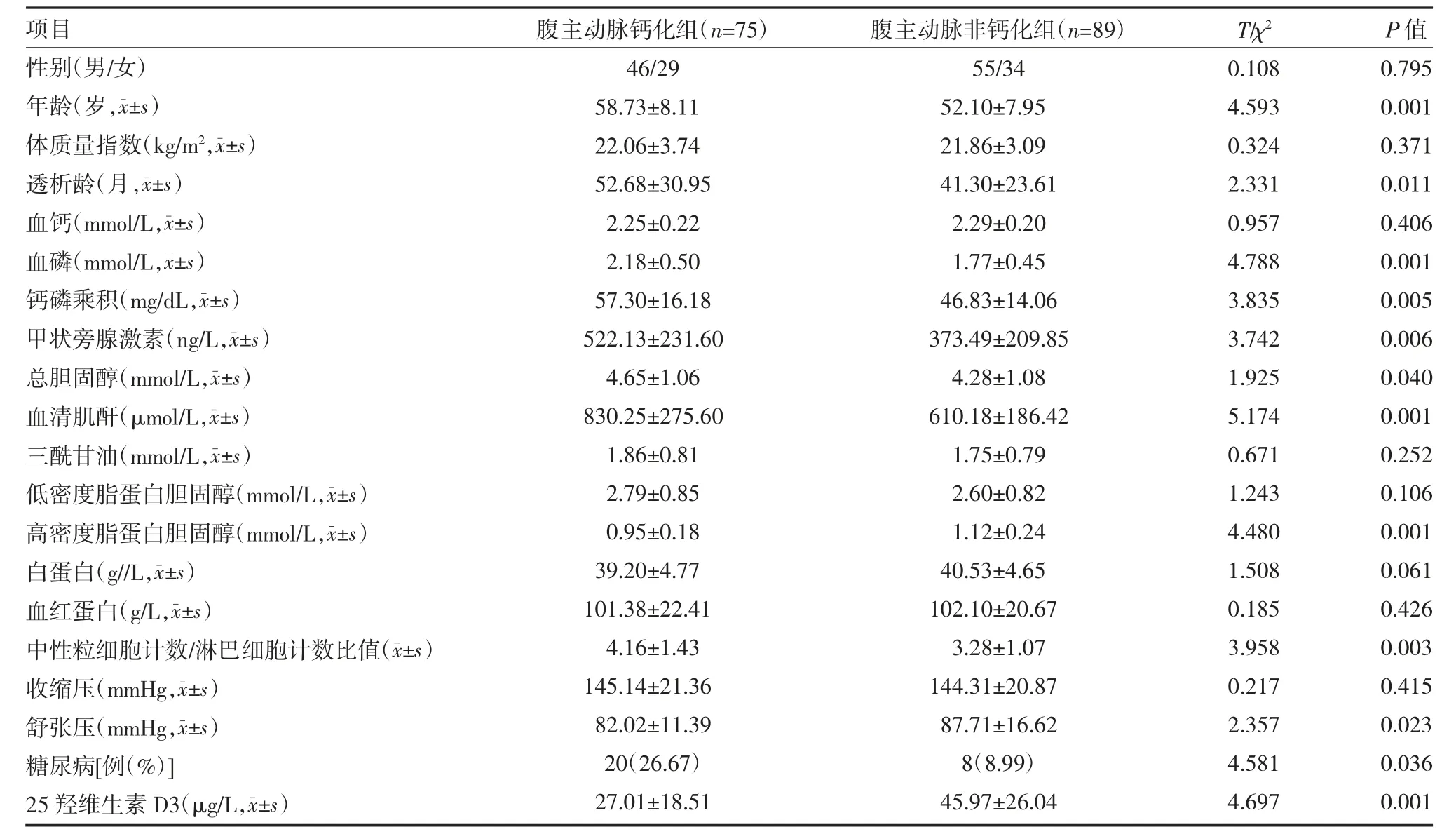
表1 维持性血液透析患者腹主动脉钙化单因素分析()
注:1mmHg=0.133kPa
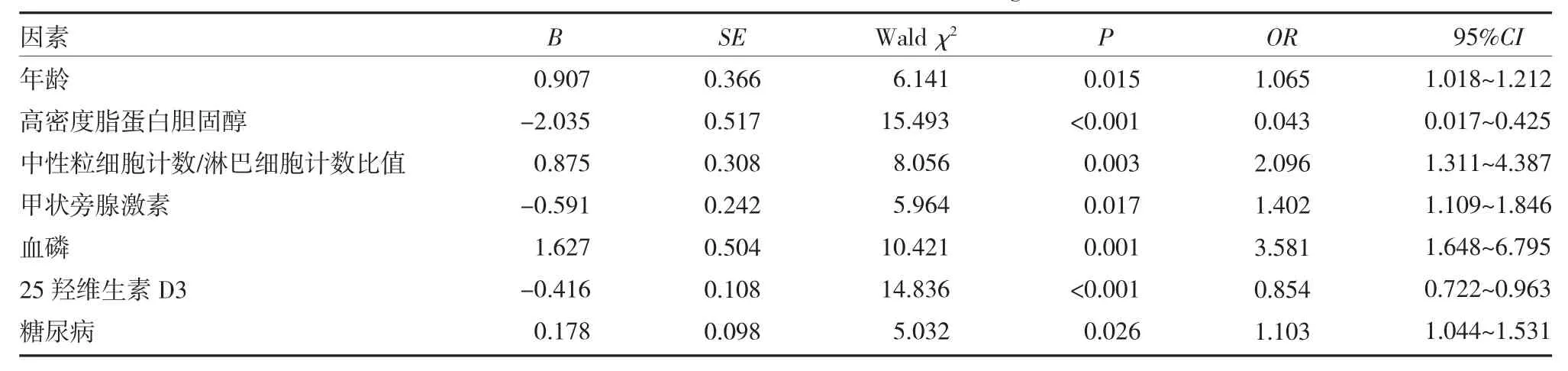
表2 影响维持性血液透析患者腹主动脉钙化的Logistic 回归分析
3 讨论
心脑血管疾病是引起MHD 患者死亡的首要病因,其中VC 是导致CVD 发生的主要致病因素,且与MHD 患者的CVD 死亡率密切相关[5]。VC 是由多基因调控,多因素参与的过程,是血管壁细胞在各种刺激因素作用下活化,具有成骨细胞样表型,类似于骨发育和软骨形成,是一个主动的、可调节的、可治疗和预防的过程。寻找能够反映VC 敏感血清学指标尤为重要[6]。
本研究Logistic 回归分析提示,高龄是AAC 的独立危险因素。随着年龄的增长MHD 患者血管中钙沉积增多,血管功能下降,血管硬化、血管内皮细胞受损以及慢性炎症的存在,容易导致VC 的发生。本研究发现,NLR 是MHD 患者AAC 的危险因素,NLR是一种新的全身炎症标志物,并已被作为一种危险分层指标,以预测几种CVD 患者的长期死亡率。NLR 结合了两个不同因素的免疫途径,能更好反映全身性炎症反应的情况,两者的失衡是全身性炎症反应的基础[7-8]。Turkmen 等[9]研究证实,NLR 可以预测ESRD 患者的炎症情况,且是VC 的危险因素。Zhou等[10]在脑卒中患者的研究发现,NLR 可能反映AAC的严重程度,可作为AAC 钙化程度的预测指标。研究发现,血磷是MHD 患者AAC 的危险因素,CKD 患者随着病情进展,肾脏排磷能力下降,且往往同时存在摄入增加、骨骼磷释放增加,导致磷在体内蓄积,发生高磷血症。高磷血症通过促使血管内皮细胞、软组织等转移性钙化,促进AAC 的发生发展[11]。研究还发现,糖尿病、PTH 是MHD 患者AAC 的危险因素,合并糖尿病的MHD 患者中由于血糖升高、糖基化终末产物增加、脂质代谢紊乱、氧化应激、慢性炎症等多因素共同作用,增加AAC 发生风险[12]。此外,高水平的PTH 同样可增加VC 的发生风险,一方面与继发性甲状旁腺功能亢进患者中钙磷代谢紊乱相关,另一方面,超生理剂量PTH 可促进血管平滑肌细胞的增殖,进而增加炎症介质或促进钙化基因的转录而导致VC 的发生[13]。
本研究发现,HDL-C、25(OH)D3 是AAC 的保护因素,与王喆等[14]报道结论相一致,HDL-C 作为重要的抗动脉粥样硬化的脂蛋白,具有逆向转运胆固醇、抗血栓、抗纤溶、清除毒性磷脂等作用,HDL-C 可降低单核细胞表达OCN,减少VC 和动脉粥样硬化[15]。Chitalia 等[16]发现,25(OH)D3 水平越低,血液流量调节舒张活性越低,内皮功能受损越严重。因此,25(OH)D3 不足或缺乏被认为导致内皮功能障碍,从而诱导或加重VC 的发生。Zhang 等[17]研究证实,补充维生素D 能够改善CKD 患者的内皮功能障碍,且小剂量的活性维生素D 治疗能够有助于预防VC,而不增加钙磷负荷。
综上所述,高龄、糖尿病、NLR、PTH、血磷水平升高及HDL-C、25(OH)D3 水平下降与MHD 患者AAC 的发生密切相关。

