减压耦合超声法提取桑叶脱氧野尻霉素及降血糖活性研究
刘 荣,李晓东,毕文玥
(1.东北林业大学 林学院,黑龙江 哈尔滨 150040;2.黑龙江省森林食品资源利用重点实验室,黑龙江 哈尔滨 150040)
我国有着丰富的桑Morus albaL.资源,凭借4 000 多年的桑树栽培史和近百万公顷的桑园,成为了世界上最大的桑树种植国[1]。桑叶,又名铁扇子,品种繁多,包括蒙桑、鸡桑、川桑、华桑等10 多个品种[2]。据报道目前桑叶被许多国家的人们用来制作成菜肴、饮品等[3]。桑叶是一种重要的林下食品资源,营养十分丰富,具有多种生物活性[4]。现如今,很多企业因其营养价值,将其开发成桑叶饮料、桑叶泡菜、桑叶咀嚼片等产品,在带给人们健康的同时,减少了桑资源的浪费。现代药理学研究发现桑叶中含有的一种多羟基生物碱—脱氧野尻霉素(Deoxynojirimycin,DNJ)[5],结构与葡萄糖类似,它以自身NH 基团取代了吡喃糖环上的氧原子[6],可通过抑制α-葡萄糖苷酶、蔗糖酶等达到降血糖效果,是降血糖的主要活性成分[7]。Hansawasdi 等[8]通过研究桑叶水提取液对α-葡萄糖苷酶抑制作用,测定Caco-2 细胞单层顶端和基底侧细胞外释放的葡萄糖浓度,表明其具有良好的降血糖功能。
桑叶作为我国林下资源的重要组成部分,早在20世纪80年代我国学者就对桑叶进行了研究,内容集中在种植培育、生长环境和营养成分分析等方面[9],对桑叶DNJ 提取新技术层面的研究甚少。目前,DNJ 提取常用方法主要包括:微波提取法[10]、超声提取法[11]、水提法[12]、酶提取法[13]等。胡瑞君等[10]利用微波萃取技术提取桑叶DNJ,最终测得DNJ 提取率仅为0.024%;花俊丽等[11]采用超声波辅助醇法提取桑叶DNJ,并对提取条件进行了优化,最终测得DNJ 得率为0.091%;Vichasilp 等[12]为使桑叶茶中DNJ 最大限度的发挥作用,采用响应面优化热水浸提法提取桑叶DNJ,最终得到DNJ 含量为0.3%;赵翔[13]对比了传统酸提法与纤维素酶法对桑叶DNJ 提取率的影响,发现纤维素酶法对DNJ 提取效果更好,又在纤维素酶法的基础上采用超声辅助技术对DNJ进行提取,最终得到DNJ 提取率为0.106 6%。在上述方法中,超声波法在DNJ 提取方面应用较为广泛。超声波法可将自身的空化效应、机械效应、热效应3者结合起来,促使细胞内容物快速溶出[14],且在提取过程中无明显的加热现象,有利于活性物质的保留[15]。而减压法是通过真空泵抽取提取容器中的空气,使容器内压力减小,提取液沸点降低,从而缩短提取时间[16]。据文献报道,有学者将两种方法联合用来提取薇菜黄酮[16]、杏鲍菇多糖[17]等物质,提取效果较好。减压耦合超声法正在向各个领域蔓延,但其在提取桑叶DNJ 方面的研究尚无报道。本研究采用减压耦合超声法对桑叶中的DNJ 进行提取,在单因素的基础上通过响应面法对提取工艺进行了优化,并对其降血糖活性进行了研究,以期为建立桑叶DNJ 提取新技术及其营养价值的开发提供参考。
1 材料与方法
1.1 供试材料
桑叶,品种为云桑2 号,购于四川省凉山州德昌县。
1.2 试剂与仪器
试剂:DNJ 标准品(Deoxynojirimycin,纯度≥98%),购于美国Sigma 公司;氯甲酸-9-芴基甲酯(9-fluorenylmethyl chloroformate,FMOCCl,纯度≥99%,色谱纯),购于美国Sigma 公司;甘氨酸(纯度≥99%)、乙腈、醋酸(均为色谱纯)、α-葡萄糖苷酶(α-Glucosidase)、4-硝基苯-α-D-吡喃葡萄糖苷(p-nitrophenyl-β-D-galactopyranoside,pNPG)、蔗糖酶、蔗糖、阿卡波糖,购于上海源叶生物有限公司;其他试剂均为分析纯。
仪器:分析天平,上海佑科仪器仪表有限公司;中草药粉碎机,天津市泰斯特仪器有限公司;电热鼓风干燥箱,上海一恒科学仪器有限公司;酶标仪,BioTek Instruments,Inc.美国;SHB-IIIG减压耦合超声设备为实验室自制;循环水式多用真空泵,郑州长城科工贸有限公司;旋转蒸发仪,巩义市予华仪器有限责任公司;美国Waters1525高效液相色谱仪(Waters2487 双通道紫外可见检测器,Waters1525 二元泵,717 自动进样器);KQ-300DE 超声波清洗机,昆山市超声仪器有限公司。
1.3 方 法
1.3.1 原料预处理
将新鲜的桑叶清洗干净,放置于40℃左右的烘箱中烘干至恒质量,粉碎机粉碎过40 目筛,置于-20℃冰箱中冷冻备用。
1.3.2 减压耦合超声波设备的设计
取一定量冻藏的桑叶粉末,将其倒入圆底烧瓶中,加入一定比例65%的乙醇溶液,按图1所示,连接装置,并使圆底烧瓶内液体液面浸没在超声仪中水液面以下,打开真空泵,此时提取容器内气压迅速下降,再启动超声设备,在一定超声条件下进行提取,收集提取液。
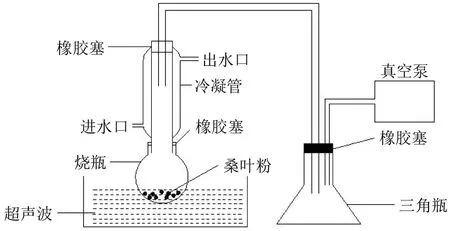
图1 减压耦合超声装置Fig.1 Decompression coupled ultrasound device
1.3.3 DNJ 衍生化与HPLC 分析
参照Kim 等[18]的方法,稍作修改。用移液枪吸取DNJ 提取液或DNJ 标准溶液100 µL 于离心管中,加入0.4 mol/L 硼酸钾缓冲液100 µL(pH值为8.5),震荡摇匀,加入5 mmol/L 的FMOCCl 溶液150 µL,25℃水浴20 min 后,加入1 mol/L甘氨酸溶液50 µL 终止反应,加入0.1%的醋酸溶液100 µL 使衍生物(FMOC-DNJ)稳定,400 µL超纯水稀释,经0.22 µm 滤膜过滤,即得待测液。
DNJ 的HPLC 色谱条件为:色谱柱:HiQSiLC18 分析柱(5 μm,250 mm×4.6 mm),检测波长为254 nm;流动相:乙腈-0.5%醋酸(体积比为65:35);流速:1 mL/min;柱温:30℃;进样量:3 µL,每个样品重复进样3 次。
1.3.4 DNJ 标准曲线的建立
称取5 mg DNJ 标准品于小烧杯中,加入少量65%乙醇溶解,移入10 mL 容量瓶中定容,将其配制成(5、10、20、40、80 μg/mL)的标准溶液,按1.3.3 方法衍生化后,对其含量检测。以DNJ 标准品的质量浓度为横坐标,峰面积为纵坐标,绘制标准曲线。
求得DNJ 的标准曲线方程为y=911.32x-123,R2=0.999 4。式中:y为峰面积;x为DNJ 质量浓度,µg/mL。相关系数为R2为0.999 4,得出DNJ 浓度在5~80 µg/mL 范围内与峰面积呈良好的线性关系。
1.3.5 FMOC-DNJ 稳定性及HPLC 方法学考察试验
参照文献[13],对FMOC-DNJ 的稳定性,HPLC 检测方法精密度、重复性及加样回收率进行测定。
1.3.6 单因素试验
准确称取干燥桑叶粉5.00 g,在前期预试验基础上,选出最佳单因素范围,分别为料液比(1∶10、1 ∶20、1 ∶30、1 ∶40、1 ∶50(g ∶mL));超声温度(45、55、65、75、85℃);超声时间(20、30、40、50、60 min);超声功率(320、400、480、560、640 W);乙醇体积分数(45%、55%、65%、75%、85%);真空度(0.00~0.02、0.02~0.04、0.04~0.06、0.06~0.08、0.08~0.10 MPa)。研究6 种因素不同水平对DNJ 得率的影响,为减小误差每组试验做3 组平行试验。
1.3.7 DNJ 的制备与得率的计算
将5 g 处理好的桑叶粉末置于圆底烧瓶中,按照一定料液比加入65%乙醇溶液,经减压耦合超声波法制备后,抽滤两次,保留滤液,4 000 r/min离心15 min,取一定量上清液按1.3.3 方法进行衍生化后进行测定,代入回归方程,按公式计算:

式(1)中:Yi为得率(mg·g-1);c为DNJ 质量浓度(mg·mL-1);n为稀释倍数;v为提取液体积(mL);m为桑叶粉总质量(g)。
1.3.8 减压耦合超声波法提取DNJ 响应面优化试验
在单因素试验的基础上,通过Plackett-Burman (PB)试验筛选出对DNJ 得率影响最显著的3 个因素(P<0.05),分别为超声功率、超声时间、乙醇体积分数。其它非显著因素的试验条件按照单因素试验的最优条件进行,以超声功率(A)、超声时间(B)、乙醇体积分数(C)为自变量,DNJ 得率(Y)为响应值,运用响应面分析软件Design-Expert 8.0.5 建立的Box-Benhnken Design(BBD),设计3 因素3 水平响应面试验。试验设计的因素水平及编码见表1。
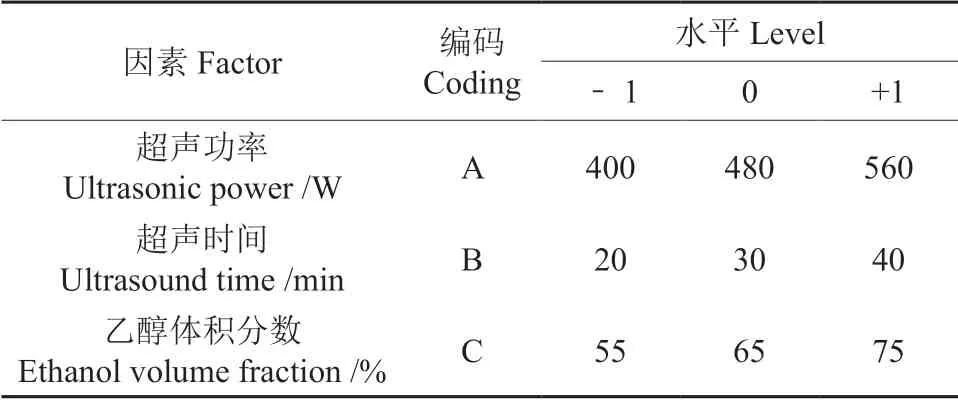
表1 Box-Behnken 试验因素和水平Table 1 Box-Behnken test factors and levels
1.3.9 DNJ 体外降血糖活性
1.3.9.1 α-葡萄糖苷酶抑制率试验
参照Kim 等[18]的方法,稍作修改。精密量取0.5 mg/mL 桑叶DNJ 提取液50 μL 于96 孔板中,加入3 U/mL 的α-葡萄糖苷酶溶液50 μL,用移液枪头吹打混匀,37℃条件下水浴15 min,加入10 mg/mL的pNPG溶液50 μL,37℃水浴10 min后,加入1 mol/L 的Na2CO3溶液80 μL 终止反应,震荡使之混合均匀。以阿卡波糖为阳性对照,用酶标仪在405 nm 波长处测定吸光值。本试验共设置6 组分别为:A0,酶液+底物;A1,样品+底物;A2,酶液+样品+底物;A3,样品。每组做3 次平行试验,按公式(2)计算抑制率。

式(2)中:RI为抑制率;A0为空白组吸光度;A1为样品背景组吸光度;A2为样品组吸光度;A3为样品对照组吸光度。
1.3.9.2 蔗糖酶抑制率的测定方法
参照Kim 等[19]的方法,稍作修改。精密量取0.5 mg/mL 桑叶DNJ 提取液50 μL 于96 孔板中,加入蔗糖酶溶液50 μL,37℃下水浴10 min,加入1 mol/L 蔗糖溶液50 μL,37℃水浴30 min 后,加入0.05 mol/L 的Tris-HCl (pH 值为8.8)缓冲液100 μL 终止反应,震荡使二者混合均匀,以阿卡波糖为阳性对照,用酶标仪在540 nm 波长处测定吸光值。本试验共设置5 组分别为:A0,酶液+底物;A1,样品+底物;A2,酶液+样品+底物;A3,样品。每组做3 次平行试验,按照公式(2)计算抑制率。
2 结果与分析
2.1 FMOC-DNJ 稳定性试验
精密称取同一样品溶液100 µL,按1.3.3 方法进行衍生化处理,使DNJ 与FMOC-Cl 反应生成衍生物FMOC-DNJ,将衍生化后的DNJ 提取液置于4℃冰箱中,设置3 个平行样,分别放置0、1、2、3、4、5、6、7、8、9、10、11、12 h 后,依次检测DNJ含量。如表2所示,FMOC-DNJ衍生物在4℃条件下放置5 h,含量改变较小,而到了6 h 含量开始大幅度下降,说明DNJ 衍生化后的产物在5 h内十分稳定,故在试验过程中数据应尽量在5 h 之内测定。
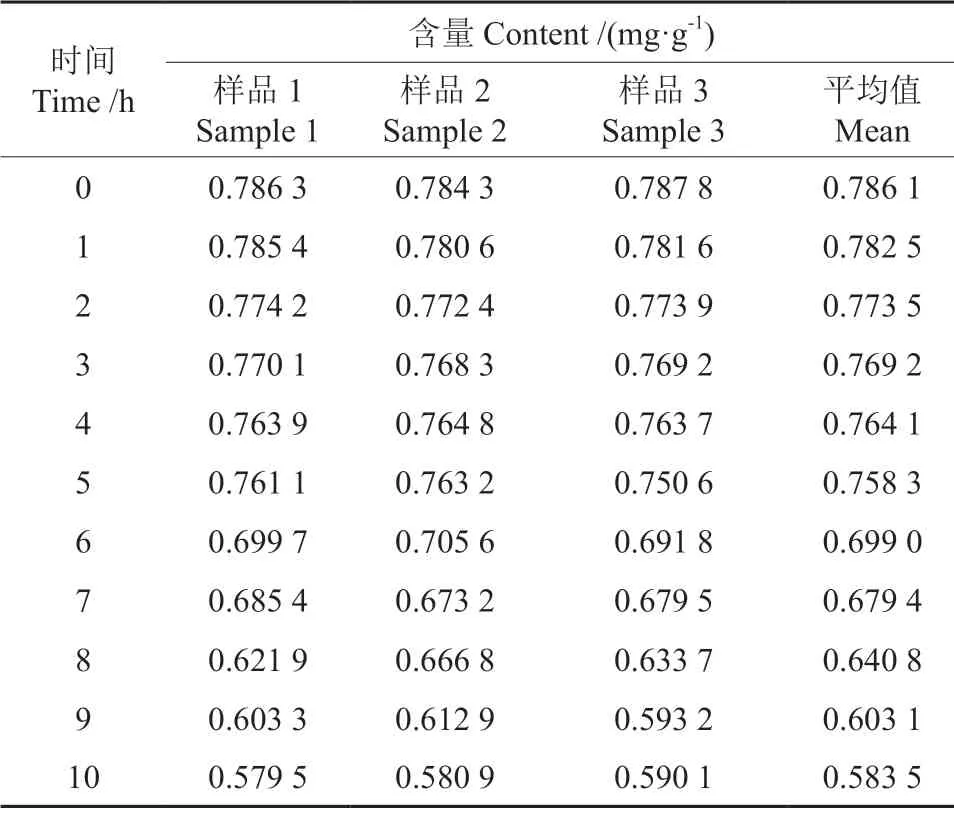
表2 稳定性试验Table 2 Stability test
2.2 精密度试验
精密吸取同一样品溶液100 µL,按1.3.3 方法进行衍生化处理后,重复6 次进样,分别测定DNJ 含量,计算相对标准偏差(RSD 值)。如表3所示,通过计算得RSD 值为0.480 0%(n=6),表明该检测方法精密度良好。
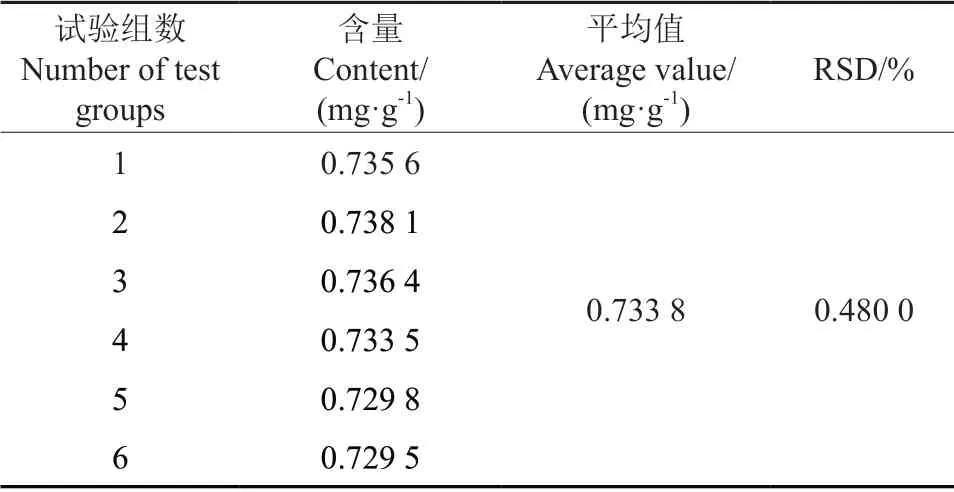
表3 精密度试验Table 3 Precision test
2.3 重复性试验
取同一桑叶样品平行制备6 份,分别精密吸取100 µL,衍生化处理后,分别测定6 份提取液中DNJ 含量,计算RSD 值。如表4所示,6 份平行样品的含量平均值为0.645 1 mg/g,RSD 值为1.370 0%(n=6),表明该检测方法具有良好重复性。

表4 重复性试验Table 4 Repeatability test
2.4 加样回收率试验
取同一桑叶粉末6 份,各1 g,按1.3.7 方法进行制备,分别测定DNJ 含量,再向6 份桑叶提取液中加入0.502 3 mg/mL DNJ 标准溶液1 mL,混匀后按1.3.3 方法进行衍生化处理并测定DNJ 含量,计算回收率及RSD 值。如表5所示,6 份样品的DNJ 平均回收率为94.7%,RSD 值为1.460 0%(n=6)。

表5 加样回收率试验Table 5 Sample recovery rate test
2.5 单因素试验结果
2.5.1 料液比对DNJ 得率的影响
从图2可以看出,在提取过程中,当料液比在1∶10~1∶40(g:mL)范围内,随着提取溶剂量的增加DNJ 得率呈明显增大趋势,且曲线较陡,DNJ 得率最高为0.73 mg·g-1;而当料液比在1∶40~1∶50(g:mL)范围内时,DNJ 得率有下降趋势。在桑叶组织中,DNJ 以氢键的形式与蛋白质,多糖和其他物质结合,而有机溶剂和水的混合物可以有效地抑制这种结合,并且料液比增加,体系传质动力增加,DNJ 更易溶出[20];固相和液相之间不仅存在扩散—溶解平衡,还存在吸附平衡。低温有利于吸附,由于溶剂量的增加,提取液的温度在产生相同热量的条件下降低,致使吸附作用增强[21],DNJ 得率下降,因此选择最佳料液比为1:40(g:mL)。

图2 料液比对DNJ 得率的影响Fig.2 Effect of feed-to-liquid ratio on DNJ yield
2.5.2 超声温度对DNJ 得率的影响
从图3可以看出,当超声温度在45~65℃范围内时,DNJ 得率随超声温度的升高而显著增加,当超声温度达到65℃时,DNJ 得率最高达到0.87 mg·g-1,这是由于乙醇沸点低,并且易于在低压条件下达到沸腾状态,能迅速减小溶液的浓度差。同时,由于沸腾是通过液体内部溶液的汽化形成的,即由于存在从浸润的植物细胞内的溶液液体分子的汽化产生微小汽泡并迅速长大和膨胀的作用,加快有效成分向溶液中的扩散速度[22]。在65~85℃范围内,DNJ 得率随超声温度的升高而降低,这是由于温度过高破坏DNJ 的活性[23],从而使DNJ 得率下降。Mantegna 等[24]认为过高的温度会引起表面张力的降低和空化泡内蒸汽压力的增加,造成超声波的阻尼。因此选择最佳超声温度为65℃。

图3 超声温度对DNJ 得率的影响Fig.3 Effect of ultrasonic temperature on DNJ yield
2.5.3 超声时间对DNJ 得率的影响
从图4中可以看出,当超声时间在20~30 min范围内,DNJ 得率呈显著上升趋势,这是由于环境处于负压状态,可促进细胞间质DNJ 短时间内最大效率溶出[25];当超声时间为30 min 时,DNJ提取率最大为0.93 mg·g-1。当超声时间在30~60 min 时,DNJ 得率呈显著下降趋势,此现象说明,超声时间过长会破坏DNJ 的内部结构[26],影响最终测定结果。因此选择最佳超声时间为30 min。

图4 超声时间对DNJ 得率的影响Fig.4 Effect of ultrasound time on DNJ yield
2.5.4 超声功率对DNJ 得率的影响
观察图5可以发现,当超声功率在320~480 W范围内,DNJ 得率呈显著上升趋势,当其达到480 W时,DNJ 得率最大为1.01 mg·g-1,这说明随着超声功率的增强桑叶细胞破碎程度也更剧烈,易形成空化泡,且空化泡的崩解也更加剧烈[27],DNJ得率随之增大;当超声功率480~640 W 范围内,随着超声功率的增大DNJ 得率呈下降趋势,这是由于超声功率持续增大,体系内部产生的空化泡过大,导致空化泡崩解困难,故空化作用降低[28],DNJ 得率出现递减趋势。Boudries 等[29]认为超过一定能量后反而会破坏提取物质的结构,同时会使空化趋于饱和,产生大量无用的气泡,这会增加散射衰减并降低空化强度,从而导致提取速率迅速降低。因此选择最佳超声功率为480 W。

图5 超声功率对DNJ 得率的影响Fig.5 Effect of ultrasound power on DNJ yield
2.5.5 乙醇体积分数对DNJ 得率的影响
分析图6可以发现,乙醇体积分数在45%~65%范围内,DNJ 得率显著增大,当乙醇的体积分数达到65%时,DNJ 得率最大可达0.69 mg·g-1;当乙醇体积分数在65%~85%范围内,DNJ 得率呈下降趋势,此现象说明,随着乙醇体积分数的增大,其它更易与乙醇结合的物质大量溶出,与DNJ 形成竞争关系,故此时的DNJ 得率有下降趋势[30]。因此选择最佳乙醇体积分数为65%。

图6 乙醇体积分数对DNJ 得率的影响Fig.6 Effects of ethanol volume fraction on DNJ yield
2.5.6 真空度对DNJ 得率的影响
从图7中可以看出,当真空度在0.00~0.02 MPa时,由于此时提取容器内的气压接近常压,因此DNJ 得率较低为0.61 mg·g-1,但随着真空度的增加,DNJ 得率显著增大,当真空度在0.08~0.10 MPa 范围内,DNJ 得率达到最大1.23 mg·g-1,此现象说明:低压时提取容器内空气稀薄,提取溶剂内的提取物受到的外力减小,分子链变大,需要打破分子链的能量降低[31],因此,DNJ 更易溶出。因此选择最佳真空度为0.08~0.10 MPa。

图7 真空度对DNJ 得率的影响Fig.7 Effects of vacuum on DNJ yield
2.5.7 响应面优化试验结果
为了进一步确定减压耦合超声法提取桑叶DNJ 的最佳工艺条件,选择了超声功率,超声时间和乙醇体积分数3 个因素,并通过响应面法对DNJ 的得率进行了分析。响应面试验设计及结果见表6,方差分析见表7。
利用Design-Expert 8.0.5对试验结果进行分析。试验结果见表6,将试验数据进行多元回归拟合得到DNJ 得率Yi与超声功率(A)、超声时间(B)、乙醇体积分数(C)的二次多项式回归方程为:由表7可知,该模型因变量与自变量之间线性关系良好,并且该模型R2=97.94%,R2adj=95.29 %,整体模型F=36.93,P<0.000 1,表明该模型极显著,即该试验方法是可靠的。由表7还可以看出,失拟项F=4.81,P=0.081 6,失拟项不显著,表示该模型选择正确,其中调整系数为R2adj=95.29%,表明95.29%的响应面值变化可以通过模型表达,相关系数R2=97.94%,说明该模型与试验拟合度良好。根据F值可知,各因素对DNJ 得率的影响顺序为乙醇体积分数(C)>超声时间(B)>超声功率(A)。根据回归方程获得响应面图和等高线图。

表6 响应面试验设计及结果Table 6 Response surface test design and results

分析图8~10 可以得出超声功率(A)、超声时间(B)、乙醇体积分数(C)对DNJ 得率的影响。如图8所示,超声功率(A)与超声时间(B)之间的相互作用具有曲面陡峭和曲率较大的特点,因此二者的交互作用极显著;从图9可以看出,超声功率(A)与乙醇体积分数(C)之间的相互作用曲面较平缓,等高线图呈圆形,故交互作用不显著;从图10可以看出,超声时间(B)与乙醇体积分数(C)交互作用曲面趋于平滑,故交互作用显著。当等高线呈现密集的椭圆形或马鞍形时说明两者交互作用显著;当呈现圆形时表明交互作用不显著,这与方差分析结果相符[32]。
2.6 最佳条件的确定和回归模型的验证
采用减压耦合超声提取桑叶DNJ 的最佳工艺条件为:料液比1:40(g:mL)、超声温度65℃、超声时间24.25 min、超声功率464.10%、乙醇体积分数69.05%、真空度0.08~0.10 MPa,此条件下DNJ 得率为(1.07±0.03)mg·g-1。为 增强实际生产中的可控制性,调整工艺为:料液比1∶40(g:mL)、超声温度65℃、超声时间24 min、超声功率480 W、乙醇体积分数69%、真空度0.08~0.10 MPa,在此条件下DNJ 得率为(1.10±0.02)mg·g-1,与理论值接近。同时,说明采用响应面法优化得到的最佳提取条件具有良好的可行性。
2.7 与单一超声波法提取效果比较
在料液比1∶40(g:mL)、超声温度65℃、超声时间24 min、超声功率480 W、乙醇体积分数69%条件下,比较单一超声波法与减压耦合超声法(真空度0.08~0.1 MPa)对桑叶DNJ 的提取效果,结果表明:单一超声提取法的DNJ 得率为(0.67±0.04)mg·g-1。而减压耦合超声波法的DNJ 得率为(1.10±0.02)mg·g-1,较单一超声波法提高了64.18%(P<0.01),说明减压耦合超声波法提取效果优于单一超声法,在桑叶DNJ 提取方面具有一定的应用前景。

表7 方差分析†Table 7 Variance analysis
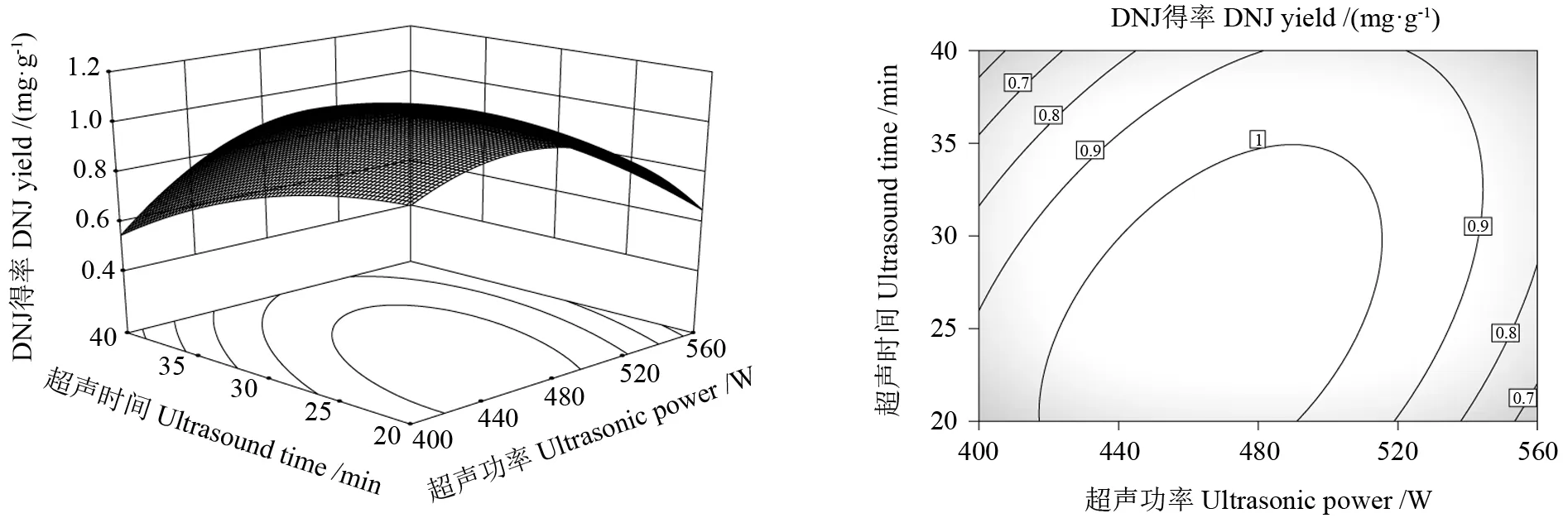
图8 超声功率与超声时间交互作用与等高线Fig.8 Ultrasonic time and ultrasonic power interaction and contour line
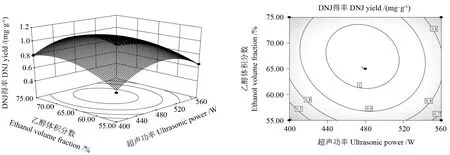
图9 超声功率与乙醇体积分数交互作用与等高线Fig.9 Interaction between ethanol volume fraction and ultrasonic power and contour
2.8 DNJ 得率与体外降血糖活性相关性分析
为了考察DNJ 得率与降血糖活性的相关性,分别对响应面17 组试验进行α-葡萄糖苷酶抑制率和蔗糖酶抑制率试验,结果见表8。
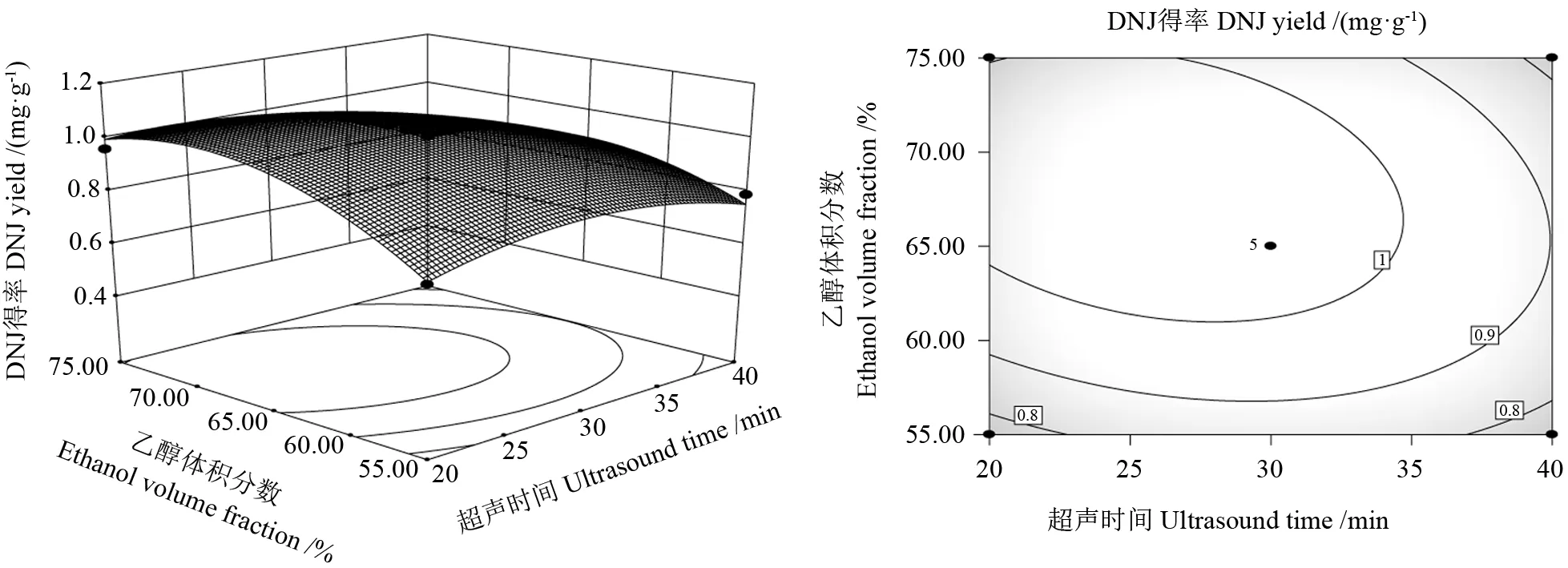
图10 超声时间与乙醇体积分数交互作用与等高线Fig.10 Interaction between ethanol volume fraction and ultrasonic time and contour line
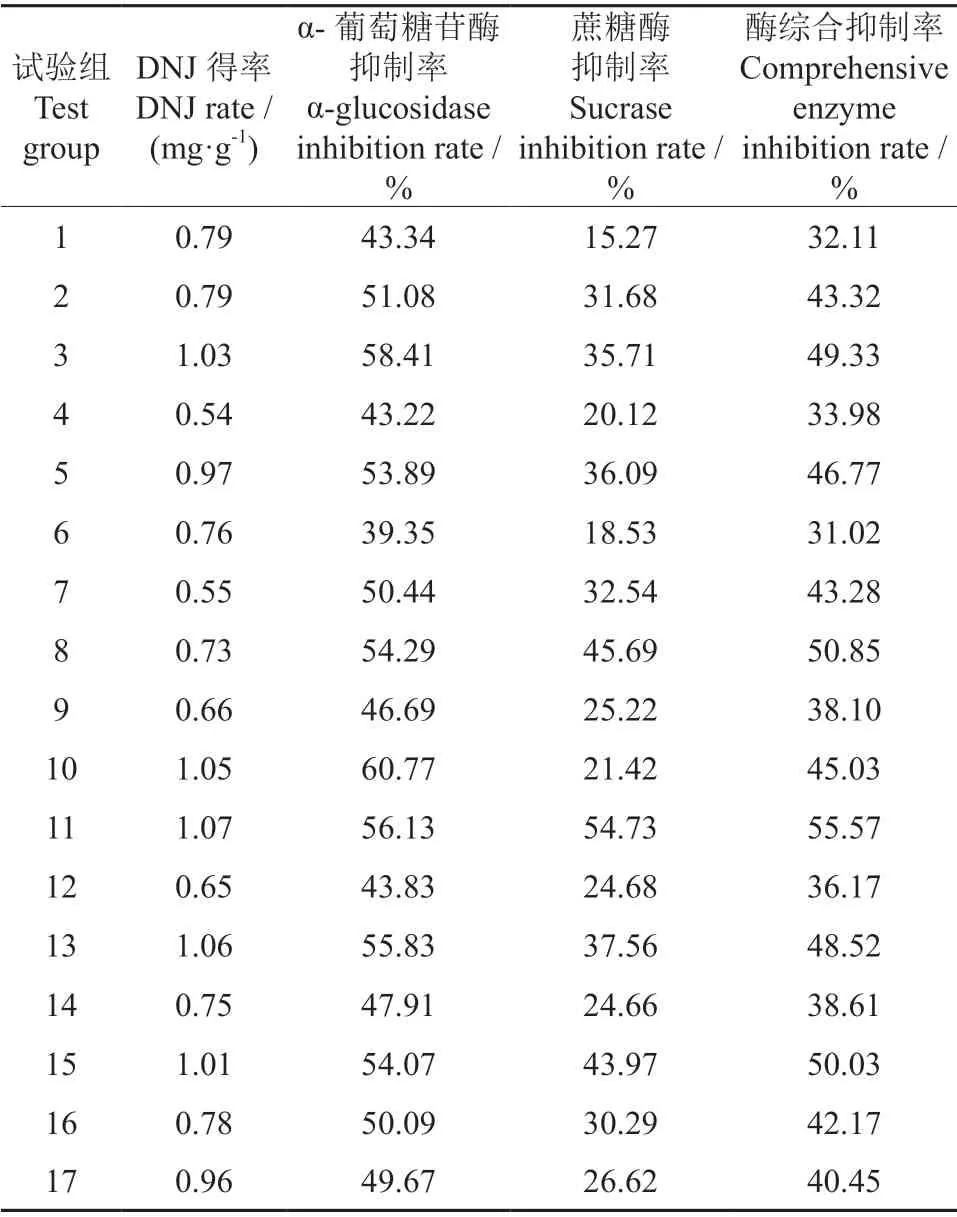
表8 不同DNJ 得率下的酶综合抑制率†Table 8 Comprehensive inhibition rate of enzymes under different DNJ yields
使用IBM SPSS 软件对DNJ 得率与酶综合抑制率进行相关性分析,结果表明,DNJ 得率与酶综合抑制率的相关系数r=0.719(P<0.05),表明两者之间呈显著正相关。
2.9 DNJ、阿卡波糖对α-葡萄糖苷酶、蔗糖酶抑制率IC50 的测定

图11 不同质量浓度DNJ、阿卡波糖对α-葡萄糖苷酶抑制率的影响Fig.11 Effects of different concentrations of DNJ and acarbose on the inhibition rate of α-glucosidase

图12 不同质量浓度DNJ、阿卡波糖对蔗糖酶抑制率的影响Fig.12 Effects of different concentrations of DNJ and acarbose on the inhibition rate of invertase
由图11~12 可知,在一定浓度范围内,DNJ 和阿卡波糖对α-葡萄糖苷酶、蔗糖酶抑制率走势基本相同,均随着质量浓度的增大而增大。其中DNJ、阿卡波糖对蔗糖酶抑制率整体趋势低于其对α-葡萄糖苷酶的抑制率。通过IBM SPSS计算得DNJ、阿卡波糖对α-葡萄糖苷酶抑制作用 的IC50分别为0.770、0.505 mg·mL-1;DNJ、阿卡波糖对蔗糖酶抑制作用的IC50分别为1.772、0.609 mg·mL-1,结果表明,阿卡波糖降血糖效果略高于DNJ,这与一些已有研究报道的结果有一定的差异,这可能是由于DNJ 提取方法、品种产地等诸多因素的不同导致的。
3 结论与讨论
α-葡萄糖苷酶和蔗糖酶是评估降血糖活性的常见指标,酶的抑制率越高,降血糖活性越强。本研究在单因素试验的基础上,以DNJ 得率为指标,通过响应面试验确定最佳工艺条件为:料液比1∶40(g:mL)、超声温度65℃、超声时间24 min、超声功率480 W、乙醇体积分数69%、真空度0.08~0.10 MPa,此条件下DNJ 得率为(1.10±0.02)mg·g-1。参照Kim 等[18]的方法使用HPLC法测定DNJ 含量,在其基础上对衍生化产物FMOC-DNJ 进行了稳定性试验,得出FMOC-DNJ在4℃的环境中放置5 h,稳定性较好,在放置6 h 后其含量发生大幅度下降。并对HPLC 法测定DNJ 含量进行了方法学考察,得出将密度、重复性、加样回收率试验的RSD 值分别为0.48%、1.37%、1.46%,表明该方法精准可靠,可以应用于桑叶DNJ 的检测。考察DNJ 得率与降血糖活性之间相关性,结果表明,DNJ 得率与降血糖活性之间存在良好的相关性r=0.738(P<0.05)。测得DNJ对α-葡萄糖苷酶、蔗糖酶抑制作用的IC50值分别为:0.770、1.772 mg·mL-1。研究表明,在一定条件下,减压耦合超声波法对DNJ 的提取效果高于单一的超声波提取法,且两种方法联合提取可有效保持桑叶DNJ 的降血糖活性。
随着果汁饮料的普及和以桑葚为原材料的功能性食品的开发,DNJ 作为此类产品的主要功能成分,直接影响了产品的质量[33],所以将桑叶中DNJ 最大限度的提取出来变得至关重要。目前,国内外学者对桑叶DNJ 的研究主要集中在活性成分等方面,对其提取新技术方面的研究较少,因此本研究将一种新型提取方法应用在DNJ 提取方面,以期为建立桑叶DNJ 提取新技术奠定基础。
减压与超声波法的结合,综合了两种方法的优点,提高了DNJ 的提取效率,降低生产成本,且良好保留桑叶DNJ 的降血糖活性,但本研究仅研究了减压耦合超声法这一种提取方法对DNJ 得率及其降血糖功能的影响,其他新型的提取方法能否更高效率的提取桑叶DNJ还有待进一步探究。刘颖坤等[34]采用超声耦合双水相萃取技术对叶百部生物碱进行提取,并与传统加热回流法进行对比,发现超声耦合双水相萃取技术提取效果更好,这是因为在提取过程中,生物碱转移至上层有机相,从而改变了提取过程中的化学平衡,有利于生物碱的溶出。沈红等[35]分别对比分析了半仿生提取法、水煎煮法、温浸法、酸性乙醇回流提取法、水蒸气蒸馏5 种方法对麻黄碱的提取效果的影响,发现半仿生的提取效果最好,半仿生提取法生产周期短、生产成本低,且能保留物质原有的活性成分,被认为是有希望替代传统提取方法的新技术。此外,生物碱的新型提取技术还包括:离子液体辅助法、高剪切联合超声波法、微波-光波-超声波联合法以及低共熔溶剂萃取法等。因桑叶DNJ 是一种多羟基生物碱,所以大多数生物碱的提取方法均可应用到桑叶DNJ 的提取中。此外由于该提取方法仅在实验室进行了初步的探究,由于工厂设备、仪器以及环境等各方面因素都可能会影响DNJ 的提取效果及降血糖活性,小剂量试制阶段、中试阶段及工业级别的影响还有待进一步考究[36]。在桑叶DNJ 提取过程中会有很多非目标性物质溶出,导致DNJ 的纯度较低,传统的分离纯化方法很难大幅提升其纯度,所以了解、掌握、寻求新的桑叶DNJ 分离纯化技术依然是今后的研究重点。

