饮水中添加复合维生素纳米乳对生长獭兔生长性能、免疫功能、抗氧化能力、肠道组织结构及盲肠微生态的影响
叶翔杨 宫瑞光 任战军*
(1.西北农林科技大学动物科技学院,杨凌 712100;2.广东省农业科学院动物科学研究所,畜禽育种国家重点实验室,农业农村部华南动物营养与饲料重点实验室,广东省畜禽育种与营养研究重点实验室,广州 510640)
维生素是一类生理功能和营养意义相似的有机化合物,参与机体代谢调节,维持人和动物正常生理功能。维生素在动物体内不能合成或合成量不足,只能从食物或饲料中摄取。然而,在饲料生产和贮藏都会对饲料中维生素含量产生影响。目前,国内外普遍认为在配合饲料加工中,温度、水分、压力、调质时间、摩擦等是影响维生素稳定性的主要因素。有研究显示,维生素在饲料热加工过程中损失很大,尤其是维生素A,其活性可降低30%~50%[1]。目前常通过过量添加的形式来补充维生素在饲料配制过程中的损失,但这种方式成本高、浪费大。
纳米乳又称微乳,是由油相、水相、表面活性剂及助表面活性剂,以适当比例混合形成的一种透明或半透明、低黏度的热力学稳定体系,其粒径一般介于1~100 nm。它被广泛地应用于封装亲脂性生物活性成分(脂溶性维生素或营养素),加入以水为基质食品中,具有很高的光学清晰度,就像强化水、软饮料、果汁等[2]。纳米乳由于其粒径小、表面活性剂和助表面活性剂浓度高,可提高封装元件的生物利用度[3]。大量资料表明,纳米乳具有制备简单、安全性高、热力学稳定、能增大难溶性药物溶解度、提高易水解药物稳定性、吸收率高等优点。
纳米乳技术在食品和药物加工中已广泛应用,而在动物营养方面研究较少,尤其是家兔方面未见研究报道。本试验以獭兔为研究对象,采用纳米乳技术将脂溶性维生素A、维生素D、维生素E和水溶性维生素B1、维生素B6、生物素、泛酸、烟酸、胆碱复合制成维生素乳液,并对其品质进行鉴定,通过饮水添加给獭兔,测定该复合维生素纳米乳对生长獭兔生长性能、免疫功能、抗氧化能力、肠道组织结构及盲肠微生态的影响,以期开发一种安全、稳定、高效、品质可控的兔用复合维生素饮品,为獭兔高效补充维生素提供理论依据。
1 材料与方法
1.1 试验设计
根据谷子林等[4]推荐的断奶后生长育肥獭兔饲粮中维生素含量,按照1 mL复合维生素纳米乳中各维生素的供应量等于1 kg饲粮中各维生素的供应量,确定复合维生素纳米乳中的各维生素含量,详见表1。采用自发乳化法制备复合维生素纳米乳,即在常温、常压下,将配方量的km(表面活性剂吐温-80∶助表面活性剂丙三醇=3∶1)与油相(维生素A油、维生素D油和维生素E油混合物)混合,搅拌均匀,然后向体系中缓慢滴加水相(含配方量水溶性维生素泛酸钙、烟酰胺、生物素、维生素B1、维生素B6、胆碱的水溶液),km∶油相∶水相为4∶1∶15。开始时体系黏度较低,随着水相的加入,体系会出现由稀变黏的过程,继续滴加,体系又会由黏变稀,最后将水相全部加入体系中,即形成稳定的复合维生素纳米乳。用高效液相色谱法对复合维生素纳米乳中各维生素的含量进行测定,结果见表1(由于生物素的添加量过低,测量不准确,故未测定生物素含量;由于测定过程中操作不当,胆碱和泛酸含量数据有误,故未采用)。

表1 复合维生素纳米乳中各维生素的设计含量与测定含量
基础饲粮为养殖场自配颗粒料,其组成及营养水平见表2。

表2 基础饲粮组成及营养水平(风干基础)
1.2 试验动物与分组
试验采用单因素随机试验设计,选取30日龄断奶、体重接近的健康獭兔150只,随机分为5组,每组3个重复,每个重复10只(公母各占1/2),单笼饲养。其中对照组Ⅰ饲喂含维生素(100%营养标准)的颗粒料,饮水中不添加复合维生素纳米乳;对照组Ⅱ饲喂含维生素(100%营养标准)的颗粒料,饮水中添加吐温-80+丙三醇(与试验组Ⅱ相同配比);试验组Ⅰ饲喂不含维生素的颗粒料,饮水中添加含营养标准80%的复合维生素纳米乳;试验组Ⅱ饲喂不含维生素的颗粒料,饮水中添加含营养标准100%的复合维生素纳米乳;试验组Ⅲ饲喂不含维生素的颗粒料,饮水中添加含营养标准120%的复合维生素纳米乳。试验期为61 d,其中预试期5 d,正试期56 d。试验期间,在每日喂料前停止供水并清干饮水碗,添加稀释至10 mL的复合维生素纳米乳,然后喂料,确认饮水碗中水喝干净后再打开水阀,自由饮水。根据前1天的采食量确定各组每日复合维生素纳米乳的添加量,其计算公式为:
复合维生素纳米乳添加量(mL)=前1天的采食量(kg)×含营养标准的百分比。
1.3 样品采集
试验结束后,从每个重复中随机选取公、母兔各1只,共30只,空腹称重后屠宰,分离胸腺、脾脏、肝脏、蚓突。用抗凝采血管心脏采血5 mL,液氮速冻后于-80 ℃保存,用于测定血液免疫指标和抗氧化指标测定;取回肠中段,载玻片刮取黏膜,装于1.5 mL离心管中,液氮速冻后-80 ℃保存,用于测定回肠黏膜免疫指标。回肠、蚓突组织各取3 cm,生理盐水洗净后用4%多聚甲醛固定24 h,用于肠道组织形态观察;结扎盲肠两端,取盲肠内容物10 mL,超低温冰箱保存,用于分析盲肠菌群。
1.4 指标测定
1.4.1 生长性能测定
每天早上喂料前收集前1天剩余的饲粮,称重计算各重复獭兔的总采食量和平均日采食量(ADFI);正试期第1天至试验结束,每2周早晨空腹称重并记录每只试验兔重量,计算各重复獭兔的体增重和平均日增重(ADG);根据平均日采食量和平均日增重,计算各重复獭兔的料重比(F/G)。每日记录试验兔腹泻、死亡情况,计算腹泻率和腹泻死亡率。
腹泻率(%)=(试验期内腹泻獭兔只次数/试验獭兔只数)×100;腹泻死亡率(%)=(试验期内腹泻并死亡獭兔头数/试验獭兔头数)×100。
1.4.2 免疫器官指数和蚓突长度测定
用天平对胸腺、脾脏、肝脏进行称重,计算免疫器官指数;用直尺测定蚓突长度。
免疫器官指数=免疫器官重/宰前活重。
1.4.3 免疫指标和抗氧化指标测定
免疫指标包括血液免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、免疫球蛋白G(IgG)和回肠黏膜分泌型免疫球蛋白(SIgA)含量,抗氧化指标包括血液丙二醛(MDA)含量、超氧化物歧化酶(SOD)活性、总抗氧化能力(T-AOC)。所有指标均采用酶联免疫吸附试验(ELISA)法测定,试剂盒购于上海优选生物科技有限公司,具体测定步骤参照说明书进行。
1.4.4 肠道组织形态观察
回肠、蚓突组织经生理盐水洗净后用4%多聚甲醛固定24 h后,冲水、梯度酒精脱水、二甲苯透明、石蜡包埋等处理后制作石蜡切片,以6 μm的厚度切片,常规苏木精-伊红(HE)染色后于显微镜下测定回肠绒毛高度和隐窝深度,计算绒毛高度/隐窝深度(V/C)。在高倍显微镜下观察回肠、蚓突,计算100个单层柱状上皮细胞中淋巴细胞和杯状细胞数目,即单层柱状上皮中淋巴细胞和杯状细胞比例。
1.4.5 盲肠菌群DNA提取与多样性分析
盲肠菌群DNA提取和多样性分析由诺禾致源公司操作完成。
1.5 数据处理与分析
试验采用SPSS 22.0软件对数据进行方差分析,并采用Duncan氏法对各组数据进行多重比较,结果用平均值±标准差表示。
2 结 果
2.1 饮水中添加复合维生素纳米乳对生长獭兔生长性能的影响
由表3可知,第1~28天,试验组Ⅰ的料重比最低,显著低于试验组Ⅱ(P<0.05),与其他组差异不显著(P>0.05);对照组Ⅱ和试验组Ⅰ的腹泻率和腹泻死亡率显著低于对照组Ⅰ(P<0.05)。第29~56天,试验组Ⅱ、Ⅲ的平均日采食量显著低于对照组Ⅰ(P<0.05)。整个试验期间(第1~56天),试验组Ⅰ的平均日增重最高,为19.27 g/d,显著高于试验组Ⅱ(P<0.05),其他指标各组间差异均不显著(P>0.05)。

表3 复合维生素纳米乳对生长獭兔生长性能的影响
2.2 饮水中添加复合维生素纳米乳对生长獭兔免疫指标的影响
复合维生素纳米乳对生长獭兔免疫器官指数和蚓突长度的影响见表4。对照组Ⅰ的胸腺指数、脾脏指数和蚓突长度均高于对照组Ⅱ和各试验组,其中胸腺指数与试验组Ⅰ、Ⅱ差异显著(P<0.05),蚓突长度与对照组Ⅱ和试验组Ⅱ差异显著(P<0.05)。此外,对照组Ⅰ的肝脏指数显著低于试验组Ⅰ、Ⅲ(P<0.05)。
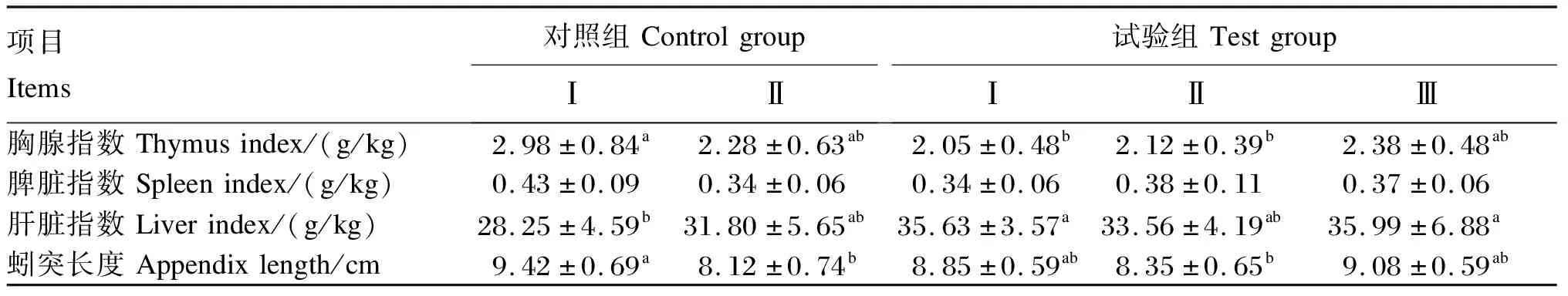
表4 复合维生素纳米乳对生长獭兔免疫器官指数和蚓突长度的影响
复合维生素纳米乳对生长獭兔血液及回肠黏膜免疫球蛋白含量的影响见表5。对照组Ⅰ的血液IgG含量极显著低于其他组(P<0.01),同时对照组Ⅱ血液IgG含量显著低于试验组Ⅰ(P<0.05)。对照组Ⅰ的回肠黏膜SIgA含量显著高于试验组Ⅱ(P<0.05)。

表5 复合维生素纳米乳对生长獭兔血液及回肠黏膜免疫球蛋白含量的影响
2.3 饮水中添加复合维生素纳米乳对生长獭兔血液抗氧化指标的影响
复合维生素纳米乳对生长獭兔血液抗氧化指标的影响见表6。试验组Ⅱ的血液MDA含量显著高于对照组Ⅰ(P<0.05),高于试验组Ⅲ、Ⅰ和对照组Ⅱ(P>0.05)。对照组Ⅱ的血液SOD活性显著高于对照组Ⅰ(P<0.05),对照组Ⅰ、对照组Ⅱ与各试验组间的差异均不显著(P>0.05)。试验组Ⅱ的血液T-AOC显著高于对照组Ⅰ、Ⅱ和试验组Ⅰ(P<0.05)。试验组Ⅰ、Ⅱ和Ⅲ之间血液MDA含量、SOD活性和T-AOC这3个指标的差异均不显著(P>0.05)。

表6 复合维生素纳米乳对生长獭兔血液抗氧化指标的影响
2.4 饮水中添加复合维生素纳米乳对生长獭兔回肠和蚓突形态结构的影响
复合维生素纳米乳对獭兔回肠和蚓突形态结构的影响见表7。对照组Ⅱ的回肠绒毛高度最高,极显著高于对照组Ⅰ(P<0.01);对照组Ⅰ、Ⅱ的回肠隐窝深度显著高于试验组Ⅰ(P<0.05);对照组Ⅰ的回肠V/C极显著低于其他4组(P<0.01)。对照组Ⅰ的蚓突隐窝深度显著高于试验组Ⅲ(P<0.05),肠壁厚度极显著高于3个试验组(P<0.01)。

表7 复合维生素纳米乳对生长獭兔回肠和蚓突形态结构的影响
复合维生素纳米乳对生长獭兔回肠和蚓突单层柱状上皮中免疫细胞比例的影响见表8。对照组Ⅱ回肠单层柱状上皮中淋巴细胞比例显著高于试验组Ⅰ、Ⅱ和对照组Ⅰ(P<0.05);试验组Ⅰ回肠单层柱状上皮中杯状细胞比例最高,对照组Ⅰ最低,但各组之间差异不显著(P>0.05)。试验组Ⅰ蚓突单层柱状上皮中淋巴细胞和杯状细胞比例最高,试验组Ⅲ最低,但各组之间差异不显著(P>0.05)。
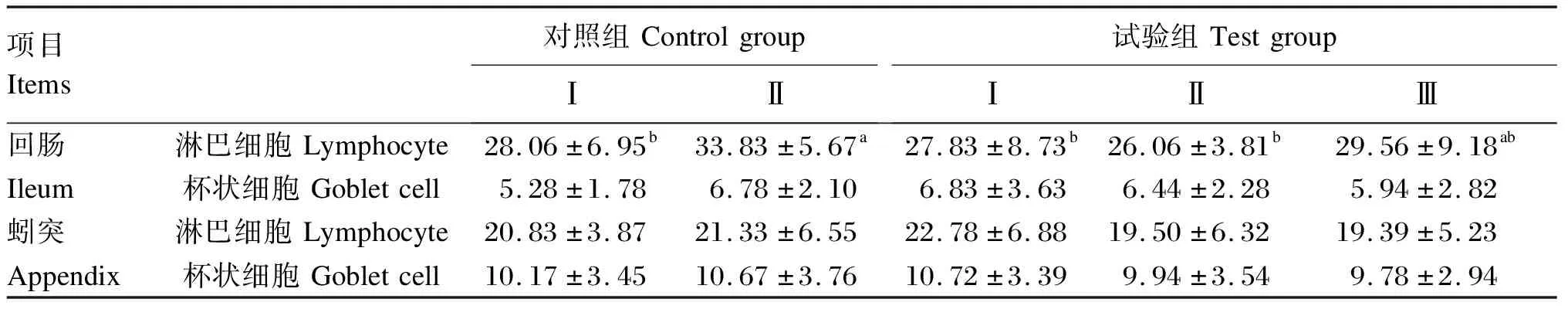
表8 复合维生素纳米乳对生长獭兔回肠和蚓突单层柱状上皮中免疫细胞比例的影响
2.5 操作分类单元(OTU)聚类及物种注释结果
本试验样本数为30,测序得到的总Tags数目为2 215 419个,能够被聚类的Tags数目为2 042 831个,总OTU数目为34 618个。
由表9可知,各组獭兔盲肠内的菌群均是以厚壁菌门为主,其中试验组Ⅱ厚壁菌门的相对丰度显著高于对照组Ⅰ(P<0.05);对照组Ⅱ的拟杆菌门、拟杆菌科的相对丰度显著高于试验组Ⅱ(P<0.05);试验组Ⅱ疣微菌科的相对丰度显著高于其他各组(P<0.05),疣微菌科UCG-014的相对丰度显著高于对照组Ⅰ(P<0.05)。

表9 复合维生素纳米乳对生长獭兔盲肠菌群相对丰度的影响
生长獭兔盲肠菌群α多样性分析结果见表10。分析可知,试验组Ⅱ的Shannon指数最低,显著高于其他各组(P<0.05);试验组Ⅰ、试验组Ⅲ和对照组Ⅰ的Simpson指数显著高于试验组Ⅱ和对照组Ⅱ(P<0.05);对照组Ⅰ的Chao1指数显著高于试验组Ⅱ、Ⅲ(P<0.05);对照组Ⅰ的ACE指数显著高于试验组Ⅱ(P<0.05)。

表10 生长獭兔盲肠菌群α多样性分析
3 讨 论
3.1 饮水中添加复合维生素纳米乳对生长獭兔生长性能、免疫功能及抗氧化能力的影响
维生素A、维生素D、维生素E、维生素B1、维生素B6、烟酸、胆碱等对动物的生长性能均有重要影响。为探讨饲粮中添加维生素与饮水添加复合维生素纳米乳在獭兔生长性能方面的差异,本试验测定了各种獭兔的平均采食量、平均日增重和料重比,从试验全期的结果看,饲粮中添加维生素与饮水中添加复合维生素纳米乳,其生长性能无显著差异。
獭兔断奶时由于消化道未发育完全,在奶料更替的过程中对饲粮的消化率较低,营养物质在消化道内滞留,难以消化。加之仔兔断奶后不能从母乳中获得抗菌物质,导致致病微生物大量增殖,从而引起断奶仔兔出现腹胀、腹泻等消化道疾病[5]。本试验中,由于基础饲粮为养殖场自配颗粒料,存在玉米含量高、纤维水平低的缺陷,导致断奶后1~28 d时大量獭兔出现腹泻症状,且正常饮水的獭兔腹泻率显著高于饮水中添加复合维生素纳米乳及其空白组方(吐温-80+丙三醇)的獭兔。而饮水中含有吐温-80+丙三醇的试验组,由于吐温-80为表面活性剂,使油、淀粉和水在肠道内一定程度上形成较稳定的乳浊液结构,从而减少由植物性饲料中具有抗原性的大分子物质(以蛋白质和碳水化合物为主)引起的短暂性过敏反应,可在断乳早期降低断奶獭兔的腹泻率和死亡率,但后期效果不明显。
IgG是动物机体抗感染免疫的主力,可作为血液学诊断和疫苗免疫后监测的主要抗体。在动物机体内IgG不仅含量高,而且持续时间长,可发挥抗菌、中和病毒和毒素等免疫学活性[6]。本试验中,正常饮水的獭兔血液IgG含量极显著低于其他组,说明给獭兔添加适宜水平的乳化剂能有效促进免疫球蛋白合成,进而增加机体免疫力和对外界不良环境的抵抗力。刘兆阳等[7]的试验同样证明乳化剂对肉鸡血清IgA和IgM含量有显著的提高作用。
多种维生素如维生素A、维生素D、维生素C等均具有抗氧化的作用。SOD作为抗氧化系统中的重要酶系,其活性与机体清除自由基的能力成正比,而MDA是细胞膜脂质过氧化的产物,其含量可间接反映细胞损伤程度。本试验中,对照组Ⅰ的血液MDA含量最低,显著低于对照组Ⅱ,但与各试验组间不存在显著性差异,说明各组獭兔不存在明显的氧化损伤;而对照组Ⅰ血液SOD活性和T-AOC也相对较低,推测饮水中添加的吐温-80+丙三醇能一定程度上提高机体清除自由基的能力,可做进一步研究。此外,试验组Ⅱ的血液MDA含量和T-AOC均显著高于试验组Ⅲ和试验组Ⅰ,随复合维生素纳米乳添加量的增加呈先增加后降低的趋势。李万佳[8]在饲粮中添加不同水平的维生素D,结果发现,随着饲粮维生素D含量的增加,生长獭兔血液SOD活性、MDA含量和T-AOC均呈先增加后降低的趋势。陈倩等[9]在辽宁绒山羊种公羊饲粮中添加不同水平的维生素E,其血液中抗氧化指标同样呈先增加后降低的趋势。上述结果说明适量的维生素能提高机体的抗氧化能力,维生素不足或过量均会降低抗氧化能力。
3.2 饮水中添加复合维生素对生长獭兔肠道组织结构和盲肠微生态的影响
小肠的形态结构与营养物质的消化吸收密切相关。V/C综合反映了肠道的功能状态,该比值下降表明动物肠道受损,消化吸收功能下降,同时动物可能表现出生长受阻等现象;该比值上升则表明肠道黏膜功能得到改善,吸收功能增强[10]。肠上皮淋巴细胞(iIEL)定位于消化道黏膜上皮细胞间,与肠上皮细胞紧密接触并相互作用,介导黏膜局部免疫防御和维持肠黏膜组织稳定性。
小肠分十二指肠、空肠、回肠3个肠段,其中十二指肠、空肠的皱襞和绒毛相对发达、浓密,为淀粉、脂肪和蛋白质消化吸收的主要场所,而回肠的杯状细胞及淋巴组织则相对发达。獭兔为草食性动物,其饲粮结构以草食纤维为主,而盲肠是獭兔消化纤维饲料的主要场所。回肠是连接小肠与盲肠的重要过渡肠段,因此研究回肠的组织结构对獭兔的消化吸收及免疫有着重要作用。
本试验结果显示,3个试验组之间獭兔回肠、蚓突单层柱状上皮中淋巴细胞和杯状细胞比例均无显著差异,与对照组Ⅰ之间也没有显著差异,说明不同维生素水平对肠道免疫功能没有显著影响。对照组Ⅰ的回肠V/C极显著低于其他4组,而回肠单层柱状上皮中淋巴细胞比例也显著低于对照组Ⅱ,说明其他4组饮水中所含的吐温-80和丙三醇能一定程度提高肠道免疫功能,其原因可能是吐温-80和丙三醇能维持獭兔肠道内环境,改善肠道菌群结构,从而影响肠黏膜中淋巴细胞数量。
HiSeq测序结果显示,对照组Ⅰ的盲肠菌群多样性显著高于试验组Ⅱ和对照组Ⅱ,而厚壁菌门的相对丰度显著低于试验组Ⅱ,说明适量的吐温-80和丙三醇增加了厚壁菌门中某种微生物的竞争优势,提高了其在盲肠中的数量,从而降低了獭兔盲肠内菌群的多样性。黄英等[11]试验证明瘤胃细菌细胞膜存在大量脂类,当表面活性剂与细菌作用时,可改变细菌细胞表面的亲疏水性,从而改变细菌的黏附性,这可能是导致盲肠菌群多样性和相对丰度发生变化的重要原因之一。张慧玲等[12]研究发现,饲粮中添加吐温-20和吐温-80后,高剂量的吐温-20使绵羊瘤胃中优势菌种类增加,吐温-80和低剂量的吐温-20使优势菌种类下降,这与本试验的结果相一致。
獭兔盲肠菌群相对丰度分析结果显示,各试验组獭兔盲肠菌群以厚壁菌门为主,其中试验组Ⅱ厚壁菌门的相对丰度显著高于对照组Ⅰ和Ⅱ。门水平上各组盲肠菌群相对丰度排序为厚壁菌门>拟杆菌门>变形菌门>柔膜菌门,与朱岩丽[13]的试验结果一致,Monteils等[14]的报道也证实了该结果。单胃动物盲肠菌群的多样性较高,以厚壁菌门中的梭菌Ⅳ群、梭菌ⅩⅣ群和拟杆菌门为最优势菌群,细菌数量为1012~1013CFU/g内容物。目前发现人体肠道中与肥胖有关的细菌主要有厚壁菌门和拟杆菌门,其中梭菌属是厚壁菌门中非常重要而且数量庞大的一类菌。对啮齿动物和人的研究发现,相对于正常体态,肥胖机体的肠道菌群多样性、细菌基因的表现形式和代谢途径包括营养素的摄入等均发生了变化[15]。其中,肥胖机体的肠道厚壁菌数量增加,拟杆菌数量减少,这种结构特点使肠道菌群能从饮食中特异地增加营养的吸收,并为宿主提供额外的能量,导致机体能量摄入过多引起肥胖[16]。由此说明,适当的吐温-80和丙三醇能明显改变獭兔盲肠内厚壁菌门和拟杆菌门的相对丰度,从而改变獭兔盲肠菌群结构,继而提高獭兔的生长性能。
4 结 论
饮水中添加含獭兔生长阶段需要量100%的复合维生素纳米乳能够在一定程度上提高生长獭兔的免疫功能和抗氧化能力,并改善其肠道组织结构和盲肠微生态环境。

