鼠神经生长因子对颅脑损伤患者神经功能及炎性状态的影响观察*
刘兵
颅脑损伤对患者神经功能造成较大损伤,且机体炎性应激突出,因此治疗的重点除包括神经功能的改善外,炎性状态的干预与评估也是重点之一[1-2]。临床中与颅脑损伤相关的治疗研究中,鼠神经生长因子的应用率较高,但是关于鼠神经生长因子对颅脑损伤患者神经功能及炎性状态的全面综合影响研究相对匮乏,故其细致的应用价值仍有待探究。故本研究就鼠神经生长因子对颅脑损伤患者神经功能及炎性状态的影响进行探究,现将结果报道如下。
1 资料与方法
1.1 一般资料
选取2017年6月-2019年10月笔者所在医院收治的66例颅脑损伤患者为研究对象。纳入标准:20岁及以上;男女不限;颅脑损伤。排除标准:合并其他创伤;合并感染;合并神经系统疾病;合并多系统器官功能不全。将其随机分为对照组和观察组,各33例。对照组男23例,女10例;年龄23~63岁,平均(43.3±5.7)岁;其中脑挫裂伤25例,其他8例;致伤原因:车祸致伤20例,摔落致伤9例,打击致伤4例。观察组男22例,女11例;年龄22~62岁,平均(43.6±5.5)岁;其中脑挫裂伤26例,其他7例;致伤原因:车祸致伤21例,摔落致伤9例,打击致伤3例。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理学委员会审批。患者和/或家属对研究知情同意。
1.2 方法
对照组进行常规颅脑损伤治疗,主要为进行颅脑压调控、脱水治疗、神经保护、脑血管痉挛防控、营养支持及其他对症治疗,治疗3周。观察组则在对照组基础上加用鼠神经生长因子(石药集团恩必普药业有限公司生产;批号:6182003107),以30 μg鼠神经生长因子进行肌注,1次/d,连续应用3周。两组其他治疗与干预均相同。
1.3 观察指标
采集两组治疗前及治疗后1、3周外周静脉血,将血标本常规离心取血清进行检测,以酶联免疫法定量检测血清神经功能及炎性状态指标,前者包括神经元特异性烯醇酶(NSE)、髓鞘碱性蛋白(MBP)及S100B蛋白(S100B),后者包括白细胞介素-1β(IL-1β)、白细胞介素-10(IL-10)及肿瘤坏死因子-α(TNF-α),上述方面均以每项指标对应的试剂盒进行检测,由两名经验丰富者进行操作检测,严格按照操作说明检测。
1.4 疗效判定标准
临床疗效判定标准:治疗后患者美国国立卫生院神经功能缺损评分(NIHSS评分)改善幅度为90%以上为基本痊愈,改善幅度在46%~90%为显效,改善幅度在19%~45%为有效,改善幅度不足19%为无效[3-4]。总有效率=(基本痊愈+显效+有效)×100%。
1.5 统计学处理
采用SPSS 23.0软件对所得数据进行统计分析,计量资料以(±s)表示,采用t检验;计数资料以率(%)表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组临床总有效率比较
观察组临床总有效率高于对照组,差异有统计学意义(P<0.05),见表 1。
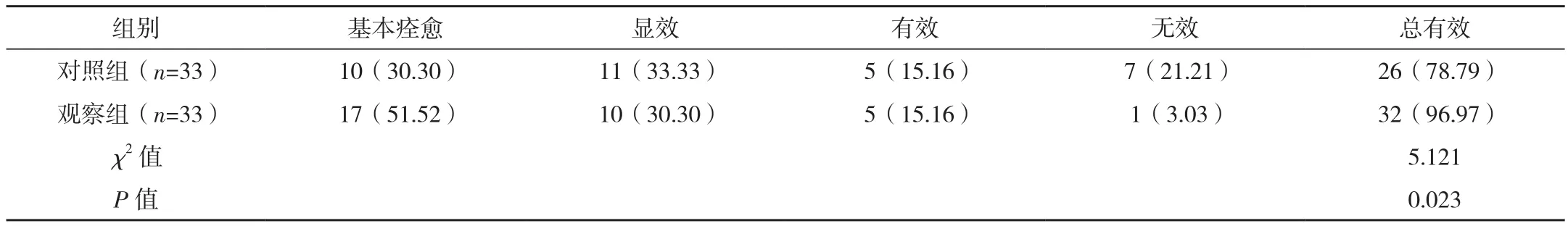
表1 两组临床总有效率比较 例(%)
2.2 两组治疗前及治疗后1、3周血清神经功能指标比较
治疗前两组血清神经功能指标比较差异无统计学意义(P>0.05),治疗后1、3周两组血清神经功能指标均低于治疗前,且观察组各指标均低于对照组,差异均有统计学意义(P<0.05),见表2。
表2 两组治疗前及治疗后1、3周血清神经功能指标比较 [μg/L,(±s)]
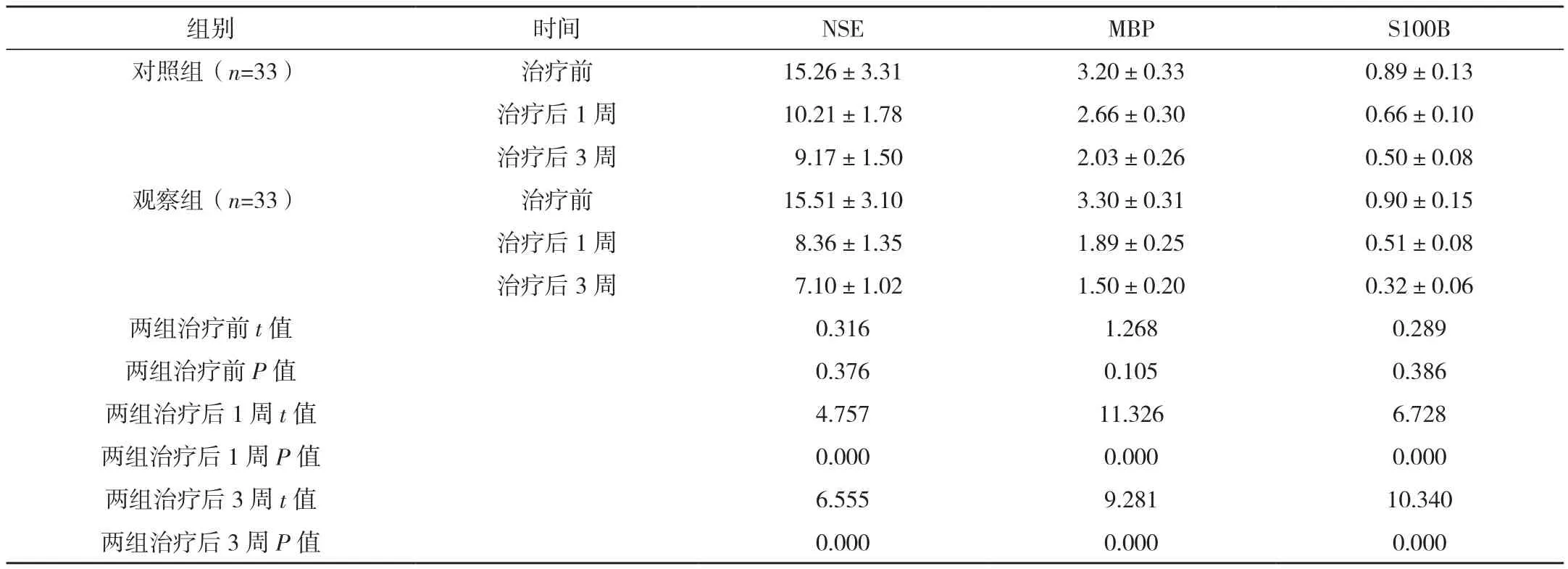
表2 两组治疗前及治疗后1、3周血清神经功能指标比较 [μg/L,(±s)]
组别 时间 NSE MBP S100B对照组(n=33) 治疗前 15.26±3.31 3.20±0.33 0.89±0.13治疗后1周 10.21±1.78 2.66±0.30 0.66±0.10治疗后3周 9.17±1.50 2.03±0.26 0.50±0.08观察组(n=33) 治疗前 15.51±3.10 3.30±0.31 0.90±0.15治疗后1周 8.36±1.35 1.89±0.25 0.51±0.08治疗后3周 7.10±1.02 1.50±0.20 0.32±0.06两组治疗前t值 0.316 1.268 0.289两组治疗前P值 0.376 0.105 0.386两组治疗后1周t值 4.757 11.326 6.728两组治疗后1周P值 0.000 0.000 0.000两组治疗后3周t值 6.555 9.281 10.340两组治疗后3周P值 0.000 0.000 0.000
2.3 两组治疗前及治疗后1、3周血清炎性指标比较
治疗前,两组血清炎性指标比较差异无统计学意义(P>0.05),治疗后1、3周,两组血清炎性指标均低于治疗前,且观察组各指标均低于对照组,差异均有统计学意义(P<0.05),见表3。
表3 两组治疗前及治疗后1、3周血清炎性指标比较 (±s)
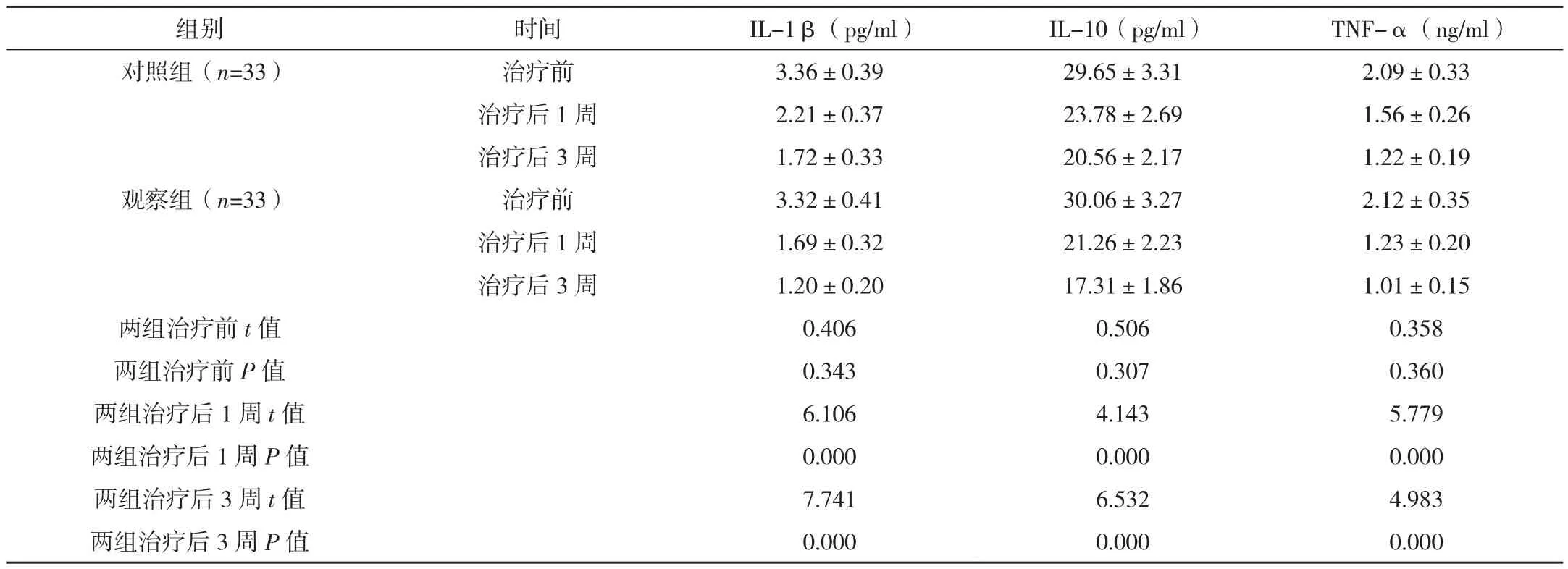
表3 两组治疗前及治疗后1、3周血清炎性指标比较 (±s)
组别 时间 IL-1β(pg/ml) IL-10(pg/ml) TNF-α(ng/ml)对照组(n=33) 治疗前 3.36±0.39 29.65±3.31 2.09±0.33治疗后1周 2.21±0.37 23.78±2.69 1.56±0.26治疗后3周 1.72±0.33 20.56±2.17 1.22±0.19观察组(n=33) 治疗前 3.32±0.41 30.06±3.27 2.12±0.35治疗后1周 1.69±0.32 21.26±2.23 1.23±0.20治疗后3周 1.20±0.20 17.31±1.86 1.01±0.15两组治疗前t值 0.406 0.506 0.358两组治疗前P值 0.343 0.307 0.360两组治疗后1周t值 6.106 4.143 5.779两组治疗后1周P值 0.000 0.000 0.000两组治疗后3周t值 7.741 6.532 4.983两组治疗后3周P值 0.000 0.000 0.000
3 讨论
颅脑损伤在临床的发生率较高,且其变化急骤,致残率致死率均较高,患者神经损伤情况突出,是治疗的重点。临床中与神经损伤相关的指标较多,其中NSE、MBP及S100B是常见的相关指标,其对于神经损伤程度及神经改善效果等多方面均有较高的参考价值[5-6],较多研究认为,其表达水平随着神经功能的改善而呈现降低的趋势,故对于治疗方式及用药选择均有较高的评估作用[7-8]。另外,本类患者的炎性状态相对突出,其中IL-β、IL-10及TNF-α等炎性指标也在血液中呈现高表达状态,且其表达程度与患儿的疾病严重程度,乃至预后均有密切的关系,因此上述炎性指标在本类患者中的表达监测意义较高,有助于了解疾病的发展转归[9-10]。临床中用于颅脑损伤治疗的方式及药物种类繁多,其中鼠神经生长因子是受认可程度较高的一类药物,其对于本类患者神经损伤的控制作用较好[11-12],但是直观影响神经功能相关血液指标的研究不足,而对于炎性反应的影响研究更为少见。
本研究就鼠神经生长因子对颅脑损伤患者神经功能及炎性状态的影响进行探究,结果显示,采用常规治疗加鼠神经生长因子治疗的患者临床效果优于仅常规治疗的患者,主要表现为临床总有效率相对更高,同时治疗后患者血清神经功能及炎性指标均低于治疗前,且均低于采用常规治疗的患者,因此肯定了鼠神经生长因子在本类患者中的应用价值。分析原因,鼠神经生长因子对神经损伤具有促进修复的作用有关,同时其具有较好的自由基清除作用[13-14],有助于控制相关损伤及促进修复,并可抑制神经细胞的凋亡,因此在神经受损控制与修复方面作用突出,相关的神经功能指标表达随之降低,而损伤的修复也有助于相关炎性反应的控制[15]。
综上所述,鼠神经生长因子有助于改善颅脑损伤患者的神经功能及炎性状态,在颅脑损伤患者中的应用价值较高。

