优化的供者来源细胞游离DNA 检测方法的初步运用
朱代文,范钰,巫丽娟,王雨姗,林涛 (.四川大学华西医院泌尿外科/泌尿外科研究所,国家老年疾病临床医学研究中心,器官移植中心,四川 成都 6004;.四川大学华西医院实验医学科,四川 成都 6004)
器官移植是治疗器官功能衰竭患者的有效外科手段,贤移植由于其开展最早、发展最快、技术和管理最成熟,目前已经成为终末期贤脏疾病(end stage renal disease, ESRD)的最优治疗方法[1-3]。当受者出现移植贤功能不全时,为明确病因,常需要进行移植贤穿刺活检(诊断的金标准)[4-5]。然而移植贤穿刺活检有一定的创伤性和出血风险,且病理结果报告延时性较长(常为1 周),为临床早诊断早治疗带来较大的困难。
移植物在发生损伤时,其供者来源细胞游离DNA(donor-derived cell-free DNA,dd-cfDNA)会游离释放到血液或尿液中。由于dd-cfDNA 序列与移植受者自身的DNA 序列存在差异,通过检测体液中dd-cfDNA 的含量,可以反映出移植物受损伤的情况[6]。目前在国际上已有多项研究采用dd-cfDNA 来检测移植贤的健康状态,发现dd-cfDNA 在排斥反应的诊断中表现出优秀的诊断效能,特别是在诊断抗体介导的排斥反应方面,其敏感度、特异度和受试者工作特征曲线下面积分别达到了0.84,0.80 和0.89[7]。对dd-cfDNA的检测主要有两种方法:随机测序法或靶向供受者cfDNA 差异法[8],目前多采用靶向供受者cfDNA 差异法,涉及到采用第二代测序技术(nextgeneration sequencing,NGS)或微滴式数字聚合酶链式反应(droplet digital polymerase chain reaction,ddPCR)。NGS 准确度非常高,但检测费用也非常昂贵,而ddPCR 不仅准确度有保证,而且可以提供dd-cfDNA 的绝对定量。现在已经有商品化的依赖于NGS 平台或ddPCR 平台的dd-cfDNA 检测试剂盒[9],但因其费用昂贵(约4000 ~8000 元/样),而且所检测的单核苷酸多态性(single nucleotide polymorphism,SNP)位点是依据国外人群来制定的,从而限制了国内临床的广泛运用。
我们前期通过整合目前国内外dd-cfDNA 的检测方法,根据中国人群SNP 位点特色,优化选择了8 个SNP 位点形成了一种高性价比的dd-cfDNA的检测方法(约1200 元/样)。本研究拟通过初步临床试验,明确该方法的临床实用性。
1 资料与方法
1.1 dd-cfDNA 检测材料:经四川大学华西医院伦理委员会批准,研究从四川大学华西医院标本库无差别获取同种异体贤移植术受者的血样,包括有围术期贤移植受者的血样和明确诊断为活动性抗体介导排斥反应(active antibody mediated rejection,ABMR)受者的血样。血样质控合格样本纳入研究进行dd-cfDNA 含量测定。本研究获四川大学华西医院伦理委员会审批通过,伦理批号为2020-063。测定用的主要耗材有:优化选择的8 个SNP 位点形成的dd-cfDNA 检测试剂盒(Panel HX-8),细胞游离DNA 保存管 (KJ1002DNA,江苏康健公司),cfDNA 提取试剂(RC1101,厦门恺硕公司)。
1.2 dd-cfDNA 检测方法:受者血样经1600×g 离心10 min 后取血浆,再在低温高速离心机(Heraeus 75004250,美国赛默飞公司)中以16 000×g 离心10 min 后取血浆进行cfDNA 提取。后在ddPCR 检验平台(D040101,D050101,D010103,杭州领航公司)上用Panel HX-8 对dd-cfDNA 进行检测,计算出dd-cfDNA 含量百分比(%)。
1.3 临床资料收集和分析:回顾性收集纳入研究血样所对应受者的临床资料。其中围术期受者,根据其术后血清肌酐 (serum creatinine,Scr)下降情况,分为4 组(具体分组标准见表1):移植物功能迅速恢复组(immediate graft function,IGF)、移植物功能缓慢恢复组(slow graft function,SGF)、移植物功能延迟恢复组(delayed graft function,DGF 组)和Scr 反弹组(creatinine elevation,CE 组)。
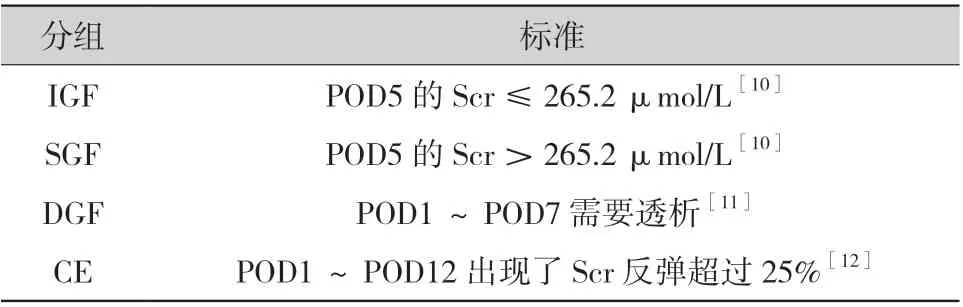
表1 围术期受者分组方法
1.4 统计学分析:采用SPSS 25.0 统计学软件进行数据处理。计量资料采用均数±标准差(±s)表示,组间比较使用t 检验,同组间前后比较使用配对t 检验。P <0.05 认为差异有统计学意义。
2 结 果
本研究共获取合格血样共330 份,来自于2020 年3 月至2021 年5 月于四川大学华西医院就医的84 例同种异体贤移植围术期的受者和3 例经移植贤穿刺活检确诊为ABMR 的受者。84 例围术期受者中,有61 例受者供贤是来源于脑死亡后捐献(donation after brain death,DBD)供者,23 例供贤来源于活体捐献(living donation,LD)供者。
围术期受者中,IGF 组73 例,SGF 组4 例,DGF 组2 例,CE 组5 例。 受者平均年龄为(31.7±11.3)岁,女性占比28.6%(24/60),一般情况见表2,Scr 和dd-cfDNA 的变化见表3。其中,IGF 组受者术后1 d(postoperative day 1,POD1)、POD3、POD5、POD7 和POD12 的平均Scr 分别为:(448.0±200.2) μmol/L、(161.5±70.8 )μmol/L、(126.4±44.3) μmol/L、(116.2±33.7) μmol/L 和(115.4±38.2) μmol/L, 成指数型下降,Scr 在POD7 达到谷平台值(图1A);相一致的,IGF 组POD1、POD3、POD5 和POD7 的dd-cfDNA 也呈指数型下降:4.0%±3.3%、1.4%±2.3%、0.8%±1.5%和0.9%±1.5%,dd-cfDNA 在POD5 达到谷平台值(图1B)。SGF 组POD1 的dd-cfDNA 显著高于IGF 组(28.5%±38.8%比4.0%±3.3%,P =0.003)(图1B),DGF 组POD1 的dd-cfDNA 在数值上也较IGF 组高 (9.9%±1.8%比4.0%±3.3%,P =0.083)(图1B)。虽然POD3、POD5 和POD7 的dd-cfDNA各组间差异无统计学意义(P >0.05),但DGF组POD3 的平均dd-cfDNA 在数值上大于IGF 组(3.7%±1.1%比1.4%±2.3%,P =0.064)(图1B)。在CE 组中,POD12 的Scr 在数值上大于POD7(150.8±25.9 μmol/L 比118.6±22.0 μmol/L,P =0.171)(图1A),POD7 的dd-cfDNA 在数值上大于POD5 (5.4%±9.6% 比1.4%±0.9%,P =0.064)(图1B)。
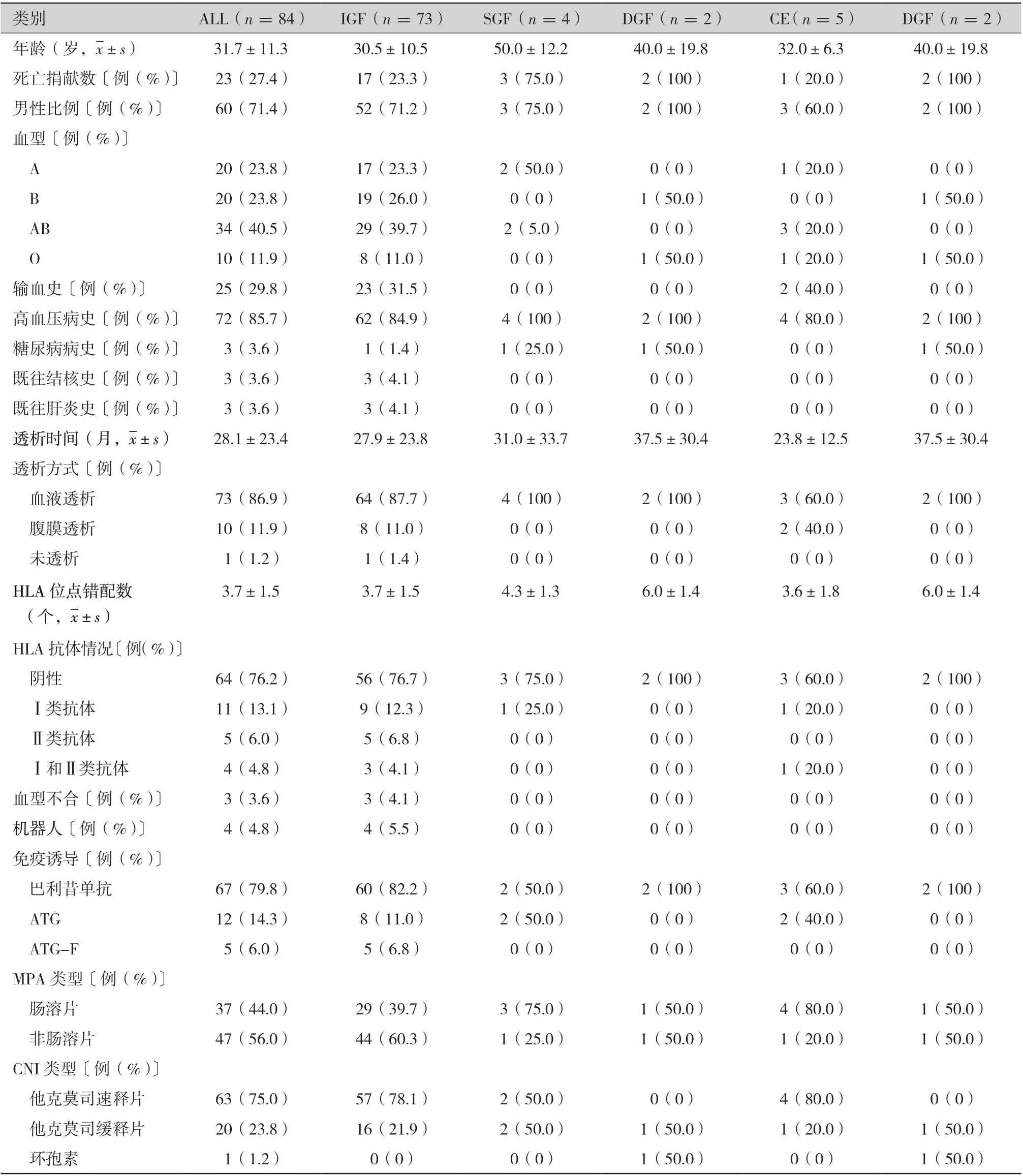
表2 围术期受者的基线特征
表3 受者Scr 与dd-cfDNA(±s)

表3 受者Scr 与dd-cfDNA(±s)
注:Scr IGF 为IGF 组的Scr;dd-cfDNA IGF:IGF 组的dd-cfDNA。
类别POD1POD3POD5POD7POD12治疗前治疗后Scr IGF(μmol/L)448.0 ± 200.2161.5 ± 71.8126.4 ± 44.3116.2 ± 37.7115.4 ± 38.2 Scr SGF(μmol/L)894.6 ± 246.3 699.0 ± 108.9 629.0 ± 108.0486.3 ± 46.3334.0 ± 255.0 Scr DGF(μmol/L)974.0 ± 347.9705.0 ± 50.9680.0 ± 75.0527.5 ± 153.4330.5 ± 89.8 Scr CE(μmol/L)413.6 ± 224.5145.0 ± 43.5121.6 ± 27.5118.6 ± 22.0150.8 ± 25.9 Scr ABMR(μmol/L)127.3 ± 3.1110.0 ± 7.5 dd-cfDNA IGF(%)4.0 ± 3.31.4 ± 2.30.8 ± 1.50.7 ± 0.6 dd-cfDNA SGF(%)28.5 ± 38.82.7 ± 4.70.5 ± 0.40.5 ± 0.3 dd-cfDNA DGF(%)9.9 ± 1.83.7 ± 1.11.3 ± 0.80.4 ± 0.1 dd-cfDNA CE(%)6.2 ± 8.24.4 ± 6.91.4 ± 0.95.4 ± 9.6 dd-cfDNA ABMR(%)4.2 ± 2.00.6 ± 0.1
3 例ABMR 受者均采用激素冲击、血浆置换和静注人丙种球蛋白治疗。在接受治疗前的Scr 分别为130 μmol/L、128 μmol/L 和124 μmol/L(图1C),dd-cfDNA 分别为2.1%、4.4%和6%;治疗后的Scr 分别为111 μmol/L、117 μmol/L 和102 μmol/L,dd-cfDNA 分别为0.7%、0.7% 和0.5%(图1C)。
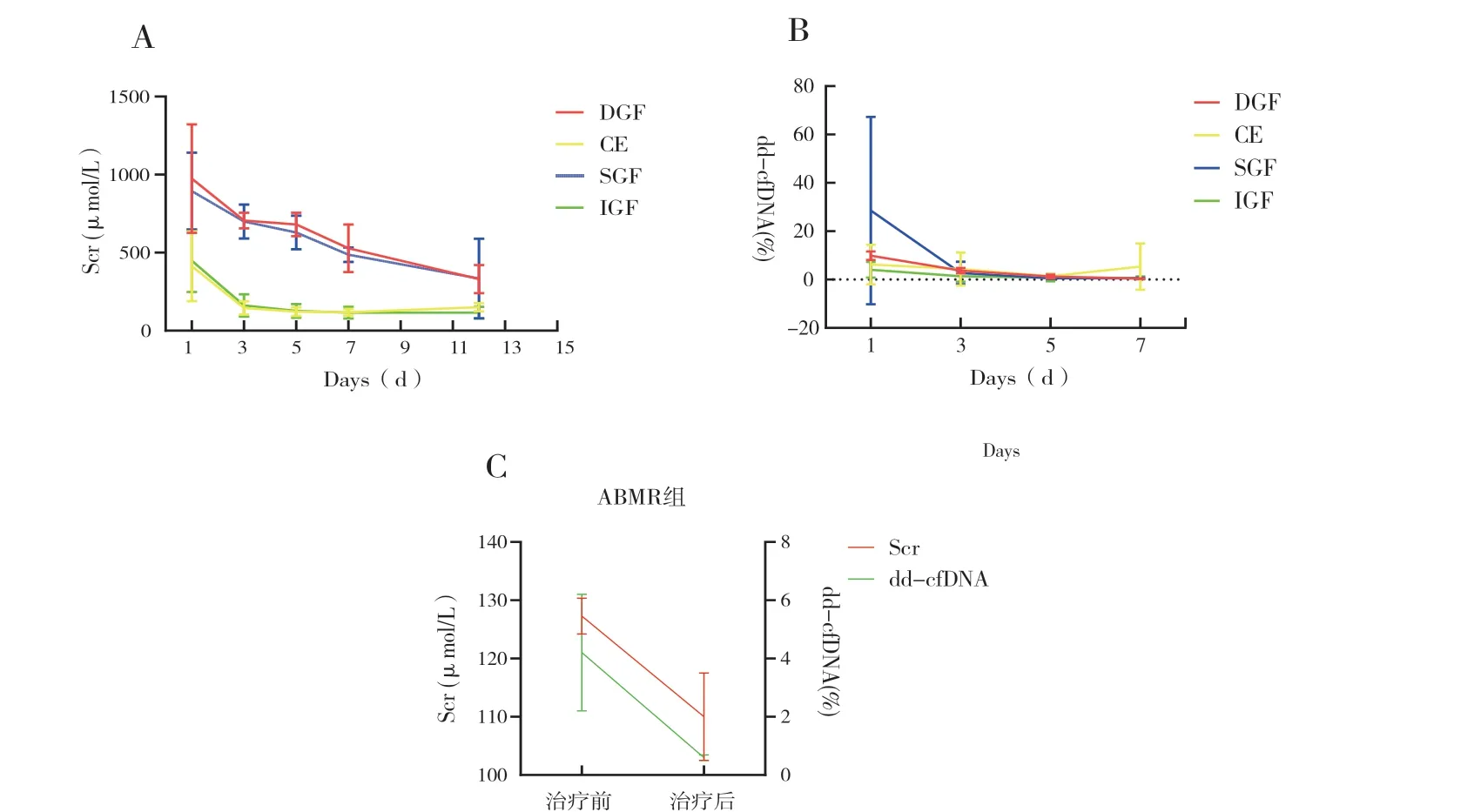
图1 IGF、SGF、DGF、CE、ABMR 组的Scr 和dd-cfDNA
3 讨 论
移植器官在围术期间容易受到免疫损伤、缺血/再灌注损伤(ischemia reperfusion injury,IRI)、药物毒性和手术并发症相关的许多急性损伤[13-16],在术后至长期随访过程中也面临着排斥反应、原发病复发、感染等损伤可能[17-18]。因此如何及时、准确地判断移植物的状态,根据损伤病因选择有效的治疗是保证移植物长期存活的关键因素。虽然临床上采用Scr 来反映贤脏功能,但Scr 的变化并不能特异性地反映出移植物损伤的情况。当Scr 出现上涨有可能只是一个短暂的过程,例如钙调神经磷酸酶抑制剂浓度过高导致的移植贤血流动力学改变,或者贤前性血容量不足[19]。而且损伤导致Scr 升高时,移植贤往往已经发生了较严重的损伤[20]。组织病理学检查是判断移植物损伤的金标准,有许多移植中心采用程序性活检的方式来定期监测移植物状态[21-22]。但穿刺活检需受者住院行有创的穿刺操作,整体费用较高,且据文献报道移植贤穿刺活检的并发症发生率为2.9%~5.8%[23],限制了其临床广泛应用。由于这些不足,研究者一直在寻找更为特异的无创生物标记物来监测移植物的健康状况,dd-cfDNA 的检测就是其中一个迅速兴起的领域。
虽然dd-cfDNA 最初是被当作一种排斥反应的无创标记物来进行研究,但很快就发现dd-cfDNA实质上是一种反映移植物损伤的标记物,而导致损伤最常见原因是排斥反应[24]。据目前文献所报道的数据表明,dd-cfDNA 在检测排斥反应方面具有优秀的整体诊断性能,用dd-cfDNA 百分比来诊断排斥反应的灵敏度为80%,特异度为76%,ROC 曲线下面积为0.81[25-26]。值得一提的是,dd-cfDNA 百分比的阴性预测值达到了90%,这提示在临床应用中,如果dd-cfDNA 在低于界定值时(通常为1%)可以考虑排除移植物发生损伤,例如ABMR[27]。在本研究中,ABMR 受者在治疗前平均dd-cfDNA 为4.2%,经过治疗后平均dd-cfDNA下降到了0.6%。dd-cfDNA 的下降,反映了针对ABMR 进行治疗明显缓解了移植贤的损伤。另外,本研究中也发现IGF 组受者的dd-cfDNA 从POD1的4.0%快速下降到POD5 的0.8%,比Scr 更快达到谷平台值,dd-cfDNA 的下降情况可能比Scr 的下降情况更敏感地反映出移植贤的快速康复。相对应的,CE 组的平均Scr 从POD7 的118.6 μmol/L 上涨到了POD12 的150.8 μmol/L,而平均dd-cfDNA则是更早的从POD5 的1.4%上涨到了POD7 的5.4%,也提示dd-cfDNA 比Scr 更加灵敏。在围术期,1 例CE 组的受者行移植贤穿刺活检,诊断为急性临界性T 细胞介导排斥反应;其余4 例受者均未行移植贤穿刺活检。
DBD 供贤较LD 供贤会经历更长时间的冷/热缺血时间,所受到的IRI 程度更重[28],因此受损的组织细胞量更多,术后早期dd-cfDNA 的释放量更大。本研究中SGF 组的DBD 供贤占75%,DGF组的供贤全部是来源于DBD 供者。这可能是导致SGF 组和DGF 两组POD1 的dd-cfDNA 都要高于IGF 组的一个重要因素。而只要移植贤没有继续受到损伤,随着时间推移,受损组织细胞吸收并修复,dd-cfDNA 会迅速下降。Gielis 等[29]发现术后恢复良好的贤移植受者,其dd-cfDNA 会快速下降,可以从POD1 的2.6%~41.9%迅速降至术后第10 天的0.46%。本研究中SGF 组和DGF 组ddcfDNA 均快速下降:IGF 组和SGF 组的dd-cfDNA在POD5 下降到了1%以内,DGF 组的dd-cfDNA在POD7 下降到了1%以内。
近年来,针对dd-cfDNA 的临床研究数量增长极快,但由于市面上dd-cfDNA 的检测成本较高,限制了dd-cfDNA 在临床上的广泛应用。Puttarajappa 等人[30]提出,对于一个低免疫学风险的贤移植受者,假设其发生亚临床T 细胞介导的排斥反应的风险为12%,ABMR 风险为3%,那么在移植后12 个月进行一次程序性活检可能比用无创性生物标记物进行筛查更具有成本效益。限制dd-cfDNA 成为一种具备实用性的连续监测生物标记物的原因更多在于其检测成本。虽然本研究有着样本量较少、为非前瞻性随机对照研究、围术期受者均未行病理检查、没有与商业化dd-cfDNA 检测进行性价对比等不足之处。但本研究通过优化SNP 位点的选择,减少了dd-cfDNA 的检测成本,并初步验证了该dd-cfDNA 检测方法的临床实用价值,为随后将该方法临床转化,探索其在临床连续dd-cfDNA 监测和广泛应用中的价值打下了基础。

