典型近岸退化珊瑚礁的成功修复案例
——蜈支洲珊瑚覆盖率的恢复
张浴阳,刘骋跃,王丰国,江 雷,俞晓磊,张 芳,黄 晖,6*
(1.中国科学院热带海洋生物资源与生态重点实验室,广东省应用海洋生物学重点实验室,中国科学院南海海洋研究所, 广东 广州 510301; 2.中国科学院南海生态环境工程创新研究院,广东 广州 510301;3.南方海洋科学与工程广东省实验室(广州),广东 广州 511458; 4.海南蜈支洲旅游开发股份有限公司,海南 三亚 572000; 5.中国科学院大学,北京 100049; 6.中国科学院海南热带海洋生物实验站,海南 三亚572000)
珊瑚礁生态系统作为海洋中生物多样性最高的生态系统,不仅养育了众多的海洋生物,同时也为自然与人类提供了包括维持生物多样性、海岸保护、渔业资源、旅游科教等重要的生态服务功能[1]。然而,珊瑚礁在全球范围内面临着包括全球气候变化、人类活动的影响以及污染、过度渔业等威胁,近一半的珊瑚礁已经出现严重退化,三分之二的珊瑚礁遭受严重威胁。据Hoegh-Guldberg等(2017)预测,如果全球变暖趋势没有能够得到控制,珊瑚礁可能在本世纪中叶面临灭绝的命运[2]。我国珊瑚礁也呈现同样严重的退化趋势,在过去的30 a间近岸珊瑚礁退化了至少80%,南海岛礁珊瑚礁的覆盖率也在二十一世纪初的10~15 a间从大于60%降至了20%左右[3]。即使在三亚珊瑚礁国家级自然保护区内,2018年的造礁石珊瑚的覆盖率也仅为14.31%,较历史数据有明显下降[4]。
为了恢复珊瑚礁生态系统健康,从上个世纪末起许多国家开始重视珊瑚礁生态修复工作,并在多个地区开展了珊瑚有性繁殖、幼体培育、苗圃培育、移植等实验[5-14]。在珊瑚礁生态修复工作中,珊瑚移植是增加退化珊瑚礁上造礁石珊瑚数量最直接的方法。人工培育出的造礁石珊瑚苗种或来自其他珊瑚礁的自然珊瑚个体都需要移植至待修复的珊瑚礁上才能直接提高退化珊瑚礁的珊瑚数量。移植后的造礁石珊瑚经一段时间的生长后可以提高区域造礁石珊瑚的覆盖率,增加珊瑚礁底质结构的复杂度、吸引更多鱼类、为珊瑚礁生物提供产卵所和避难所等,发挥其在珊瑚礁上的完整生态功能作用;此外,移植造礁石珊瑚增加了区域的空间异质性,可以通过吸引更多植食性动物聚集,增强对藻类的摄食压力,而且移植珊瑚同藻类的空间竞争也会降低藻类在珊瑚礁的数量与覆盖面积,这两方面能够减缓或阻止珊瑚礁向藻礁的退化[14]。因此,珊瑚移植是珊瑚礁生态修复工作中重要的一步,移植的效果将直接影响整个珊瑚礁生态修复工作的成败。
珊瑚移植的效果受到多种因素的影响,包括移植的环境、方法、个体大小、珊瑚种类等都会影响到珊瑚的存活率和生长率[15-19]。在日本冲绳对比水平和垂直移植美丽鹿角珊瑚(Acroporamuricata)和风信子鹿角珊瑚(A.hyacinthus)的效果,发现垂直移植的珊瑚存活率更高,生长更快;较大移植个体的存活率高于小个体的,但生长率要低于小个体[16]。但在菲律宾对指状蔷薇珊瑚(Montiporadigitata)的移植实验中显示,水平移植和垂直移植对珊瑚存活率和生长的影响不大,反而是不同移植站位间环境差异影响更大[15]。在受到不同沉积物水平与风浪影响的站位移植多种珊瑚,其存活率在不同站位间出现了明显的差异,细柱滨珊瑚(Poritescylindrica)在受沉积物影响的站位存活率要好于小叶鹿角珊瑚(A.micropthalma)和薄片刺孔珊瑚(Echinoporalamellosa)[18]。火焰滨珊瑚(P.rus)以金属网作为移植基底的移植效果要明显好于以细柱滨珊瑚和死珊瑚骨骼作为移植基底的效果,即使经历了高水温影响,其14周存活率依旧保持在80%,而移植在死亡珊瑚骨骼上的存活率只有不足20%[20]。
珊瑚礁生态修复工作往往以移植珊瑚的存活率和生长率作为评判修复效果的标准[18-23],部分研究也会考虑移植珊瑚的健康率和患病率作为指示移植珊瑚健康状况的指标[19,22],或者用生态体积(Ecological Volume)估算其修复效果[23]。然而,在反映珊瑚礁生态状况时,多以造礁石珊瑚的覆盖率作为指标衡量珊瑚礁的健康,这造成难以直接评价珊瑚移植对珊瑚礁生态健康恢复的效用。相较于生长率和存活率,仅有少数较长期的研究关注移植珊瑚对提升修复区域的珊瑚覆盖率上的贡献[24-28]。
蜈支洲作为海南省三亚市的近岸岛礁,其岛屿周边分布着典型的近岸珊瑚礁,珊瑚礁受到旅游活动、渔业捕捞、海岸建设、近岸污染等因素的影响。由于蜈支洲是海南热门的旅游景点之一,每年接待大量的游客,游客数量在2017年已经达到了三百万人,但游客增多与工程建设可能造成了珊瑚覆盖率的下降[29]。蜈支洲北侧的珊瑚礁为5—10月游客潜水观光的主要区域,10—4月由于风向转变,北部风浪较大的原因,观光潜水区域则改换至西侧的珊瑚礁区,北侧珊瑚礁有半年的休息期。蜈支洲的造礁石珊瑚覆盖率由2007年的约80.0%降至2019年的21.5%,珊瑚群落构成从以分枝状的鹿角珊瑚为主转变为以风信子鹿角珊瑚、指状蔷薇珊瑚、丛生盔形珊瑚(Galaxeafascicularis)、澄黄滨珊瑚(P.lutea)的多种生长类型的造礁石珊瑚为主[30]。珊瑚礁的退化和水下珊瑚与鱼类数量的降低导致潜水体验变差,直接影响蜈支洲岛旅游资源质量和对游客的吸引力,降低游客参与潜水活动的兴趣,进而影响旅游公司的口碑、营业收入和就业。
为探讨在典型的近岸退化珊瑚礁区开展珊瑚礁生态修复的可能性与有效性,以及珊瑚修复工作对于提高造礁石珊瑚覆盖率的效果,本研究在蜈支洲岛北侧的夏季潜水观光区内开展珊瑚礁的生态修复,希望通过同相关旅游企业的合作共同恢复珊瑚礁健康,推动企业参与海洋生态保护并从中受益。
1 材料与方法
为了恢复蜈支洲退化珊瑚礁的水下景观与造礁石珊瑚数量,2016年中国科学院海南热带海洋生物实验站同蜈支洲旅游公司开始合作,在蜈支洲北侧的夏季潜水观光区内开展珊瑚礁修复工作。修复工作从2016年的11月一直延续至2020年,期间实施了多次的造礁石珊瑚移植和培育苗圃修建工作。珊瑚修复区域是蜈支洲夏季5—10月潜水观光的主要区域,面积约5 hm2,移植范围深度为1~6 m(图1)。移植珊瑚主要固定在珊瑚礁的礁石基底上,移植密度根据珊瑚礁底质状况,一般为2~5个珊瑚/m2,底质构成为碎石、沙子、泥沙等区域并未移植珊瑚。最早的移植开始于2016年11月(图2),移植珊瑚约150株,第一次移植珊瑚密度较高,达到15~20株/m2[图2(a)],2017年及之后的珊瑚移植则降低移植密度,保持每个移植珊瑚间有20 cm以上的生长空间。本研究主要探讨2017年6月同蜈支洲旅游公司合作移植的6 000株造礁石珊瑚对珊瑚礁修复区的珊瑚覆盖率的恢复效果。

图1 位于蜈支洲北侧的珊瑚修复区Fig. 1 Coral restoration area located in the north of Wuzhizhou Island, Hainan

图2 蜈支洲造礁石珊瑚的修复效果Fig. 2 Results of coral transplantation at Wuzhizhou Island(a): 2016年11月在蜈支洲移植的第一批造礁石珊瑚, (b): 生长10个月后的第一批移植珊瑚个体, (c): 生长43个月后的第一批移植珊瑚个体, (d): 2017年6月移植在样框内的珊瑚断枝, (e): 生长3 a后样框内的移植珊瑚, (f): 修复前的退化珊瑚礁底质, (g): 修复3 a后的珊瑚礁底质, (h): 珊瑚礁水下景观已经出现改善, (i): 被风浪打翻的移植珊瑚个体,箭头所指为生锈的移植钉。
移植珊瑚的母体来自于在移植实验期间被碰断、风浪打翻和部分生长于蜈支洲范围内的健康造礁石珊瑚个体。由于蜈支洲的珊瑚种类在退化前主要以分枝状造礁石珊瑚为主,优势度达到了0.90,但随后出现退化,分枝造礁石珊瑚的数量急剧减少[29,31]。为恢复珊瑚多样性和珊瑚数量,本次珊瑚礁修复工作中,移植珊瑚所采用的全部为分枝状的种类,其中又以鹿角珊瑚占绝大部分。移植珊瑚种类主要为风信子鹿角珊瑚、中间鹿角珊瑚(A.intermedia)、简单鹿角珊瑚(A.austera)、美丽鹿角珊瑚、柔枝鹿角珊瑚(A.tenuis)、两叉鹿角珊瑚(A.divaricata)、硬刺柄珊瑚(Hydnophorarigida)、指状蔷薇珊瑚。
采集到的造礁石珊瑚母体被分解成多个长度在5~10 cm的珊瑚断枝用于移植。移植采取的是将造礁石珊瑚断枝用塑料扎带捆绑固定在钉入珊瑚礁的铁钉上的方法,珊瑚断枝尽量贴近珊瑚礁底。该方法是国际上常用的珊瑚移植方法,其成本相较于使用环氧树脂胶固定珊瑚断枝更经济,固定效果好、操作方便,并且能够一定程度上抵御风浪影响,因此更适合在受台风影响的三亚海区实施应用[12]。用于固定珊瑚的铁钉之间的间距保持在20 cm以上,为珊瑚生长提供足够空间。
2017年10月、2018年8月、2019年10月和2020年7月分别对移植珊瑚存活率进行调查。方法为在修复区内潜水随机游动,记录见到的100株移植珊瑚,记录下存活和死亡的珊瑚个体,其中珊瑚脱落的个体被认为死亡并计入死亡率统计中,每次调查重复记录3次。
对珊瑚礁修复区内的造礁石珊瑚平均覆盖率的调查采用的是截点样带法,2017年10月、2018年8月、2019年10月和2020年7月在水下珊瑚礁上随机铺设3条10 m平行于岸线的样带,潜水沿样带拍摄珊瑚礁与样带,每条样带上取100个样点用于判读[32]。在电脑上统计样带上每10 cm整数刻度对应点下底质为造礁石珊瑚的点数,并计算造礁石珊瑚的覆盖率。为反映移植珊瑚对珊瑚覆盖率的影响,本研究采用固定样框法估算修复区不同时期造礁石珊瑚覆盖率的变化。我们在珊瑚礁修复区内移植珊瑚的区域建立两个5 m×10 m和一个5 m×5 m的固定样框,并在2017年6月、2019年10月和2020年7月分别对3个样框进行拍照。在电脑上使用ImageJ1.52i测量珊瑚覆盖率。沿照片中的移植与非移植造礁石珊瑚边缘描绘并测量其面积[19],计算两者的覆盖率。
修复区内造礁石珊瑚平均覆盖率以及样框中的珊瑚覆盖率的变化采用One-way ANOVA进行比较,由于修复区内造礁石珊瑚平均覆盖率的数据方差非齐性,用Dunnett T3分析显著性差异,分析软件为SPSS 21.0,作图软件为SigmaPlot 11.0。
2 结果与讨论
研究结果表明,蜈支洲珊瑚移植取得较好的修复效果。移植的珊瑚10个月后可以达到15 cm左右大小[图2(b)],3~4 a后,造礁石珊瑚个体出现明显的增长,直径一般在25~50 cm范围[图2(c)、(e)、(g)],最大的风信子鹿角珊瑚个体的直径已经接近100 cm。修复区域的存活移植珊瑚绝大多数个体的骨骼已经蔓延生长到珊瑚礁基底,珊瑚已稳定固着在珊瑚礁上。修复区域珊瑚礁的造礁石珊瑚数量和水下景观出现了明显的改善。本次珊瑚礁修复实验的周期历时37个月,超过约已报道过的80%的珊瑚礁修复实验周期;修复面积约50 000 m2,相较于国际上珊瑚修复面积中位数100 m2的规模,本次修复的面积超过绝大多数珊瑚礁修复案例[33]。
移植珊瑚在经历了37个月的生长后,存活率达到61.3%,在最初的4个月内存活率下降最明显,在随后的近3 a中则相对稳定。由于是随机选取样本统计,所以2019年移植珊瑚个体的存活率较2018年的出现了增加(图3)。根据移植后的观察,初期珊瑚个体死亡率较高是由于核果螺(Drupellaspp.)的摄食和移植基底上的藻类竞争压力造成的。Boström-Einarsson等(2020)对截止至2019年国际上已经报道的珊瑚礁修复工作进行统计,得到直接移植珊瑚的存活率中位数为64%[33],本实验中37个月的存活率稍低于该比例。然而,国际上统计的珊瑚修复工作有超过60%监测持续时间小于18个月,平均监测时间较短[33],以本实验在12个月和28个月的存活率来看,是与国际上的平均水平相当。由于鹿角珊瑚属中很多种类是珊瑚礁生态系统中的优势种和常见种、生长速度快、形态复杂、颜色多样,在珊瑚礁生态修复中常被作为主要的目标珊瑚类群被移植。根据Boström-Einarsson等(2020)对全球报道的珊瑚移植数据统计,直接移植鹿角珊瑚的平均存活率为56%[34],本次实验的移植珊瑚绝大多数为鹿角珊瑚,其存活率(61.3%)稍高于全球移植鹿角珊瑚的平均存活率,不过相对于Bayraktarov等(2016)提出的成功的修复工作要达到5 a的监测期和目标生物85%以上的存活率[35]的目标还相差甚远。
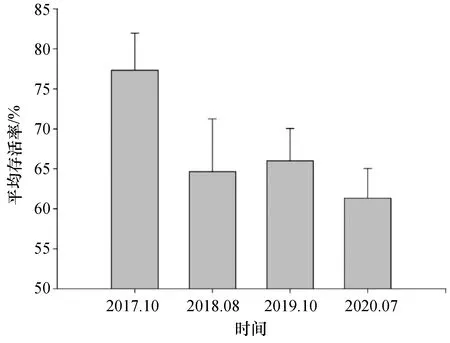
图3 蜈支洲移植造礁石珊瑚平均存活率的年际变化Fig. 3 Yearly variation of the average survival rate of transplanted corals at Wuzhizhou Island
利用截点样带法调查得到的蜈支洲珊瑚礁修复区的造礁石珊瑚平均覆盖率从2017年至2020年呈现增长的趋势,近3 a时间内平均覆盖率从2017年的9.3%提高到了2020年的35.3%(图4)。虽然珊瑚覆盖率在3 a内提升了近3倍,但由于截点样带法采用的是随机布设样带,同组样带点数据差异较大,平行样较少,导致对比2017年同2020年的平均覆盖率前后差异的结果并无显著性差异(p=0.052,F=3.508)。与截点样带法相比较,固定样框法虽然无法反映整个区域的珊瑚覆盖率变化,但固定样框法获得的覆盖率数据调查更能确切反映固定范围内的珊瑚覆盖率变化。因此,用固定样框法来估算造礁石珊瑚的覆盖率可能更能反映造礁石珊瑚移植的成效。与珊瑚移植初期的珊瑚覆盖率相比,2020年7月样框内的总珊瑚覆盖率为23.2%,相比2017年6月提升了18%的覆盖率(图5),两者间的差异非常显著(p=0.001,F=17.019)。其中样框中原生的珊瑚个体覆盖率在2017年6月是5.2%,2019年增加到7.3%,2020年7月达到8.3%,三者间并无显著差异(p>0.05),表明修复区内造礁石珊瑚覆盖率的提升主要来自珊瑚移植。根据测算,移植珊瑚个体在2017年移植前覆盖率为0%,从2017年6月到2019年10月,移植珊瑚个体的覆盖率增加了7.9%,2020年7月时达到14.9%,比2019年显著增长了7.0% (p=0.014,F=136.7)。从覆盖率增长来看,2017年至2020年覆盖率增长了18.0%,其中移植珊瑚贡献的覆盖率增长为14.9%,对珊瑚覆盖率增长的贡献达到了82.9%,移植珊瑚提供的增长率超过了原生珊瑚的近4倍。近4 a蜈支洲修复区珊瑚覆盖率的变化说明了在蜈支洲的珊瑚礁生态修复确实提升了造礁石珊瑚覆盖率,很大程度上弥补了退化珊瑚礁上珊瑚数量的不足、难以自我恢复的缺陷。
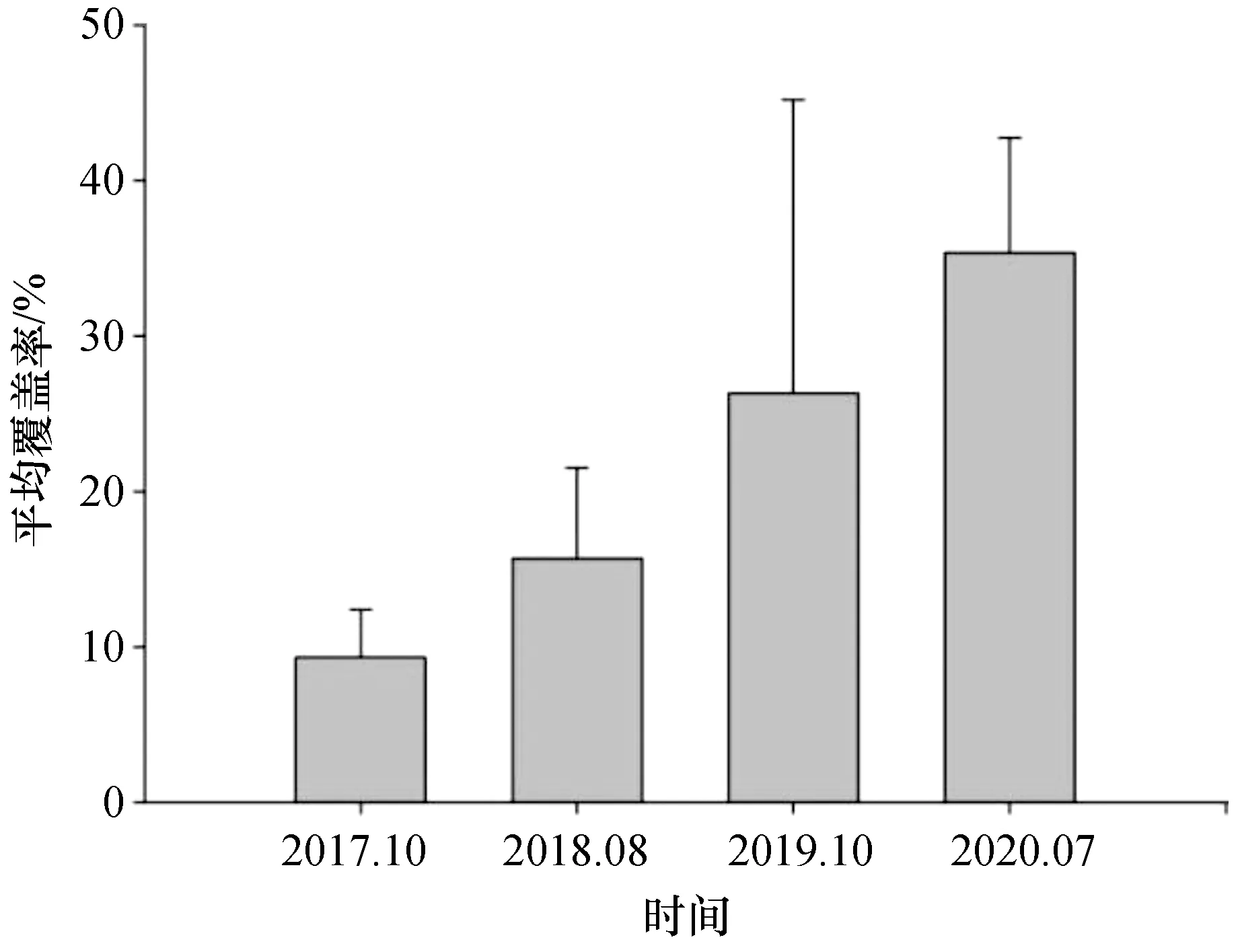
图4 修复区内造礁石珊瑚平均覆盖率年际变动趋势Fig. 4 Yearly variation of the average coral coverage in the restoration area
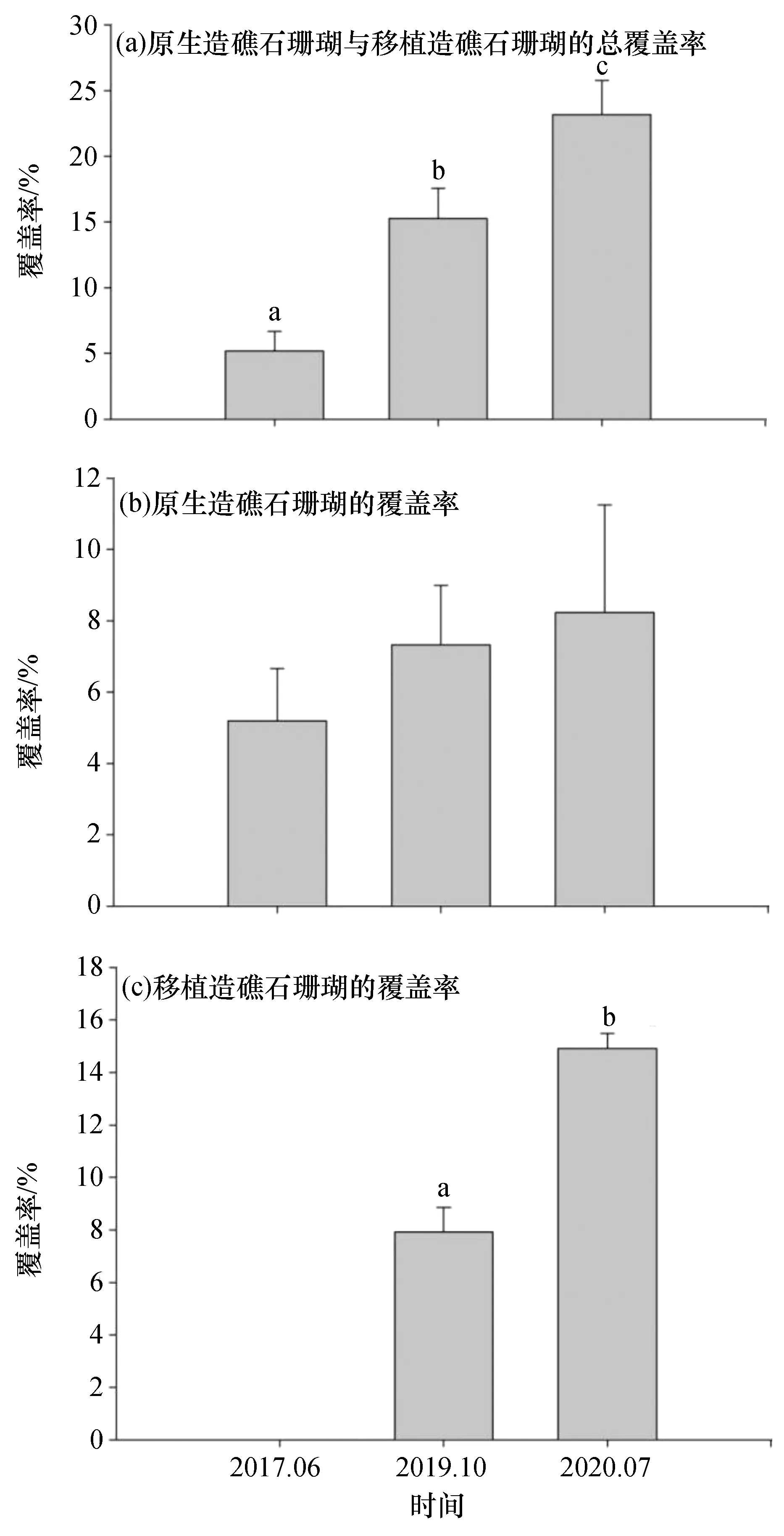
图5 固定样框中造礁石珊瑚覆盖率的变化Fig. 5 Variation of the average coral coverage in the fixed frames
在2006—2009年间蜈支洲珊瑚礁的珊瑚覆盖率在40.0%以上,但珊瑚幼体补充数量只有0.39~1.87 个/m2,已经处于珊瑚补充量不足的状况;随着蜈支洲珊瑚礁的持续退化,珊瑚补充量会更低,无法维持珊瑚礁的自我恢复[31]。在珊瑚幼体补充数量不足的情况下,利用珊瑚断枝或碎片的培育与移植提高珊瑚礁的覆盖率,可以帮助珊瑚礁重新恢复生态健康[15]。由于蜈支洲珊瑚礁的退化状况难以在几年内通过自然补充迅速恢复其生态状况,因此本实验利用珊瑚移植的修复方法辅助珊瑚数量恢复,使修复区内珊瑚覆盖率较修复前提升了2~3倍,取得了很好的修复效果。在泰国、马尔达夫和美国的佛罗里达3处地点的珊瑚礁修复实验,分别采用在人工礁体上和直接在珊瑚礁上移植珊瑚,也取得了提升珊瑚覆盖率1~3倍的结果[27]。由此可见,利用珊瑚移植作为生态修复的手段确实可以在几年内迅速提升退化珊瑚礁的珊瑚覆盖率,恢复造礁石珊瑚数量,这有利于缩短珊瑚礁的自我恢复时间[14]。而且,性成熟的移植珊瑚个体可为珊瑚礁提供更多的珊瑚补充,加快珊瑚数量的自我恢复,同时移植珊瑚也促使珊瑚礁的部分生态功能得到初步恢复。
本次珊瑚礁修复的效果相较于其它已报道的珊瑚礁修复实验具有恢复珊瑚种类多、移植数量大、修复面积更大的优点。Fox等(2005)在印度尼西亚的科摩多国家公园对珊瑚礁的破碎底质进行稳固,部分珊瑚在3 a内增加了500~1 000 cm2/m2的覆盖率[36],但其并未像本实验一样实施珊瑚移植,仅依靠珊瑚的补充提升覆盖率,因此珊瑚覆盖率提升较慢。Gomez等(2006)在菲律宾Bolinao珊瑚礁中的3大块礁石上移植960个细柱滨珊瑚,约18个月后,移植的珊瑚几乎覆盖住礁石全部面积[26]。该实验仅采用了单种珊瑚进行移植,并且移植珊瑚的面积有限,每个移植珊瑚间的间隔仅15或30 cm,移植密度远高于本实验。2014年100个铝合金人工礁体被放置在蜈支洲珊瑚礁内用于珊瑚苗圃培育,生长速率最快的鹿角珊瑚达到了11.0~12.1 cm/a,仅3 a后珊瑚在铝合金礁体上的覆盖率就接近100%[30]。该实验在约1 m2大小的礁体上移植的珊瑚断枝约为30个,而本实验移植珊瑚密度较高的区域也仅为4~5个/m2,这是造成本实验3 a的珊瑚覆盖率不及铝合金礁体上的珊瑚覆盖率增长快速的主要原因。此外,移植在铝合金礁体上的珊瑚断枝远离珊瑚礁的底质,受沉积物和敌害的影响更少,存活率也更高,这在其它移植实验中也得到证实[37],因此相比于本实验直接移植在珊瑚礁底质上更具有存活率的优势。
许多珊瑚礁修复工作利用人工礁体作为移植珊瑚的辅助手段,虽然在人工礁体上移植珊瑚具有一定优势,但其自身也具有部分缺陷。移植在人工礁体上的珊瑚同移植在自然底质上的珊瑚相比,珊瑚断枝固着生长至底质上的速度更慢[37]。海浪或台风造成人工礁体的破坏、翻覆、倾斜等都会导致其上移植的珊瑚脱落、死亡。中国科学院南海海洋研究所2010年在西沙群岛永兴岛海域放置的6个用钢筋焊接的人工礁体,由于台风破坏发生翻覆,其上移植的珊瑚全部脱落死亡。在三亚湾鹿回头利用礁体移植珊瑚的实验中,台风“康森”造成了人工礁体上珊瑚个体脱落和珊瑚组织部分死亡的比例增加[19]。本次实验期间,无直接登陆三亚的台风,但有6个台风对三亚造成影响,其中2017年9月14—15日的台风“杜苏芮”(Doksuri)风力最强,从南部经过三亚时风力达到13级(38 m/s)。2018、2019年对三亚造成影响的4个台风风力在7~10级之间。2018年的台风造成蜈支洲的铝合金礁体大部分被摧毁,其上的珊瑚大量死亡,礁体上的珊瑚覆盖率从48.6%降至低于10.0%[30],而同时间在蜈支洲珊瑚礁底质上移植的珊瑚断枝并未出现大规模死亡的现象,仅有个别个体因未稳固生长至基底上出现翻覆[图2(i)],说明在珊瑚礁底质上原位移植的造礁石珊瑚一旦固着至珊瑚礁底质上后,具有良好的抗风浪效果。此外,利用人工礁体或底质实施珊瑚礁修复,会将大量的水泥、金属、塑料等非自然的材料引入珊瑚礁,可能对珊瑚礁环境造成污染,影响周边环境。最重要的是,只有当珊瑚移植至珊瑚礁上,珊瑚才能完全发挥其对珊瑚礁生态系统的生态功能,如为珊瑚礁生物提供庇护、控制藻类数量、增加珊瑚礁的三维结构、抵御风浪等[5]。
对于潜水和浮潜游客来说,水下珊瑚礁的景观直接影响其对景点体验的满意程度,同时也关系到景点的口碑和未来的市场[38]。为提升景点的吸引力、维护周边生态环境、招揽更多游客,泰国、马尔达夫、墨西哥等国家有多个旅游公司主动参与甚至主导珊瑚礁生态修复工作[39]。蜈支洲作为三亚的著名旅游景区,其水下珊瑚礁生态健康关系到景区的水下景观、游客水下观光体验、海区近岸生态安全、海岸保护等多个方面,因此近年来当地旅游公司加强了对蜈支洲珊瑚礁生态健康的关注。本实验通过同蜈支洲旅游公司的合作,修复了蜈支洲潜水观光区域内的珊瑚礁生态,扭转了退化珊瑚礁内珊瑚数量稀少、水下景观单调的状况[图2(d)、(f)],部分恢复了修复区域内的水下景观[图2(c)、(e)、(g)、(h)],提升了游客潜水体验,旅游企业的潜水营业收入和具备的旅游资源质量都得到提高。通过对珊瑚礁的修复,也提升了相关从业人员的环保意识。旅游公司的潜水员从2016年开始修复时认为修复挤占了他们潜水待客的区域、采集珊瑚母体占用了原本不多的珊瑚资源,到现在会带领游客到修复后的区域拍照、主动要求在他们待客区域移植更多珊瑚、向游客讲解珊瑚礁修复工作。
3 结论
通过在蜈支洲开展的退化珊瑚礁生态修复实验,采用在退化的珊瑚礁底质上直接移植多种分枝状造礁石珊瑚,近3 a的时间内将修复区的造礁珊瑚覆盖率从9.3%提升到35.5%,增加了近3倍。移植珊瑚的覆盖率增长是修复区内珊瑚覆盖率增长的主要原因,贡献了82.3%的增长。从恢复效果来看,珊瑚礁修复工作有效地恢复了珊瑚礁的造礁石珊瑚数量,改善了珊瑚礁的水下景观,带动了相关企业参与海洋生态保护的积极性。本研究结果证明了利用原位珊瑚移植等珊瑚礁生态修复技术恢复近岸退化珊瑚礁生态是可行和有效的。

