抗幽门螺杆菌细胞空泡毒素纳米抗体的制备及鉴定
刘晓芳,刘琼,黄云祥,钟引凤,何庆华,李燕萍,涂追,付金衡*
(1.南昌大学 生命科学学院,江西南昌 330031;2.中德联合研究院,江西南昌 330047;3.食品科学与技术国家重点实验室,江西南昌 330047;4.南昌大学基础医学院,江西南昌 330031)
幽门螺杆菌(Helicobacter pylori,Hp)是一种慢性感染的病原菌,世界卫生组织将其定为Ⅰ类致癌原[1],细胞空泡毒素(Vacuolating cytotoxin,Vac A)是Hp产生并经自转运蛋白途径分泌到胞外的蛋白,在体外能使宿主细胞产生空泡变性,VacA还可引起线粒体膜通透性改变,抑制细胞凋亡[2]、诱导肿瘤细胞自噬[3]、促进HCO3-释放并降低胃酸分泌[4]等。针对特异性识别VacA的研究主要体现在肽[5]、单链抗体(scFv)[6]、卵黄抗体[7]和单克隆抗体[8],然而具有亲和力高、稳定性好、免疫原性低、分子量小、易于基因工程改造的纳米抗体[9-10]却未见报道。
因此,本实验聚焦抗Hp细胞空泡毒素纳米抗体的研究,构建了纳米抗体噬菌体免疫文库,采用固相亲和淘选技术,从该文库中获得了抗幽门螺杆菌VacA纳米抗体,通过基因工程技术获得了原核表达的纳米抗体,并进行了初步功能鉴定,为抗幽门螺杆菌VacA纳米抗体的应用奠定了基础。
1 材料与方法
1.1 主要材料与试剂
幽门螺杆菌J99菌株质粒由南昌大学基础医学院刘琼讲师提供;大肠杆菌TG1、噬菌粒载体pComb3XSS、辅助噬菌体M13KO7、原核表达载体(pET25b)为实验室保存;卵清蛋白(OVA)、牛血清蛋白(BSA),购自上海生工生物工程有限公司;TA克隆试剂盒购自Takara;EasyGeno快速重组克隆试剂盒购自天根生化科技有限公司。
1.2 方法
1.2.1 获取幽门螺杆菌VacA基因及原核表达
据NCBI上AF049653.1的VacA基因设计引物,VacA-F1为 5'-GGAATTCCGAAATACAACAA ACACACCGC-3'(EcoRI),VacA-R1 为 5'-CCG CTCGAGCGGATTGGTACCTGTAGAAACATTAC-3'(xhoI)。以Hp菌液为模板进行PCR扩增VacA基因。根据Mighty TA-cloning Kit进行TA克隆以减小序列突变的概率,电转至E.coliDH5α感受态中,菌落PCR验证阳性克隆并测序。EcoRI和HindⅢ双酶切pMD20-T-VacA质粒和pET25b质粒,酶连电转至E.coliRosetta感受态中,1 mmol/L IPTG 25 ℃诱导4 h,超声破碎SDS-PAGE鉴定。
1.2.2 重组蛋白的变性、纯化及复性
目的蛋白用包涵体洗涤液(50 mmol/L Tris-HCl,pH 8.0,100 mmol/L NaCl,1 mmol/L EDTA,0.5%Triton-100)洗涤,加入包涵体变性液(50 mmol/L Tris-HCl,pH 8.0,100 mmol/L NaCl,1 mmol/L EDTA,10 mmol/L DTT,8 mol/L尿素),于4 ℃下变性1 h,离心取上清过Ni柱纯化,在含高纯度目的蛋白的洗脱液中加入等体积的复性液(50 mmol/L Tris-HCl,pH 8.0,100 mmol/L NaCl,1.5 mmol/L GSH,0.3 mmol/L GSSG,0.5 mol/L L-精氨酸)3次以逐步稀释尿素浓度,用10 kDa透析管透析后备用。
1.2.3 抗幽门螺杆菌纳米抗体噬菌体展示文库的构建
用灭活的HpJ99菌株四次免疫羊驼后取血提总RNA,反转录合成cDNA,以cDNA为模板,通过巢式PCR方法获得VHH基因,第一步以AlpVh-LD(5'-CTTGGTGGTCCTGGCTGC-3') 和 CH2-R(5'-GGTACGTGCTGTTGAACTGTTCC-3') 为 引物,扩增出约700 bp的VH域;第二步以VHH-1(5'-CATGCCATGACTGTGGCCCAGGCGGCCCAGKTGCAGCTCGTGGAGTC-3') 和 VHH-2(5'-CATGCC ATGACTCGCGGCCGGCCTGGCCATGGGGGTCTTCG CTGTGGTGCG-3')或 VHH-3(5'-CATGCCATGACT CGCGGCCGGCCTGGCCGTCTTGTGGTTTTGGTGTCT TGGG-3')为引物,扩增出约500 bp的VHH基因。VHH基因和噬菌粒载体pComb3XSS用S fiⅠ单酶切,T4DNA连接酶连接后电转至E.coliTGI感受态细胞中,固态培养12 h,M13KO7辅助噬菌体感染,构建抗Hp纳米抗体的噬菌体展示文库,并通过插入率、库容及多样性评估文库质量。
1.2.4 抗Hp纳米抗体噬菌体展示文库的淘选及阳性噬菌体鉴定
以重组蛋白VacA为靶点,从纳米抗体噬菌体展示免疫库中筛选出能特异性结合VacA的纳米抗体。按表1条件进行三轮筛选,每一轮筛选后,取10 μL洗脱物测滴度,剩余洗脱物扩增后用于下一轮的筛选。间接phage-ELISA鉴定阳性菌,具体操作方法参照文献[11]。OD450样本值/OD450阴性对照值≥2视为阳性菌,将阳性菌进行特异性验证并测序。

表1 固相淘选条件
1.2.5 抗重组幽门螺杆菌VacA纳米抗体的原核表达
根据EasyGeno快速重组克隆试剂盒设计能特异性扩增VHH基因的引物F'(5'-AGCCGGCGATGGCCATGCAGTTGCAGCTCGTGGATGC-3') 和R'(5'-ATCTCGAGTGCGGCCGCCTGGCCGGCCTGGCC GTCTTG-3'),pET25b(+)用 Nco Ⅰ和 Not Ⅰ双酶切后,按EasyGeno快速重组克隆试剂盒配制10 μL的连接体系,于50 ℃反应15 min立即冷却钙转至Rosetta(DE3)感受态细胞中固态过夜培养,随机挑取单克隆进行菌落PCR验证并测序。用0.1 mmol/L IPTG振荡培养6 h超声破碎,将含有目的蛋白的上清进行Ni柱纯化,SDS-PAGE鉴定纯化结果。
1.2.6 鉴定抗重组幽门螺杆菌VacA纳米抗体结合Hp的活性
通过间接酶联免疫吸附剂测定(ELISA),鉴定原核表达的抗VacA纳米抗体结合Hp的活性[11],包被3 μg/mL的幽门螺杆菌全菌蛋白,结合时,加入不同浓度的纳米抗体,测OD450,根据OD450样本值/OD450空白对照值≥2时,即认为纳米抗体在该浓度下具有结合幽门螺杆菌的能力。
1.2.7 抗重组幽门螺杆菌VacA纳米抗体抑制Hp鉴定
通过在一定时间内测定CO2浓度的变化,评估纳米抗体抑制幽门螺杆菌活性的能力,即体外培养幽门螺杆菌至1×109CFU与不同浓度的纳米抗体于4 ℃下孵育16 h,加入100 μL 500 mmol/L尿素和0.2 g/L的酚红混合液于37 ℃下孵育3 h,每30 min测定OD550,根据公式(1)计算抑制率。

2 结果与分析
2.1 幽门螺杆菌VacA基因的扩增、蛋白表达及纯化
琼脂糖凝胶电泳鉴定PCR扩增产物如图1A所示,大约2 200 bp左右有一条与幽门螺杆菌VacA基因理论分子量大小(2 248 bp)相近的条带,故成功扩增到幽门螺杆菌VacA基因片段。阳性克隆子原核表达后SDS-PAGE电泳如图1B所示,VacA重组蛋白分子量大小约85 kDa,与理论值相符,复性后获得高纯度的目的蛋白。

图1 幽门螺杆菌VacA PCR产物及蛋白鉴定图
2.2 抗幽门螺杆菌纳米抗体噬菌体展示文库的构建
如图2A所示,在泳道1中可见18S和28S两条带,表明RNA没有降解。两步巢式PCR技术扩增VHH基因片段,第一步巢式PCR产物鉴定如图2B所示,750 bp左右出现长铰链重链抗体编码的可变区基因目的条带;第二步反应以第一步回收纯化后的产物作为模板进行扩增,如图2C所示,在450 bp左右出现与预期扩增的VHH片段大小相符的条带,纯化PCR产物将其与噬菌粒载体pComb3XSS分别进行S fiⅠ酶切,酶连后电转至E.coliTGI感受态中,37 ℃固态培养12 h,随机挑取24个单菌落进行菌落PCR验证。如图3A所示,在650 bp左右有条带,计算出VHH基因插入率为87.5%,测序后进行多序列比对结果如图3B所示,21个阳性克隆的基因均为编码VHH的基因序列,抗体库的有效库容达到4.68×107CFU。

图3 噬菌体展示文库菌落PCR鉴定及序列比对图
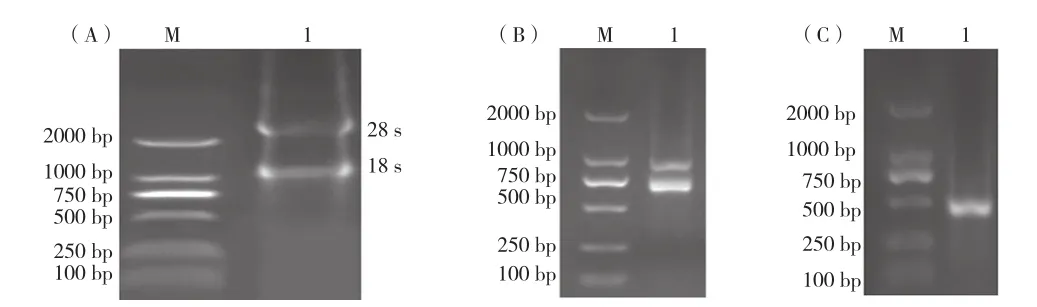
图2 VHH总RNA及巢式PCR产物鉴定图
2.3 抗幽门螺杆菌纳米抗体噬菌体展示文库的淘选
以重组蛋白VacA为靶分子,经过3轮固相淘选,每轮以“吸附-洗涤-洗脱-扩增”为主要步骤,逐轮降低靶分子包被浓度、文库投入量,通过增加洗涤次数来富集特异性结合VacA的纳米抗体,结果如表2所示,噬菌体克隆得到有效富集。

表2 各轮淘选中结合VacA的噬菌体克隆的滴度和富集度
2.4 间接phage-ELISA鉴定阳性克隆
包被重组蛋白VacA,间接phage-ELISA鉴定阳性菌,将OD450样本值/OD450阴性对照值≥2的噬菌体送测序,采用Alignment进行多序列对比分析,得到6种抗体序列,选取吸光度值较高的阳性噬菌体进行交叉验证,结果如图4所示。克隆HV2-36 OD450值较高且与BSA和OVA无交叉反应,因此,采用HV2-36进行后续实验。
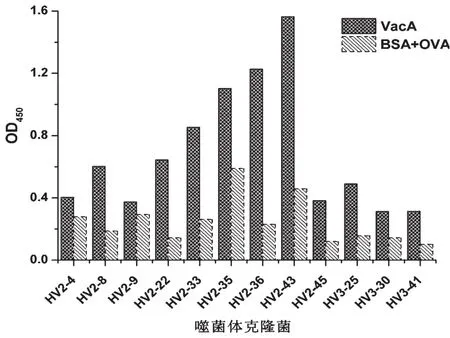
图4 间接phage-ELISA鉴定阳性菌
2.5 表达载体pET25b(+)-HV2-36的构建及纳米抗体的表达与纯化
阳性克隆的菌落PCR鉴定结果如图5A所示,在750 bp处扩增到目的条带及测序结果表明,表达载体pET25b(+)-HV2-36构建成功。将重组表达载体钙转至E.coliRosetta(DE3)感受态细胞,0.1 mmol/L IPTG诱导表达6 h,SDS-PAGE鉴定纯化效果,结果如图5B所示,在20 kDa处有符合目的蛋白分子量大小的条带。
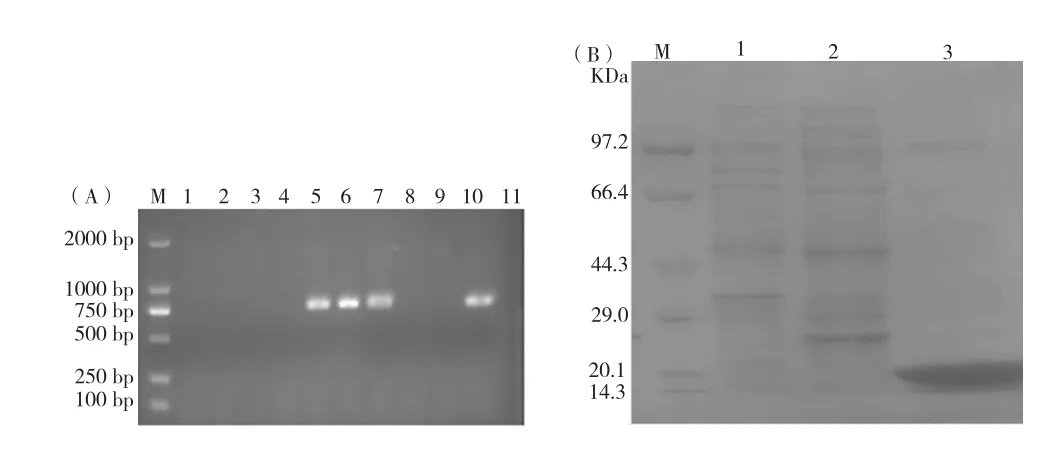
图5 纳米抗体重组载体克隆子的菌落PCR鉴定及原核表达图
2.6 HV2-36结合幽门螺杆菌的活性分析
以破碎的幽门螺杆菌全菌蛋白为检测抗原,分别测定不同浓度的纳米抗体HV2-36结合幽门螺杆菌的活性。如图6所示,纳米抗体浓度为112.4 μg/mL时对Hp几乎无结合力。
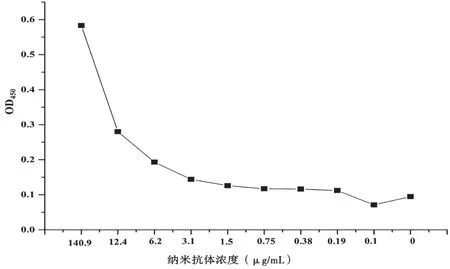
图6 间接ELISA鉴定纳米抗体结合幽门螺杆菌活性图
2.7 纳米抗体HV2-36抑制幽门螺杆菌活性分析
不同浓度的纳米抗体与109CFU幽门螺杆菌J99菌株孵育,通过检测一定时间内CO2浓度的变化,分析纳米抗体抑制Hp活性的能力。如图7所示,当纳米抗体浓度在30 μg/mL时,HV2-36抑制率为31.13%。
幽门螺杆菌是一种引起多种疾病的革兰氏阴性微需氧菌,其致病性主要与尿素酶B[12]、细胞毒素相关蛋白A、细胞空泡毒素[13]、黏附素[14]等致病因子有关。本实验以重组蛋白VacA为靶标,从Hp灭活菌免疫后构建的噬菌体展示文库中筛选出与重组蛋白VacA特异性结合的阳性噬菌体,测序发现,从多样性较好的文库中,淘选获得了6种不同序列的阳性噬菌体。具有独特性质的纳米抗体,不仅能够结合细菌表面抗原,拮抗细菌对宿主细胞的黏附[15],还可通过拮抗细菌侵袭有关的毒力因子产生抗菌作用[16]。抗尿素酶B纳米抗体能有效抑制尿素酶的活性,从而减少Hp在胃黏膜上皮细胞的定植,所以纳米抗体被认为是一种颇具前景的Hp感染的治疗方法[17-18]。
3 结论
本实验挑选出与重组蛋白VacA结合力较高的HV2-36进行原核表达载体的构建,获得了可溶性好且表达量高的HV2-36纳米抗体,采用间接ELISA鉴定其能特异性结合Hp。HV2-36纳米抗体浓度为30 μg/mL时,对Hp抑制率达到了31.13%,该研究结果为使用纳米抗体检测和治疗幽门螺杆菌感染奠定了基础。

