猪源伪狂犬病病毒变异株传代致弱株LA2017株的获得与鉴定
郑亚婷,郭容利,陈赛赛,乔永峰,王志胜,许梦微,5,刘娅梅,张传健,吕家轩,5,王继春*
(1.江苏省农业科学院 动物免疫工程研究所,江苏 南京 210014;2.江苏省农业科学院 国家兽用生物制品工程技术研究中心,江苏 南京 210014;3.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009;4.江苏省农业科学院 兽医研究所,江苏 南京 210014;5.南京农业大学 动物医学院,江苏 南京 210095)
猪伪狂犬病(Pseudorabies, PR)是猪的一种以发热、繁殖障碍和脑脊髓炎为主要症状的急性传染病[1],其流行方式包括散发与地方性流行。PR在全年任何时间均可发生,其中冬季与春季发生较多。近年来养猪业呈集约化发展,并且集约化程度越来越高,使PR的危害变得更为严重。PR由伪狂犬病病毒(Pseudorabies virus, PRV)引起,PRV属于疱疹病毒科、α疱疹病毒亚科、水痘病毒属,为一种线性双链DNA病毒,其基因组全长约145 kbp,共编码70多种蛋白质[2]。在PRV中共发现了11种糖蛋白,包括gB、gC、gD、gE、gG、gH、gI、gK、gL、gM、gN。病毒对细胞的吸附需要gB和gC参与,病毒与细胞质膜的融合需要gB、gH、gI等蛋白。与病毒增殖相关的必需蛋白包括gB、gD、gH、gK、gL以及gN,非必需蛋白主要有gC、gE、gG、gI和gM[3]。这些蛋白可以介导PRV与受感染动物细胞之间的融合,促使病毒的扩散与释放,以及影响宿主细胞蛋白合成跟免疫逃避[4]。
目前公认对猪伪狂犬病有效的防控方法是疫苗免疫,其中PRV基因缺失疫苗具有毒力低、免疫原性强、稳定性好、可区分疫苗免疫与自然野毒感染动物等优点[4],有两种类型,分别为自然缺失弱毒活疫苗以及基因工程人工缺失活疫苗。自然缺失弱毒活疫苗的制备方法主要包括由野毒株直接盲传,加诱变剂或由非猪源细胞盲传,也可以通过提高培养温度传代获得。目前市场已有的自然缺失弱毒活疫苗主要有:匈牙利的Bartha株、罗马尼亚的Bucharest株、BUK株[5]、TK200株、北爱尔兰的NIA4株、法国的Alfort-26株[6]、前苏联的VGNK-I株、保加利亚的MK25株、南斯拉夫的Bkal68株和Govacc株、中国的C株等[7]。
PRV基因工程人工缺失疫苗是为降低病毒毒力,将野毒株基因组中与致病力相关的基因经人工缺失突变后制备出的一种活疫苗,主要删除的有TK、RR、gE、gI等相关基因。市场上已有的PRV基因工程疫苗或疫苗候选株主要包括gE/gI/TK基因缺失的SA215、缺失TK/gG基因的HB-98疫苗株、gE缺失的LA-A株[8]、gE/TK双缺失的LA1206株[9]、gE/gI基因缺失的PRVJS-2012候选株[10]、gE/gI缺失[11]以及gE/gI/TK缺失[12]的PRVTJ株、gE/gI/TK缺失的PRVHN1201株[13],以及gE/gI缺失的PRVZJ01株[14]等。虽然目前已成功研制出缺失gC与gG基因的疫苗,可是大多数国家在猪上只允许使用缺失gE基因的疫苗,因此,可以通过血清学诊断技术来区分接种过疫苗的猪以及感染野生病毒的猪[15]。
20世纪60年代PRV开始在中国流行,之后BarthaK61株、HB-98株和SA215株疫苗的使用使疫情得到了良好的控制[16]。但是,在2011年,很多注射过BarthaK61疫苗的养殖场的猪都感染了PRV,表现为新生仔猪患致命性脑炎,母猪出现繁殖障碍,生长育肥猪和仔猪大量死亡。经分离鉴定,证实此次暴发流行是由PRV变异株引起的[17],说明传统疫苗株已经不能完全免疫PRV的流行变异株,需要研制出针对变异株的新型疫苗[18]。
本试验取猪源伪狂犬病病毒强毒变异株AH02LA株进行传代,获得了致弱株LA2017株,并对其安全性、稳定性、免疫效力及生长特性进行了测定。结果显示传代致弱株LA2017株免疫原性好、安全性高,在ST细胞及CEF上生长良好,滴度均能满足活疫苗生产的要求,是一株研制针对PRV变异株疫苗的优良候选株。
1 材料与方法
1.1 材料
毒株:伪狂犬病病毒(Pseudorabies virus, PRV)AH02LA株,系本研究团队分离鉴定的强毒株,已交中国微生物菌种保藏管理委员会普通微生物中心进行保藏,保藏号为CGMCC No.10891,保藏日期为2015年6月16日。
细胞: 鸡胚成纤维细胞(Chicken embryo fibroblasts, CEF),按常规方法制备;用于制备 CEF的SPF鸡胚购自北京梅里亚维通实验动物技术有限公司。
28~35日龄健康断奶仔猪,以及PRV、PRRSV和CSFV抗原和抗体均为阴性;试验猪来自南京市六合区养殖户,试验猪引入后在隔离环境中饲养。
主要试剂:LA Taq DNA聚合酶、dNTP Mix、2×GC Buffer Ⅰ(Ⅱ)、DL 15000 DNA Marker来自宝生物工程(大连)有限公司。胎牛血清(FBS)和DMEM培养基为Invitrogen公司产品;CIVTEST SUIS ADV gB、CIVTEST SUIS ADV gE诊断试剂盒购自西班牙HIPRA公司,其他各种试剂均为国产分析纯试剂。
1.2 方法
1.2.1 伪狂犬病病毒PRV AH02LA株的盲传 将9~10日龄SPF鸡胚制备CEF,培养液用含10%初生牛血清的DMEM,置于37 ℃培养箱中24~48 h,获得单层CEF细胞。取PRV AH02LA 株F6代病毒液0.1 mL接种于六孔板CEF细胞中的1孔,吸附1 h。弃上清,用无菌PBS洗涤3次后,吸净上清,加入含10%初生牛血清的DMEM培养液,置于37 ℃培养箱中24~48 h。用以上方法再取细胞培养物上清0.1 mL接种于新鲜CEF,直至盲传到F185代,每10~20代取样冻存于-70 ℃备用。
1.2.2 PRV AH02LA株盲传致弱株种子批的建立 应用PRV AH02LA株盲传致弱株的F20、F51、F110、F151和F185代,接种长满单层的新鲜ST细胞。培养36~48 h后收获,冻融3次,以8000 r/min的转速离心,然后取上清,分装保存于-70 ℃。取样按现行《中华人民共和国兽药典》检测病毒的TCID50。
1.2.3 PRV AH02LA株盲传致弱株的安全性 应用PRV AH02LA株盲传致弱株的F20、F51、F110、F151和F185代,分别以0.5×106.50TCID50/mL的剂量滴鼻接种28~35日龄PRV阴性断奶仔猪(PRRSV抗原和抗体也为阴性)各5头,每头接种2 mL。攻毒后每日对试验猪的体温、精神状态、饮食情况与临床表现进行检测与观察,直至接种后14 d。并检测接种前和接种后的PRV gE和gB的ELISA抗体。
1.2.4 PRV AH02LA株盲传致弱株的免疫保护效力 应用PRV AH02LA株盲传致弱株的F151和F185代,选取28~35日龄PRV阴性断奶仔猪(PRRSV抗原和抗体也为阴性),以0.5×106.00TCID50/mL的剂量颈部肌肉注射,分别接种5头试验猪,每头接种2 mL。在21 d后,用PRV AH02LA株以106.50TCID50/mL的剂量对这两组与对照组同时进行滴鼻攻毒,每头接种2 mL。攻毒后每日进行体温监测,观察试验猪的精神状态、饮食以及临床表现,并通过鼻拭子样品来检测排毒,持续至攻毒后14 d。分别在攻毒前、攻毒后14 d检测PRV gE和gB的ELISA抗体。设BarthaK61疫苗作为对照。
1.2.5 病毒的克隆纯化 制备CEF并铺于六孔细胞板中,将获得的F151代致弱毒株稀释至200~500 TCID50/mL,将其加入1孔细胞中,吸附1 h后吸去病毒液,细胞用无菌PBS洗3次后,用含0.5%(质量分数)甲基纤维素和10%初生牛血清的DMEM培养,置37 ℃下12~18 h。挑取单个病毒蚀斑,接种于新鲜的CEF,吸附1 h后,再经洗涤后加0.5%(质量分数)甲基纤维素的培养基继续培养。按以上挑斑克隆纯化步骤进行3轮后,获得了1株病毒,将其命名为PRV LA2017株(保藏号:CGMCC No.18170)。
1.2.6 PRV LA2017株的序列测定
1.2.6.1 病毒DNA的提取 按文献[19]所述的方法进行,病毒以0.01感染复数(multiplicity of infection, MOI)接种CEF。当细胞病变大约为80%时,去上清,在六孔板中加入2 mL/孔的消化液、20 μL/孔的蛋白酶K,于37 ℃缓慢振荡过夜。将消化液分装至EP管中,加入苯酚、氯仿(1∶1)混合液,轻摇5~10 min,以12000 r/min离心5 min;取上清至1个新的EP管,加入等体积的氯仿,轻摇5~10 min,以12000 r/min离心5 min;再取上清至1个新的EP管中,加入Rnase,使其终体积为20 μL/mL,置于37 ℃下孵育30 min。加入等体积的异丙醇及上清体积1/10的3 mol/L醋酸钠,缓慢上下翻转混匀后,以12000 r/min于4 ℃离心30 min;弃上清,用70%酒精洗涤沉淀2次,以12000 r/min 于4 ℃离心5 min;然后弃上清,置于通风处晾干沉淀,在管底加入100~300 μL的灭菌水,置于37 ℃下30 min以溶解DNA,最后于-20 ℃保存。
1.2.6.2 PRVgC、gD和US6-US2序列的PCR扩增和序列测定 以GenBank中的PRV全基因组序列(GenBank: JF797218)为参考,使用Vector NTI软件,设计gC、gD和US6-US2基因鉴定引物(详见表1)。引物由南京金斯瑞生物科技公司合成。
以病毒DNA为模板,按表1中的引物与表2中的体系进行PCR扩增,反应程序如下:94 ℃ 4 min;94 ℃ 40 s,58 ℃ 40 s,72 ℃延伸合适时间,共30个循环;72 ℃ 10 min。产物用含1%琼脂糖凝胶进行电泳,切出特异性条带,用DNA凝胶回收试剂盒回收,产物送至华大基因公司测序。
1.2.7 PRV LA2017株的稳定性检测 将PRV LA2017株接种CEF,连续传代,从F1代传至F35代。分别提取F18和F35代病毒的DNA,并以此为模板,按上述体系与程序进行PCR,将所得产物用1%琼脂糖凝胶进行电泳,切出特异性条带,用DNA凝胶回收试剂盒回收,将产物送华大基因公司测序。
1.2.8 PRV LA2017株的生长特性鉴定 将PRV LA2017株F1、F18和F35代以0.004 MOI分别接种长满单层的六孔板上的CEF和ST细胞,在37 ℃、5% CO2的培养箱中吸附1 h,弃上清,细胞用PBS洗3次后,换2 mL/孔、含3% FBS的DMEM,放回37 ℃培养箱中。分别于接种后0、6、12、24、36、48和72 h测定培养物中病毒含量。设PRV AH02LA株F5代种毒为对照,采用相同方法检测,重复3次。细胞培养物中病毒含量检测按照以下方法:在指定时间点分别将培养物全部取出,经-70 ℃与37 ℃反复冻融3次后取0.5~1.0 mL,以500 r/min离心5 min后,取100 μL上清液,加入到900 μL DMEM培养基中并混合均匀,再从中吸取100 μL,加入900 μL DMEM培养基中,重复以上步骤至10-10,即作10~1010倍比稀释。将CEF与ST细胞铺满单层至96孔细胞板中,取不同滴度的病毒稀释液分别接种CEF或ST细胞,每个浓度设置4~8个重复,置于37 ℃培养箱中吸附2 h,弃去病毒液,用PBS洗涤3次后,在每孔中加入100 μL含3% FBS的DMEM培养基。放回培养箱中,在12 h之后,观察细胞有无出现病变,持续3 d,用Reed-Muench法计算病毒TCID50,统计所有时间点的病毒滴度,以此绘制病毒生长曲线。
2 结果与分析
2.1 PRV AH02LA株盲传致弱株的获得与安全性
对PRV AH02LA株盲传致弱株的F20、F51、F110、F151和F185代分别制备了种子批,病毒含量分别为108.25、108.00、108.00、107.875和108.00TCID50/mL。在接种健康断奶仔猪后,F20、F51和F110代试验猪的体温全部明显升高,部分出现临床症状,包括打喷嚏、食欲不振或废绝、精神萎靡、呼吸困难、转圈或卧地、四肢划水状等,甚至发生死亡;在接种后14 d,PRV gE和gB的ELISA抗体均为阳性。F151和F185代接种猪的体温均未超过39.5 ℃,饮食和精神均正常,未出现任何猪伪狂犬病症状;在接种后14 d,PRV gB的ELISA抗体均为阳性,而PRV gE的ELISA抗体均为阴性(表3)。

表3 PRV AH02LA 株盲传致弱株不同代次的安全性
2.2 PRV AH02LA株盲传致弱株免疫后的攻毒保护作用
用PRV AH02LA株盲传致弱株的F151和F185代对健康断奶仔猪分别进行免疫接种,在免疫后21 d同时用PRV AH02LA株对这两组、BarthaK61疫苗免疫组以及对照组进行攻毒。结果显示:在攻毒之后,对照组试验猪全部出现体温升高的症状,至41.5 ℃以上,并伴有打喷嚏、精神萎靡、食欲不振或废绝、呼吸困难、转圈或卧地、四肢划水状等症状,其中3头试验猪死亡;经检测,攻毒后2~5 d均有排毒;经血清学检测,攻毒前PRV gB和gE的ELISA抗体全部为阴性;在攻毒后14 d用试剂盒对存活猪的PRV gB和gE ELISA抗体进行检测,结果全部为阳性。而接种了PRV AH02LA株盲传致弱株F151和F185代的试验猪在攻毒后体温全部正常,没有超过40.0 ℃,同时饮食和精神状况没有出现异常,也未出现任何猪伪狂犬病症状,并且没有发现排毒现象;在攻毒前PRV gB的ELISA抗体均为阳性,而PRV gE的ELISA抗体均为阴性;在攻毒后14 d,PRV gB和gE的ELISA抗体均为阳性。BarthaK61免疫对照组的试验猪均出现发病,并且体温高至40.5 ℃以上,且在攻毒后2~5 d均可检测到排毒,排毒可持续3~5 d(表4)。
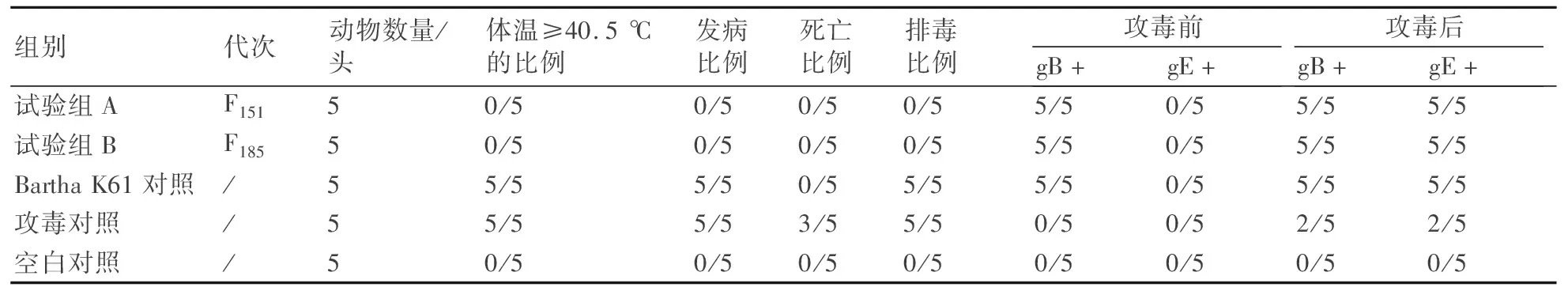
表4 PRV AH02LA 株盲传致弱株免疫后的攻毒保护作用
2.3 伪狂犬病病毒PRV LA2017株的PCR鉴定与序列测定
以PRV LA2017株的DNA为模板,以gC F/R这1对引物扩增获得了3700~4000 bp的特异性片段,测序结果表明其gC基因序列与AH02LA株完全一致。以gD F/R这1对引物扩增获得了1300~1600 bp的特异性片段,测序结果表明其gD基因序列与AH02LA株完全一致。以US6-US2 F/R这1对引物扩增获得了2000~2300 bp的特异性片段(图1),测序结果表明该毒株缺失了从gI基因第118位核苷酸至28K基因第251位核苷酸的共3686 bp碱基,包括gI部分基因、gE全部基因、11K全部基因和28K部分基因(图2)。

M: DNA分子质量标准(DL15000)。

图2 PRV LA2017株基因缺失片段结构示意图
2.4 伪狂犬病病毒PRV LA2017株的稳定性检测
测序结果显示: F18和F35代病毒的gC和gD基因与LA2017株F1代完全一致;US6-US2片段基因缺失的位点也与LA2017株F1代完全一致(图3),表明该毒株传代35代以内稳定。
M: DNA分子质量标准(DL15000)。
2.5 PRV LA2017株的生长特性鉴定
从病毒的体外生长曲线可以看出,PRV LA2017株在CEF细胞(图4)或ST上(图5)F1、F18和F35代具有相似的生长动力学特征,在接种后24~48 h都达到峰值,在CEF上滴度达到108.0TCID50/mL以上,在ST细胞上滴度最高可达到109.5TCID50/mL以上,均能满足活疫苗生产的要求。

图5 PRV LA2017株在ST细胞上的生长曲线
3 讨论
PRV进行感染后只能在猪上存活,因此PR主要在猪群中发生。从2011年以来,中国猪群中PRV变异株大规模流行,其致病力增强,抗原性也发生了改变。目前疫苗免疫仍是防控猪伪狂犬病,净化以及控制野毒感染的有效方法。目前市场上应用的主要是Bartha K61等传统疫苗,但这些疫苗均不能在PRV的流行变异株感染的情况下提供完全保护。
本实验室将自行分离鉴定的伪狂犬病病毒变异株AH02LA株在CEF上进行盲传致弱,获得了PRV LA2017株(保藏号:CGMCC No.18170)。与PRV AH02LA株相比,两者gC和gD基因的序列完全一致,PRV LA2017株的缺失片段共有3686 bp碱基,从gI基因的第118位核苷酸开始,至28K基因第251位核苷酸,包括gI部分基因、gE全部基因、11K全部基因和28K部分基因。gC和gD作为PRV重要的保护性抗原基因,在盲传过程中序列未发生改变,说明PRV LA2017的免疫原性基本上未受到盲传的影响。高俊锋等[20]分离到了猪伪狂犬病毒C株,经6代盲传后,提取病毒DNA并扩增gE基因,测序结果显示, PRV C株在第989~4468位基因缺失,此缺失片段大小为3570 bp,包含全部的gE基因。武吉强等[21]将1株伪狂犬病病毒变异毒株(JS-2012株)连续传代致弱,将所得毒株命名为JS-2012-F120株,两者相比,JS-2012-F120在gE、gI基因区域有2307个碱基缺失,说明gE基因所在位点可能存在某些特殊结构,导致其容易发生缺失。本试验只检测了F151代(PRV LA2017)的gE基因,因此这种缺失是逐步发生的还是一次性发生的?有待于进一步研究。
我们在以前的研究中用BarthaK61弱毒苗经肌肉注射接种后1周攻毒,发现在攻毒后的14 d内,经BarthaK61弱毒苗接种的免疫猪没有出现猪伪狂犬病临床症状;从攻毒后2~3 d开始,通过检测鼻拭子均能发现排毒情况,并持续3 d左右,最长可持续4 d[22]。而试验猪在接种BarthaK61后21 d用强毒攻毒的结果显示并未受到有效保护,说明BarthaK61株的活疫苗并不能阻止变异株的排毒,只可以提供短时间的保护,但是不能长期维持。在本试验中,用PRV LA2017接种28~35日龄健康断奶仔猪,21 d后应用PRV AH02LA株进行攻毒,结果显示:免疫猪在攻毒前、后的体温均未超过40.0 ℃,饮食和精神均正常,未出现任何猪伪狂犬病症状;攻毒前PRV gB的ELISA抗体均为阳性,而PRV gE的ELISA抗体均为阴性;攻毒后14 d,PRV gB和gE的ELISA抗体均为阳性。说明PRV LA2017具有较高的安全性,并且可以对免疫猪起到完全的保护作用,而且能阻止排毒,非常有利于我国伪狂犬病毒变异株的净化。PRV LA2017株在传至35代后,gC、gD基因以及基因缺失位点序列与LA2017株F1代完全一致,体现出其良好的稳定性。
细胞悬浮培养技术指的是细胞在生物反应器中自由悬浮于培养液内生长增殖的一种培养方法,可以在很大程度上减少人力物力的投入,有可控性强、规模大、单产效能高、细胞质量好、病毒效价高、批间差异小等优势,同时可以监控并且查找其生产的过程[23],因此可以作为PRV LA2017疫苗制备方法的研究方向。鸡胚成纤维细胞具有制备方法简单、细胞增殖能力强,适应性、耐受性及稳定性高、不易被猪外源病毒污染等特点,已被广泛应用于传统PRV疫苗生产[24]。ST细胞为猪睾丸细胞传代细胞系,具有可悬浮培养、可增殖的病毒种类多、不致瘤、具有较高的安全性、较好的遗传稳定性等特点,其在最近一段时间以来在猪瘟疫苗的生产中有很多应用。有多种细胞可适应PRV的增殖并能产生明显的细胞病变,研究表明,CEF与ST细胞相比较,PRV在ST细胞上产生病变更快,并且在CEF细胞上的增殖效率明显低于在ST细胞上的[25-27]。在本试验中,PRV LA2017株在CEF上的滴度达到了108.0TCID50/mL以上,在ST细胞上的滴度最高可达到109.5TCID50/mL以上,这与相关文献报道的结果基本一致,均能满足活疫苗生产的要求。本试验表明所获得的PRV LA2017株可以作为预防和控制我国PRV新疫情的DIVA疫苗候选株。

