乳腺癌保乳术后大分割放疗的进展*
祁月潇,罗宏涛,魏世鸿
730010 兰州,甘肃省肿瘤医院 放疗科
保乳手术具有创伤小、乳房美容效果好等优势,已被越来越多地应用于临床。早期乳腺癌临床试验协作组的Meta分析[1]显示,乳腺癌保乳术联合术后辅助放疗可显著降低局部复发风险、提高患者的远期生存率,达到与改良根治术相似的局部控制率和远期生存率。传统观点认为乳腺癌术后标准治疗模式是单次剂量1.8~2.0 Gy, 总共照射25~30 F,瘤床区域局部补量或不补,这是因为早期发表的乳腺癌放疗的相关研究提示全乳腺照射剂量50Gy/25F是有效的[2]。
近年来,越来越多的大规模前瞻性随机对照研究表明,对于早期浸润性乳腺癌[3-4],采用短程大分割放疗与50Gy/25F的传统分割方式相比,具有相同的疗效且不增加副反应。短程大分割放疗还具有疗程短、费用低等优势,更易被患者接受,也可节省医疗资源,降低医疗成本。所以,短程大分割放疗被越来越多的学者推荐作为早期乳腺癌保乳术后的标准治疗模式。本文将对近年来国内外相关研究进展作简要综述,探讨早期乳腺癌保乳术后短程大分割辅助放疗的有效性和安全性。
1 乳腺癌大分割放疗的放射生物学基础
一般认为肿瘤组织的α/β值是8~10Gy[5-6]。但是,Yarnold等[5]通过不同放疗分割方案辅助治疗了乳腺癌保乳手术后患者1 410例, 依据放疗后各组乳腺癌组织和正常乳腺组织的变化,推算出乳腺癌对单次剂量敏感性的α/β值约为3.6 Gy, 而正常乳腺组织的α/β值约为3.1 Gy。从放射生物学角度分析, 依据放射生物模型线性二次公式,大分割放疗对较低α/β值的肿瘤相对生物剂量提高快, 杀伤力更强,故大分割放疗对乳腺癌更有利。但是,单次分割剂量越大,正常组织的放射性损伤也越高。国内开展的多项研究表明乳腺癌保乳术后大分割放疗与传统放疗效果相同,且不明显增加不良反应[7-14],支持将大分割放疗作为乳腺癌保乳术后的标准放疗模式。
2 乳腺癌保乳术后大分割放疗的有效性和安全性
鉴于乳腺癌的α/β值较低,国内外开展了多项乳腺癌保乳术后大分割放射治疗的研究。表1列出了英国和加拿大相继开展的4项大型随机对照研究,总共纳入的人数为7 095人,随访时间超过10年。英国的START(Standardization of Breast Radiotherapy)研究组开展了两项III期临床研究,即START A研究和START B研究。START A研究[7]纳入了2 236例早期乳腺癌保乳术后患者,随机分为3组,分别为50.0Gy/25F、41.6Gy/13F、39Gy/13F。研究发现,三组患者的5年局部区域复发率分别是3.6%、3.5%、5.2%,10年局部区域复发率分别是7.4%、6.3%、8.8%,并且在局部控制率、远期生存、美容效果及副反应方面均没有明显差异。START B研究[8]入组2 215例早期乳腺癌患者,随机分为大分割组(40Gy/15F)和常规分割组(50Gy/25F)。 随访10年后,95人出现局部复发,两组的复发率分别是4.3%和5.5%,差异无统计学意义(HR0.77, 95%CI0.51~1.16;P=0.21), 同时大分割组的副反应明显少于常规分割组[7-9]。另一项英国的研究[3]将1 410例早期浸润性乳腺癌随机分为三组,50.0Gy/25F组(470人)、39Gy/13F组(474人)及42.9Gy/13F组(466人),其10年局部复发率分别是12.1%、14.8%、9.6%,其中,39Gy和42.9Gy分别对比50Gy组在统计学上无明显差异(HR 0.86, 95%CI0.57~1.30; HR 1.33, 95%CI0.92~1.92), 然而42.9Gy组的局部控制率明显优于39Gy组(P=0.027)。加拿大的研究[10]纳入1 234例早期乳腺癌保乳术后切缘阴性且淋巴结阴性的的病例,其中612人接受常规分割治疗(50Gy/25F),622人接受大分割放疗(42.5Gy/16F), 两组方案的10年的局部复发率、总生存率以及美容效果都是相似的。美国的一项回顾性分析[11]纳入了8 228人,发现大分割放疗(>2Gy)对比常规分割,不影响局部控制率、乳房美容效果和远期副反应,并能降低急性毒副反应。
目前国内针对乳腺癌保乳术后大分割放疗开展的研究较少,表2列出国内相关研究。天津医科大学肿瘤中心开展一项前瞻性随机对照研究[12],纳入大分割组(全乳腺 43.2Gy/18F,瘤床同步补量50.4Gy/18F)和对照组(全乳腺 45Gy/25F,瘤床序贯补量14Gy/7F)患者,每组随机入组40人,随访27月后,两组均未出现局部复发或死亡,两组均出现轻度的皮肤毒性反应。中国医学科学院肿瘤医院邓垒等[13]进行了早期乳腺癌保乳术后大分割放疗的II期临床观察,45例乳腺癌患者在保乳术后接受三维适形或简化调强放疗,全乳腺 43.5Gy/15F,瘤床序贯补量8.7Gy/3F,2年的局部区域控制率、总生存率均为100%,两组中均出现2级以内的乳房纤维化、上肢水肿、放射性皮肤炎等副反应。陕西省人民医院[14]将107例保乳术后的早期乳腺癌患者随机分为大分割组(42.56Gy/16F,瘤床序贯补量7.98Gy/3F)和常规分割组(50Gy/25F,瘤床序贯补量10Gy/5F),随访10年,发现两组的局部控制(9.6%vs7.9%,P=0.712)和远期生存(86.5%vs88.5%,P=0.748) 没有差异。以上国内外研究均证明乳腺癌保乳术后大分割放疗可以达到与常规分割放疗相似的效果。
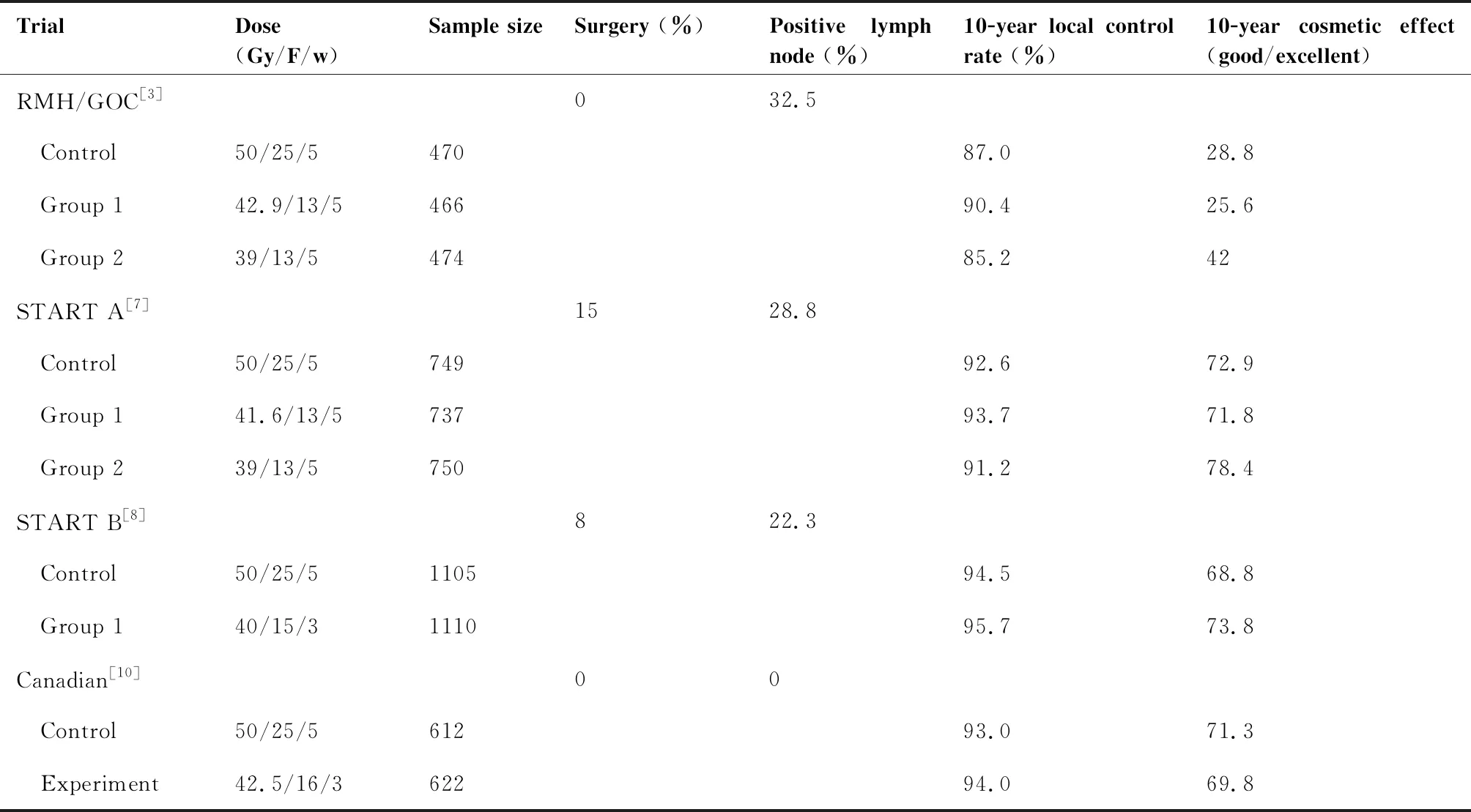
表1 国外乳腺癌术后大分割放疗研究的特征和结果
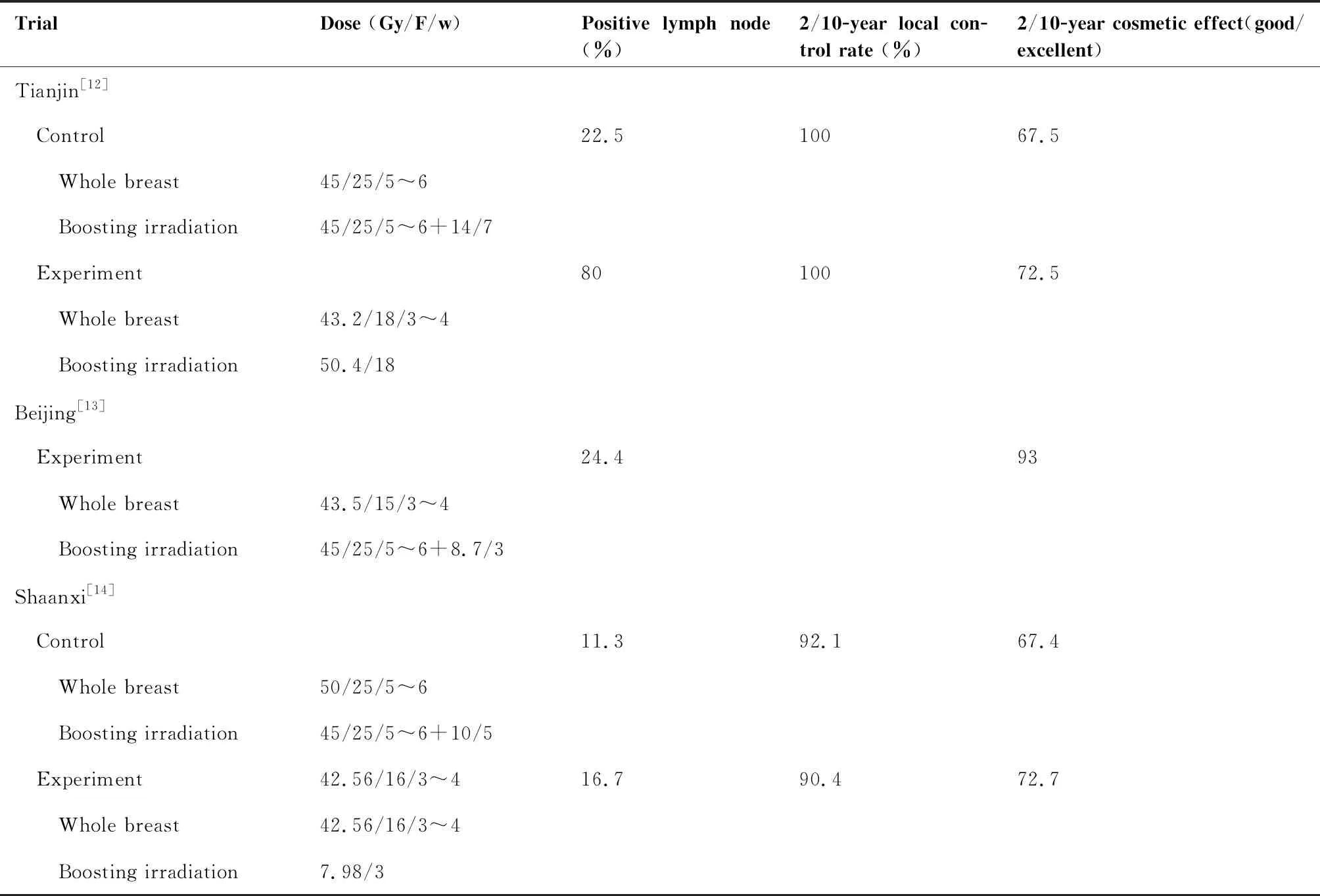
表2 我国乳腺癌保乳术后大分割放疗研究的特征和结果
保乳术后放疗的不良副反应主要是急慢性的皮肤反应,包括皮肤毛细血管扩张、乳房水肿、色素沉着、以及纤维化,影响乳房美容效果。大分割放疗对比常规放疗是否会增加这些皮肤副反应是一个重要的问题。英国的START试验[7-9]和加拿大[10]的试验结果,均表明大分割放疗对比50Gy/25F的常规放疗不会增加皮肤副反应。START A研究中[7,9],中等程度乳房硬化、毛细血管扩张、乳房水肿等副反应在39Gy组中的发生率显著低于常规50Gy组。START B研究中,乳房萎缩、脉细血管扩张、乳房水肿在大分割组中的发生率明显低于常规分割组[8-9]。加拿大的研究中[10],常规分割组(71.3%)和大分割组(69.8%)中的大部分患者可以在10年内保持良好的乳房美容效果,两组之间差别很小。一项意大利的研究[15]将155例早期乳腺癌保乳术后的患者分为大分割组(45Gy/20F)和常规分割组,两组都进行瘤床序贯补量,大分割组早反应发生率是85%,晚反应发生率是10%;常规放疗组分别是96%和15%。研究表明大分割放疗缩短疗程,减少急性皮肤反应,且不增加晚期皮肤反应。近期的一些研究[16-18]进一步证实,乳腺癌保乳术后大分割放疗具有良好的美容效果和较低的不良反应发生率。
心脏损伤是乳腺癌放疗的另一个主要不良反应,影响患者长期生活质量。Chan等[19]研究随访15年,结果显示左侧早期乳腺癌大分割组与常规分割组在心脏致死率上没有明显统计学差异(21%vs21%,P=0.93)。 Tjessem等[20]人发现大分割放疗(>2Gy)不会增加心血管疾病发病风险及心脏相关的死亡风险, 但是超大分割放疗(>4Gy)会显著增加心脏相关死亡风险。证明大分割的程度与心脏相关死亡率存在相关性。不过,具有更大样本量的START A/B研究亚组分析发现左侧乳腺癌在大分割组和常规分割组中心脏损伤没有明显差异。要避免放射性心肌损伤,主要是要将心脏避开照射野,而非采用哪种分割方式[7-9]。
综上所述,大分割放疗是一种安全、有效且方便的乳腺癌保乳术后辅助放疗方式,它的优势在于缩短疗程、减少住院天数,方便患者治疗且节约医疗资源。有望作为一种乳腺癌术后辅助放疗优先推荐的新标准方式。
3 导管原位癌是否可行大分割放疗?
导管原位癌保乳术后也需要接受放射治疗增加局部控制率。一系列研究[21-25]证实乳腺导管原位癌保乳术后放疗中,大分割放疗(42.5Gy/16F)可以达到与常规分割相同的局部控制率。加拿大的一项研究[22]分析了1994年至2003年间的1 609位乳腺导管原位癌患者,其中638人接受大分割放疗,971人接受常规分割放疗,中位随访时间9.2年,局部控制率分别是86%和89%。一项meta分析[23]纳入了13项研究,发现乳腺原位癌保乳术后接受大分割放疗和接受常规分割放疗具有相同的局部控制率(OR0.78, 95%CI0.58~1.03)。因此,大分割放疗可以作为乳腺导管原位癌保乳术后辅助放疗的可选方式,推荐剂量和分割方式是42.5Gy/16F或40Gy/15F。
4 高风险人群是否可行大分割放疗?
加拿大大分割试验[10]的亚组分析发现,对于病理级别为III级的患者,大分割组局部复发风险高于常规分割组,而认为高级别乳腺癌对于大分割放疗不如低级别肿瘤敏感。但是样本量更大的START研究并未发现大分割放疗在高级别乳腺癌人群中表现出增加的局部复发风险。并且,加拿大的一项研究[26]对比了从1990年到2000年间的1 335位III级早期乳腺癌患者,保乳术后接受全乳腺大分割放疗或者常规放疗,随访10年后,发现大分割组和常规组具有相同的局部控制率(6.9%vs6.2%,P=0.99)。因此,大分割放疗不应该仅仅局限在低病理级别的乳腺癌低风险人群,不应该保守的认为大分割会增加局部或远处的复发风险。
5 全乳腺大分割放疗如何进行瘤床补量?
欧洲癌症研究与治疗组织(European Organization for Research and Treatment of Cancer,EORTC)组织的研究[27-28]随访20年,发现全乳腺放疗后瘤床区域补量虽然不能改善总生存(99%CI0.92~1.19,P=0.323),但是可以显著降低局部复发率(99%CI0.52~0.81,P<0.0001)。法国里昂的研究[29]也表明,瘤床补量能显著提高局部控制率(P=0 .044)。EORTC研究补量的方式是16Gy/8F, 法国研究的是10Gy/5F。虽然补量的方式不同,局部复发风险降低的程度也不同,但是都证明瘤床补量能提高局部控制率。一般认为局部补量的指征是切缘阳性、年龄<50岁、高级别病变等[29]。局部补量的推荐剂量是10~16Gy/4~8F。大分割放疗后瘤床区域大分割补量的方式目前没有统一标准。有研究[30]表明10Gy/4F的补量方式具有良好的耐受性,乳房纤维化、疼痛、毛细血管扩张等副反应可以被接受,美容效果良好。邓垒等的研究采取的方式是8.7Gy/3F,结果提示其不良反应可以被接受[13]。
6 哪些人群不适合大分割放疗?
全乳腺大分割放疗应该广泛的推广到临床实践,但不是所有的患者都适用。大分割放疗最大的风险是增大的单次剂量会加剧皮肤纤维化和晚期副反应。研究发现,剂量不均匀[31-32]、术后感染[32]、吸烟[33]、乳房重建[34]等是常规分割放疗后纤维化发生的高风险因素。在大分割放疗中,剂量不均匀(剂量>107%的区域)的潜在影响可能更加严重[31,34]。另外,术后乳房明显水肿的患者不推荐大分割放疗,因为水肿的乳房内含有大量富含蛋白的组织间液,当组织间液吸收后,沉积的胶原蛋白将会逐渐转变成纤维组织。所以存在以上或者其他纤维化高风险因素的人群推荐常规分割放疗,或者强度更低的方式45Gy/25F, 单次剂量1.8Gy,当然这个剂量还达不到最佳的局部控制率,所以还要进行瘤床区域的局部补量。
7 总 结
近二十年来,一些大的随机试验和研究机构连续观察得到的数据表明早期乳腺癌保乳术后,全乳腺进行40Gy/15F或42.5Gy/16F的大分割放疗,可以达到与常规分割放疗相似的效果,且治疗相关副反应无明显增加。短程大分割放疗具有缩短疗程、降低费用、节约医疗资源等优势,建议优先选用。但大分割放疗并不适用所有患者,对于一些合并术后并发症、乳房重建、大乳房等人群,大分割放疗可能增加纤维化风险、降低乳房美容效果,故推荐进行常规分割放疗。综上所述,大分割放疗安全有效,具有多项优势,有望更广泛地推广应用于临床实践中。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

