肝性脑病患者大脑静息态低频振荡幅度及脑代谢情况
孟静,李洪强,姚艳,余州,张润秋,雷宇,张雪松,游玉峰
肝性脑病(hepatic encephalopathy,HE)是由肝脏代谢紊乱导致的脑病。研究发现,病情严重程度不同的HE患者大脑功能和脑代谢活动存在一定差异,这有助于疾病的诊断和治疗[1]。静息态血氧水平依赖功能磁共振(blood oxygenation level dependentfunctional magnetic resonance imaging,BOLD-fMRI)是一种安全无创的检查方式,其低频振幅强度(amplitude of low frequency fluctuation,ALFF)可直接反映人脑中自发神经活动的强弱,准确评价脑功能改变[2]。本研究利用BOLD-fMRI及ALFF观察不同严重程度的HE患者大脑活动的改变,为磁共振成像(magnetic resonance imaging,MRI)诊断HE的严重程度提供理论依据,报道如下。
1 资料与方法
1.1 一般资料
选择2016年1月至2018年7月我院收治的确诊为HE的患者48例,其中男36例,女12例;年龄25~72岁,平均(41.35±11.56)岁。根据胃肠病学会实践标准委员会发布的West-Haven标准[3]和HE心理学评 分(psychometric hepatic encephalopathy score,PHES)中数字连接试验-A及数字符号试验[4]对患者病情进行评估,符合West-Haven标准2~4级,且具有明显精神异常者,或West-Haven标准1级,且可引出扑翼样震颤者,纳入重症组;符合West-Haven标准0级,且数字连接试验-A及数字符号试验均为阳性者纳入轻微组。本研究据此分组,轻微组28例,男19例,女9例;年龄25~69岁,平均(44.36±10.27)岁;原发病为慢性病毒性肝炎11例、自身免疫性肝炎11例、硬化性胆管炎3例、药物性肝病2例、酒精性肝病1例。重症组20例,男17例,女3例;年龄28~72岁,平均(40.15±12.53)岁;原发病为慢性病毒性肝炎7例、自身免疫性肝炎9例、硬化性胆管炎2例、药物性肝病1例、酒精性肝病1例。另选取同期我院健康体检并自愿参加研究的志愿者20例为对照组,其中男11例,女9例;年龄22~78岁,平均(40.12±10.34)岁。各组受试者的一般资料差异无统计学意义(P>0.05),具有可比性。
本研究纳入标准:经肝功能检查、超声、影像学检查及或肝脏穿刺活检确诊为HE[3];入院后还未接受治疗;所有患者和健康受试者均自愿加入本次实验,且本研究通过医院伦理委员会同意。排除标准:存在精神障碍性疾病;并存严重心、肺、脑、肾疾病;文盲和不能配合相关检查。
1.2 方法
采用GE1.5 T光纤磁共振,16通道线圈,采集MRI数据。使用梯度回波-回波平面成像脉冲序列(GRE-EPI),主要参数:翻转角90°,回波时间30 ms,重复时间2 000 ms;矩阵64×64;FOV 240 mm×240 mm;层厚4 mm;层数34层。整个序列总共有180个时间点,总共6 min 6 sec。手工整理所有采集的功能数据录入静息态功能磁共振数据(data processing assistant for resting state fMRI,DPARSF)进行处理。将获得的序列转换为频谱,并对频谱进行平方并求平均以获得ALFF图。最后,将ALFF值除以全脑平均值,并获得标准化的ALFF图。与0~0.25 Hz的全频段振幅总和值相除,即得到分数化低频振荡幅度(fractional amplitude of low frequency fluctuation,fALFF)值。计算N-乙酰天门冬氨酸(N-acetyl aspartate,NAA)、胆碱(choline compounds,Cho)、肌醇(myo-Inositol,mI)各峰下面积与参照指标肌酸(creatine,Cr)的比值。静息态fMRI数据采用REST软件进行处理。脑功能数据处理包括以下步骤[5]:时间层校正,空间归一化,高斯平滑,离线漂移。数据处理后经带通滤波,并与T1WI图像进行融合,产生激活图。
采用格拉斯哥昏迷量表(Glasgow coma scale,GCS)评价意识情况,15分为意识清醒;13~14分为轻度意识障碍;9~12分为中度意识障碍;<9分为昏迷。
1.3 统计学处理
2 结果
2.1 各组间不同脑区的ALFF差异比较
轻微组与对照组、重症组与对照组以及轻微组与重症组对比,在额叶、顶叶、颞叶等脑区ALFF差异有统计学意义(均P<0.05),见表1。
2.2 各组脑代谢物峰值下面积比值差异比较
轻微组与重症组脑代谢物峰值下面积比值均明显低于对照组,差异有统计学意义(均P<0.05);轻微组Cho/Cr和mI/Cr高于重症组,差异有统计学意义(均P<0.05);轻微组和重症组NAA/Cr差异无计学意义(P>0.05),见表2。
2.3 2组患者GCS评分比较
轻微组GCS评分为(12.64±1.58)分,高于重症组的(10.82±1.36)分,差异有统计学意义(P<0.05)。
2.4 HE患者GCS评分与脑代谢的关系
HE患者NAA/Cr与GCS评分无关(P>0.05);Cho/Cr、mI/Cr与GCS水平呈正相关(P<0.05),见表3。
3 讨论
HE又被称为肝昏迷、门静脉脑病等,分为2个阶段:临床症状严重和临床症状轻微。HE的不同阶段在脑功能和脑代谢活动方面存在差异,早期轻微阶段未出现明显的临床症状,容易漏诊、误诊。准确了解各阶段患者的状况能够为治疗方案的制定提供帮助。
静息状态BOLD-fMRI安全,无创,无辐射,逐渐被应用于阿尔茨海默病、精神分裂症等多种精神相关的疾病中。本研究应用静息态BOLD-fMRI低频振幅分析法观察不同进展阶段HE患者大脑活动与脑代谢情况,结果显示:3组在额叶、顶叶、颞叶等脑区ALFF差异有统计学意义(均P<0.05)。同时,与对照组相比,HE组多个脑区的ALFF值降低,主要包括双侧内侧前额叶皮质,双侧后扣带回/左侧楔叶,右中央后/中央前,左中央侧小叶和左辅助运动区;与重症组相比,轻微组的左前扣带回,双侧内侧前额叶皮质,背扣的两侧带回,右后角/枕背和右前背ALFF减少。

表1各组间ALFF差异有统计学意义的脑区
表2各组脑代谢物峰值下面积比值差异对比(±s)
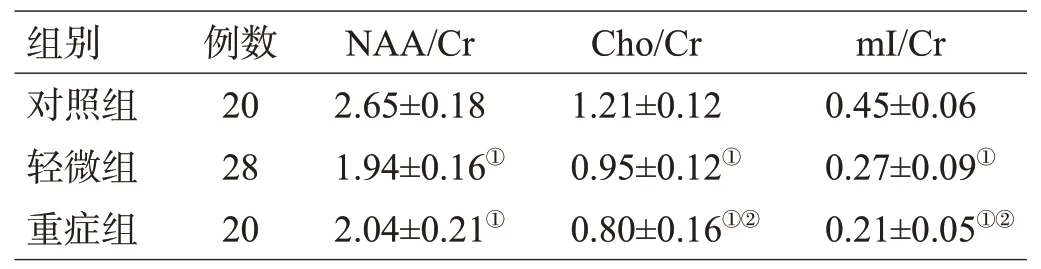
表2各组脑代谢物峰值下面积比值差异对比(±s)
注:与对照组比较,①P<0.05;与轻微组比较,②P<0.05
?

表3 HE患者GCS评分与脑代谢的关系
通常HE患者的代谢产物包括Cho、mI、Cr、NAA等。血氨升高是HE的机理之一,血氨升高与谷氨酸结合形成谷氨酰胺的过程中,机体内大量ATP和辅酶被消耗,而Cr能够有效缓冲这一过程,并且能够储备大量高能磷酸以维持细胞能量供应;Cho和mI的作用在于调节星形胶质细胞的有机渗透压,当这2者的含量出现变化时表示脑内渗透压改变[6];NAA存在于神经元及轴索,为神经元标志物,其升高与降低分别代表着分解代谢障碍与神经元的损失或能量障碍。研究发现HE患者的NAA/Cr值会出现下降[7],与本研究结果不符,其原因可能由于本研究纳入的样本量较少有关。另外,本研究还发现,Cho/Cr和mI/Cr值随着患者病情的恶化进展下降,且GCS评分与Cho/Cr、mI/Cr水平呈正相关。即随着病情恶化的进展,GCS评分也呈明显下降趋势,与Cho/Cr、mI/Cr水平呈正相关。
综上所述,通过大脑静息态功能评价患者部分脑区的fALLF可以作为HE病程进展监测的有效手段,同时通过磁共振波谱成像所得到的脑代谢物Cr、NAA、Cho、mI等峰值下面积的比值有助于进一步判断疾病病程。

