重症肌无力合并肺结节手术治疗3例
尹东涛,周 雯,褚 剑,黄 玲,王 美,韩 冰
重症肌无力(myasthenia gravis, MG)是一种少见的、自身抗体介导的、主要累及神经肌肉接头的自身免疫性疾病[1]。胸腺切除术已广泛应用于MG的治疗[2]。随着胸部CT检查的普及,单纯肺结节的检出率明显提高。而MG合并肺结节的患者临床少见,且易引发肌无力危象(myasthenia gravis crisis,MC)这一严重并发症,所以目前对该病的手术治疗、围术期处理及预后转归经验均较少。国内外研究也仅为个案报道,笔者通过对我院收治的3例手术治疗的MG合并肺结节病例进行分析,旨在为临床治疗提供借鉴。
1 临床资料
病例1 男,63岁,主因“复视、上睑下垂及全身乏力1个月”于2012-05-09入院,神经电生理检查及新斯的明试验阳性。胸部CT示:前纵隔近右心房处及左肺上叶各有一个实性结节(图1A、B)。诊断:(1)MG(ⅡB型);(2)胸腺瘤,左上肺结节。定量重症肌无力评分(quantitive myasthenia gravis score, QMG)13分。先行CT引导下左上肺肿物穿刺活检术,病理示:低分化腺癌。由于症状较重,经右胸行胸腔镜辅助下胸腺瘤扩大切除术,术中完整切除肿瘤及部分受累心包及纵隔胸膜。术后第2天发生MC,行气管插管呼吸机辅助通气,经3次血浆置换等治疗,第7天病情稳定。病理示:侵袭性胸腺瘤,WHO B3型,Masaoka分期Ⅲ期。1个月后患者一般情况良好,行左肺上叶切除联合纵隔淋巴结清扫术,术后恢复顺利,病理示:中分化腺癌(T2N0M0,Ⅰb)。3个月后发现右前臂软组织肿物,穿刺病理提示为“转移性腺癌”,行伽马刀局部治疗并缓解疼痛。术后1年,因全身多处转移死亡。
病例2 男,22岁,主因“反复眼睑下垂、复视8年”于2019-07-09入院。新斯的明试验及肌电图检查均阳性,乙酰胆碱受体抗体(+),嗅比斯的明治疗有效,免疫抑制药他克莫司治疗后仍有反复。胸部CT:前纵隔异常密度影考虑胸腺增生、右下肺小结节(图1 C,D)。诊断:MG(IIA型);右下肺结节”,QMG为3分。术前1天停用他克莫司,术日先行CT引导下弹簧圈定位肺小结节,术中取左侧卧位,术者站于患者腹侧,常规行单操作孔右肺下叶楔形切除术。患者体位向背侧旋转 45°,术者至患者背侧,继续行腔镜下胸腺扩大切除术。手术顺利,冰冻结果为不典型增生。术后患者恢复顺利,病理示:(胸腺)单纯性增生;(右下肺)不典型增生。术后停止他克莫司治疗,随访6个月,患者一般情况好。
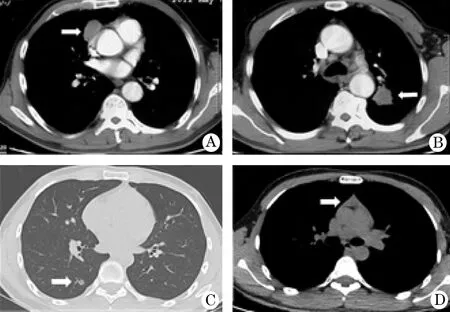
图1 重症肌无力合并肺结节胸部CT
病例3 男,64岁,主因“右眼睑下垂5年,咀嚼、吞咽困难、呼吸费力伴四肢无力10 d,左眼睑下垂5 d”于2014-11-21入院,神经电生理检查及新斯的明试验阳性。既往高血压病史8年,血小板减少性紫癜病史3年。胸部CT示:左前上纵膈不均质软组织影,右下肺结节。入院诊断:(1)MG(ⅡB型);(2)右下肺结节。QMG 为14分。先行CT引导下右肺穿刺活检,病理:中分化腺癌。胸腔镜辅助下右肺下叶楔形切除术联合纵隔肿物扩大切除术,先取左侧卧位,探查见病变位于右肺下叶后基底段,直径 1.5 cm,近椭圆形,边界尚清,表面胸膜无明显皱缩,遂行右肺下叶楔形切除术。体位变为仰卧位,左侧肩部垫高 30°,左侧第4肋间小切口探查,肿物 6.0 cm×5.0 cm×4.0 cm,近椭圆形,膨胀性生长,表面包膜尚完整,滋养血管较丰富,与肺门、膈神经、主动脉弓粘连紧密。采用超声刀自肿瘤下极开始锐性加钝性仔细分离,至完整切除肿瘤。术后8 h,发生MC,Ⅱ型呼吸衰竭,予以呼吸机辅助呼吸及抗感染支持治疗,术后第4天病情稳定,予以拔除气管插管。术后病理:(右肺下叶)中分化腺癌,(前上纵隔)B1型胸腺瘤,局部侵犯周围脂肪组织(图2)。术后经多学科讨论,动态观察肺部情况同时,给予环磷酰胺维持治疗MG。随访至今60个月,一般情况良好,肺癌未见复发,MG完全缓解。
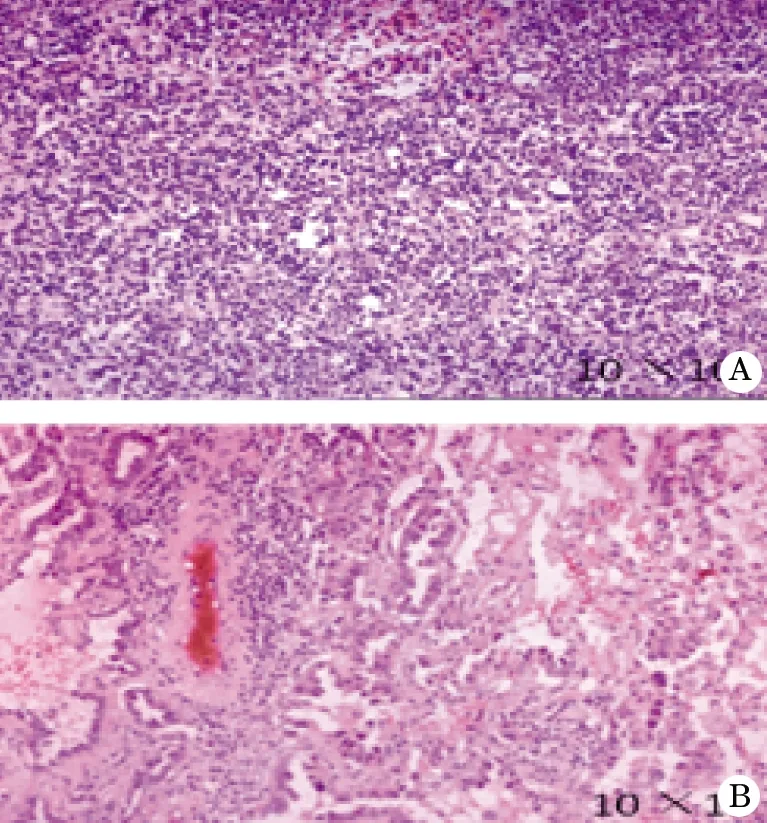
图2 重症肌无力合并肺结节手术病理(HE,×100)
2 讨 论
MG是一种累及神经-肌肉接头的少见的自身免疫性疾病,具有病程长、疗效不确切、病情易反复等特点。MG多合并胸腺瘤、胸腺增生或胸腺囊肿等[3]。肺结节临床常见,分为良性结节和恶性结节(肺癌)。但MG合并肺结节临床少见,国内外仅见个案报道,且均缺少相对完善的诊断、治疗及预后的资料[3-7]。笔者通过分析我院收集的3例MG合并肺结节患者的诊断、外科治疗、围术期处理及预后,旨在为临床诊治提供借鉴。
MG合并肺结节选择合适的手术时机非常重要。MG行胸腺或胸腺瘤扩大切除术,对心肺功能影响较小,如肌无力症状较轻,肺结节和病变能够通过一侧进胸手术切除,应选择同期手术,一次解决两个问题,尽量减少手术创伤。肺结节与胸腺病变位于两侧时,需两侧进胸手术,如术前肌无力症状严重或心肺功能差,应警惕发生MC。MC可由感染、麻醉、手术、应激等多种因素诱发,肺部感染最为常见[8]。而肺手术后,肺部感染是最主要的并发症之一,严重威胁生命。因此,对于术前临床分型ⅡB型、定量MG评分高、溴吡斯的明片和泼尼松用量大及吞咽功能障碍的患者,术前应积极改善肌无力症状,再行手术治疗[9]。笔者的经验是:(1)术前尽量调整溴吡斯的明用量至最小,保持最佳状态;(2)对于临床分型ⅡB型以上者,术前给予丙种球蛋白0.4 g/(kg·d),连续5~7 d,或进行血浆置换改善肌无力症状,再争取进行同期手术。本文中病例1术前QMG评分13分,影像提示侵袭性胸腺瘤,行分期手术,先经右胸行腔镜下胸腺瘤扩大切除,术后仍发生MC,积极治疗好转,4周后,进行了左肺上叶切除联合纵隔淋巴结清扫术,术后恢复顺利,但由于肺癌转移,生存期不到2年。病例3术前QMG评分14分,由于患者及家属强烈要求,行同期手术,术后当天发生MC,经积极治疗后缓解。病例2症状较轻,QMG评分3分,予以同期手术,术后恢复顺利,随访6个月状态良好。
肺癌的标准术式仍为肺叶切除联合纵隔淋巴结清扫术,而对高龄、合并MG临床分期较早的肺癌患者,笔者认为,亚肺叶切除能缩短手术和麻醉时间,保留肺功能,尤其在同期手术的情况下,有助于患者安全渡过围术期,应予以考虑。本文中病例3,虽行肺楔形切除,但随访5年,未见肿瘤复发,长期生存状态良好。针对MG应行胸腺及纵隔脂肪扩大切除术,可改善术后的肌无力症状,减少肌无力反复的机会。术后处理的关键是呼吸道并发症和MC的防治。临床预防感染应合理选择抗生素,对于肺不张的防治,可使用大剂量氨溴索稀释痰液,促进患者排痰[10]。当发生呼吸衰竭时,及时采取经鼻气管插管辅助呼吸,免疫球蛋白或血浆置换,以及短期大剂量激素冲击治疗,同时应警惕支气管胸膜瘘的发生[11]。
总之,MG合并肺结节的诊治,术前应明确病理,如为良性,则治疗思路相对明朗;如为恶性,对一般情况较好的患者应争取行同期手术治疗,围术期加强呼吸道和感染的管理,积极防治MC。

