花生胚小叶再生体系的建立
马倩 马莹莹 高古腔 朱树良 屈成鑫 巩方平 任锐 李忠峰 马兴立 张幸果 殷冬梅





摘要:本研究选用不同花生品种远杂9102、丰花2号和花814的胚小叶为外植体,通过分析不同激素配比、不同基因型诱导不定芽的差异,确定了适宜花生胚小叶不定芽诱导、继代培养的最佳培养基,经伸长和生根培养,最终建立了花生胚小叶的离体再生体系。结果表明,6-BA和NAA组合诱导效果优于TDZ,最佳不定芽诱导培养基为M519+4.5mg/L6-BA+0.2mg/LNAA,丰花2号、远杂9102、花814均有较高的不定芽诱导率;最佳继代培养基为M519+4.0mg/L6-BA,3个基因型品种的芽再生率较高,均超过64%;在1/2MS+0.2mg/LIBA+0.1mg/LNAA的生根培养基中,丰花2号、远杂9102、花814的生根率依次为73.80%、60.32%、50.66%。本研究初步建立了不依赖于基因型的较广适花生胚小叶再生体系。
关键词:花生;胚小叶;不定芽诱导;离体再生体系
中图分类号:S565.201 文献标识号:A 文章编号:1001-4942(2021)12-0017-08
花生(ArachishypogaeaL.)又名落花生,双子叶植物,在世界范围内广泛种植,是重要的油料和经济作物之一,具有适应性广、经济效益高等优点。我国是全球花生贸易四大出口国之一,花生在我国占有极其重要的地位[1]。目前,我国花生种植面积为油料作物的第二位,总产量居首位[2]。花生的产量和品质往往受到多种病虫害的影响,选育抗病虫新品种、改良品质对花生产业发展具有重要意义。近年来分子生物学技术飞速发展,利用该技术改良花生品质、提高抗病虫能力的新型育种方式受到了广大育种工作者的青睐。分子育种技术往往同组织培养和遗传转化过程紧密联系,花生离体再生及遗传转化技术发展相对缓慢,在一定程度上限制了其分子育种技术的发展,建立高效、稳定、广适的再生体系是促进花生分子育种研究的关键。
目前,关于花生组织培养的报道日益增多,其中以花生胚小叶为外植体的再生体系已有较多报道。何晔[3]、尤淑丽[4]等研究了不同花生品种的愈伤组织诱导率和不定芽分化率。张月婷等[5]建立了高效的花生再生体系,认为丰花2号有较强的再生能力。隋炯明等[6]比较了不同基因型的胚小叶不定芽诱导率,认为龙生型>珍珠豆型>多粒型。任艳等[7]比较了不同浓度NAA和TDZ对胚小叶的诱导情况。但仍然存在较多问题,如再生体系重复性差,再生过程基因型依赖性强等。因此,建立一个不依赖基因型的广适性再生体系势在必行。本研究选用不同花生品种的胚小叶为外植体,通过对不同激素配比的筛选试验,确定了适宜花生胚小叶不定芽诱导、伸长和生根的最佳培养基,初步建立了适于不同基因型花生的离体再生体系。
1 材料与方法
1.1 供试材料
试验所用花生品种为远杂9102(珍珠豆型)、花814(普通型)、丰花2号(珍珠豆型),以其自然风干的种子为试材。
1.2 试验方法
1.2.1 基础培养基及培养条件 基础培养基为M519和1/2MS,添加3%蔗糖和0.8%琼脂,用NaOH调pH值至5.7~5.8。所有培养基均在121℃ 下高压蒸汽灭菌15 min。培养条件:26/24℃,16h/8h光/暗循环,60%相对湿度。
1.2.2 种子预培养 分别取丰花2号、远杂9102、花814荚果,去壳后挑选饱满健康的种子进行消毒:将种子放入无菌罐头瓶中,倒入75%乙醇消毒40s,弃乙醇,用无菌水冲洗几次;加入0.1%氯化汞溶液浸泡10min,弃氯化汞溶液,用无菌蒸馏水清洗4~5次,最后加入无菌蒸馏水浸泡过夜。
1.2.3 外植体制备及不定芽诱导 将浸泡好的种子在无菌条件下取出完整胚,并从基部切下胚小叶,将胚小叶在一次性培养皿上用手术刀充分分散成单一胚小叶,使之不粘连,然后接种于含有不同配比6-BA和NAA或不同浓度TDZ的诱导培养基上,于光照培养箱培养40~50d后统计不定芽诱导率。
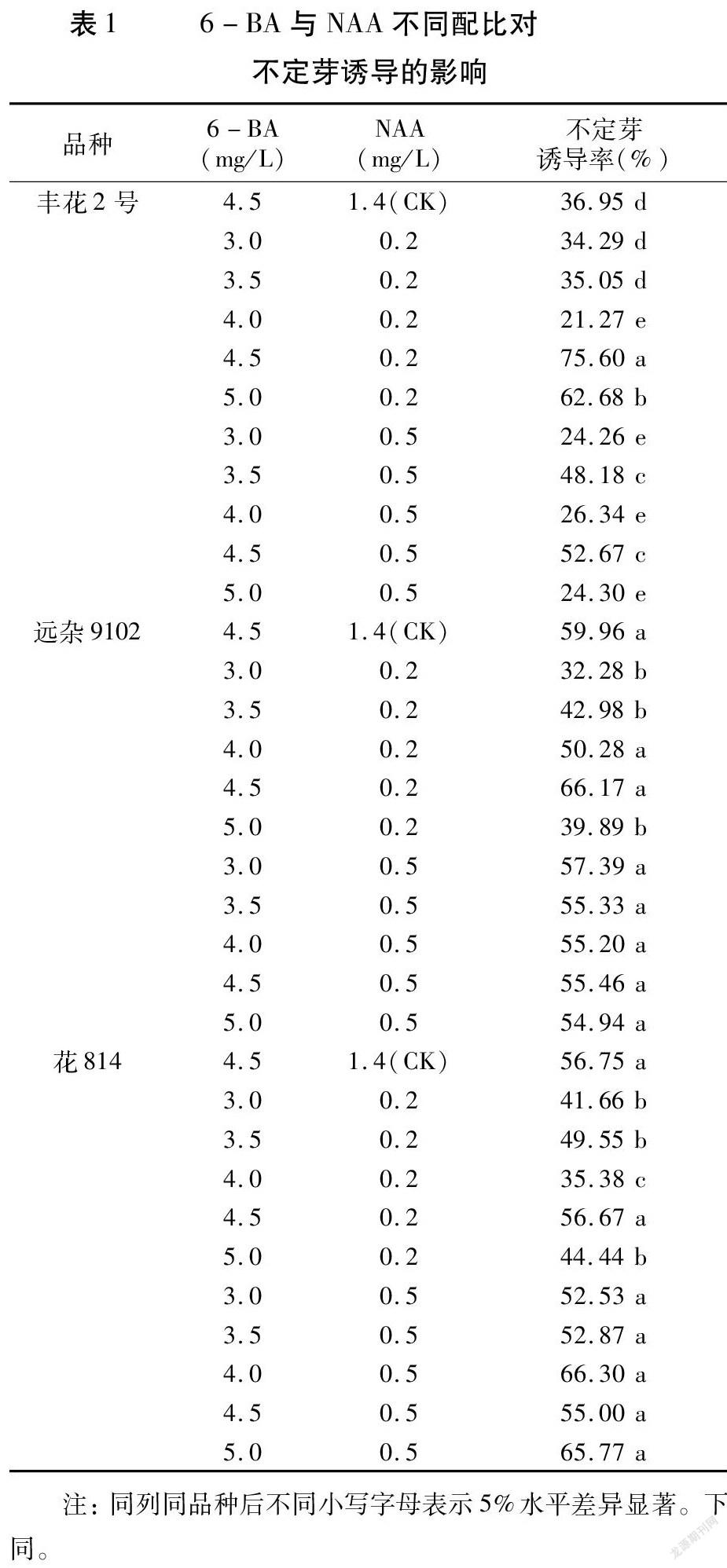
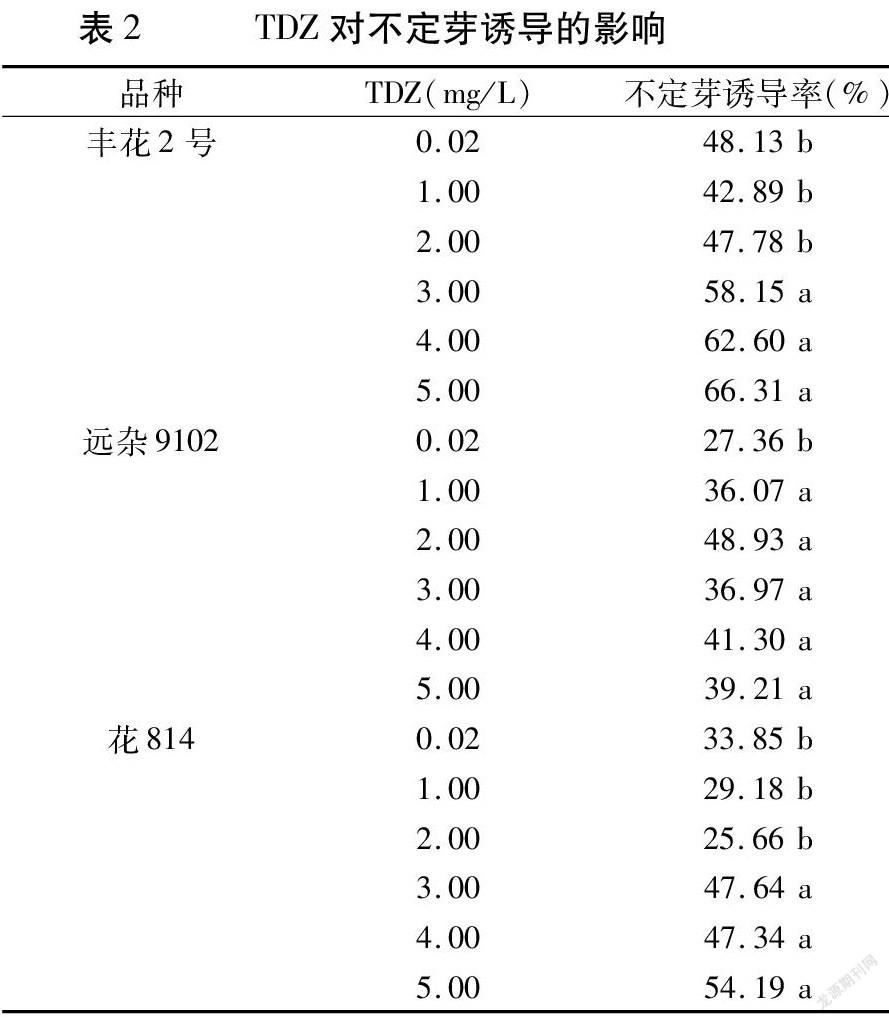
6-BA设置3.0、3.5、4.0、4.5、5.0mg/L的浓度梯度,NAA设置0.2、0.5mg/L的浓度梯度,TDZ设置0.02、1.00、2.00、3.00、4.00、5.00mg/L的浓度梯度;6-BA和NAA配比的筛选以李拴柱[8]的4.5mg/L6-BA+1.4mg/LNAA为对照。每皿接种30个外植体,每种激素处理设置3次重复,每3皿为一个重复。
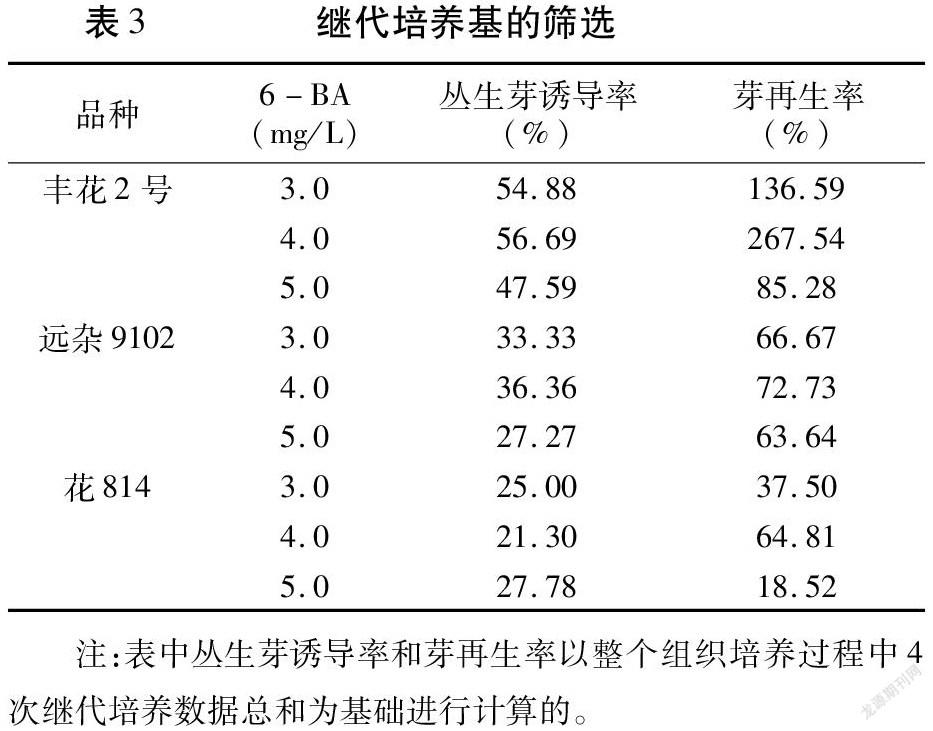
1.2.4 叢生芽诱导及再生成苗 诱导培养60d后,切下诱导出的不定芽,接种至继代培养基诱导丛生芽,之后每30d继代一次。继代培养基设置3.0、4.0、5.0mg/L的6-BA浓度梯度。继代时将仍有芽点的组织接种至相同的继代培养基增殖,而将长度1cm左右的芽移至生根培养基1/2MS+0.2mg/LIBA+0.1mg/LNAA,使之伸长并生根。每处理继代3~4次,每次均记录丛生芽数及芽再生数,并进行生根培养,统计生根率。
1.3 数据统计与分析
采用MicrosoftExcel对数据进行处理与统计分析。根据下列公式计算各指标值。
不定芽诱导率(%)=诱导出不定芽的外植体数/接种外植体数×100 ;
丛生芽诱导率(%)=产生丛生芽的外植体数/接种外植体数×100 ;
芽再生率(%)=丛生芽上长度大于1cm的芽数/外植体数×100 ;
生根率(%)=生根芽数/再生芽数×100 。
2 结果与分析
2.1 不定芽诱导培养基的筛选
2.1.1 不同品种的不定芽诱导差异 将远杂9102、丰花2号、花814的胚小叶置于含有4.5mg/L6-BA+1.4mg/LNAA的诱导培养基上培养,丰花2号培养3周左右分化出嫩绿的具有生命力的不定芽,且产生的不定芽多,培养至30d时产生的水渍状愈伤少,不定芽仍然具有旺盛的生命力;而远杂9102培养20d左右即分化出深绿色不定芽和松软的水渍状愈伤,培养至30d时水渍状愈伤增多且有部分转化成雪花状,已经分化的不定芽也逐步向水渍状愈伤转化;花814培养过程中诱导不定芽的同时往往伴随大量松散的愈伤,影响后期不定芽的伸长(图1)。可见,3个品种胚小叶在相同环境下进行培养,均可诱导出不定芽,但不定芽形态存在差异,推测形态差异可能与内源激素含量不同有关。
2.1.2 6-BA与NAA不同配比对不定芽诱导的影响 由表1可见,丰花2号和远杂9102的最适激素配比均为4.5mg/L6-BA+0.2mg/LNAA,诱导率分别为75.60%和66.17%,其中,丰花2号显著高于对照,而远杂9102与对照无显著差异。NAA浓度为0.5mg/L时,无论6-BA浓度多少,远杂9102各组诱导率均与对照无显著差异。花814的最适激素配比为4.0mg/L6-BA+0.5mg/LNAA,诱导率为66.30%,4.5mg/L6-BA+0.2mg/LNAA的诱导率略低,但两者间差异不显著,均与对照组无显著差异;NAA浓度为0.5mg/L时,各种配比的不定芽诱导率也均与对照差异不显著。3个品种间比较,在最适6-BA和NAA配比下,丰花2号的不定芽诱导率明显高于远杂9102和花814;而在对照组6-BA和NAA配比下,远杂9102和花814的不定芽诱导率要高于丰花2号。
以丰花2号为例,将其胚小叶接种至6-BA和NAA不同浓度配比的培养基上,一周后胚小叶逐步变绿,3周后叶柄基部或伤口处开始膨大并出现绿色芽点。随着培养时间的延长,芽点逐步发育成不定芽,30d时不定芽清晰可见(图2A);但继续培养,会出现水渍状和白色蓬松状愈伤,不定芽诱导率逐步降低,因此选择每30d继代一次。
2.1.3 不同浓度TDZ对不定芽诱导的影响 由表2可见,丰花2号在5.00mg/LTDZ处理时有最高不定芽诱导率,但与3.00、4.00mg/LTDZ处理差异不显著。远杂9102在1.00mg/LTDZ处理时不定芽诱导率显著高于0.02mg/LTDZ处理,继续提高TDZ浓度可提高不定芽诱导率,但未达显著水平。花814在3.00mg/LTDZ处理时不定芽诱导率显著高于CK,继续提高TDZ浓度可提高不定芽诱导率,但差异不显著。
以丰花2号为例,将其胚小叶接种至不同浓度TDZ诱导培养基上,胚小叶前期迅速膨大变绿,培养20d左右时逐步在小叶背面基部出现芽点,培养30d时仍较小(图2B),整个培养过程中几乎没有出现水渍状或雪花状愈伤;但随着TDZ浓度升高,产生的不定芽越来越难以分化出丛生芽,在伸长培养基上逐步转化为水渍状愈伤。
综合来看,6-BA和NAA配合使用对3个花生品种不定芽的诱导效果优于单独使用TDZ;其中丰花2号更易被激素诱导,而远杂9102和花814诱导效果更为稳定。
2.2 继代培养基及继代次数的筛选
3个品种在含不同浓度6-BA的继代培养基上均可实现芽再生,但丛生芽诱导率和芽再生率存在差异。其中丰花2号、远杂9102均在添加4.0mg/L6-BA的培养基上有最高丛生芽诱导率(分别为56.69%、36.36%)和芽再生率(分别为267.54%、72.73%),花814在添加5.0mg/L6-BA 的培养基上有最高丛生芽诱导率(27.78%),但在该浓度下芽再生率小于添加4.0mg/L6-BA的继代培养基(表3)。此外,无论是含3.0mg/L还是4.0mg/L6-BA的培养基,丛生芽诱导率基本一致,但芽再生率均为含4.0mg/L6-BA的培养基最佳。这表明3个品种对外源激素的敏感性不同,可能受自身内源激素的影响。综上所述,含4.0mg/L6-BA的继代培养基对3个品种的芽再生效果更好,具有广适性。
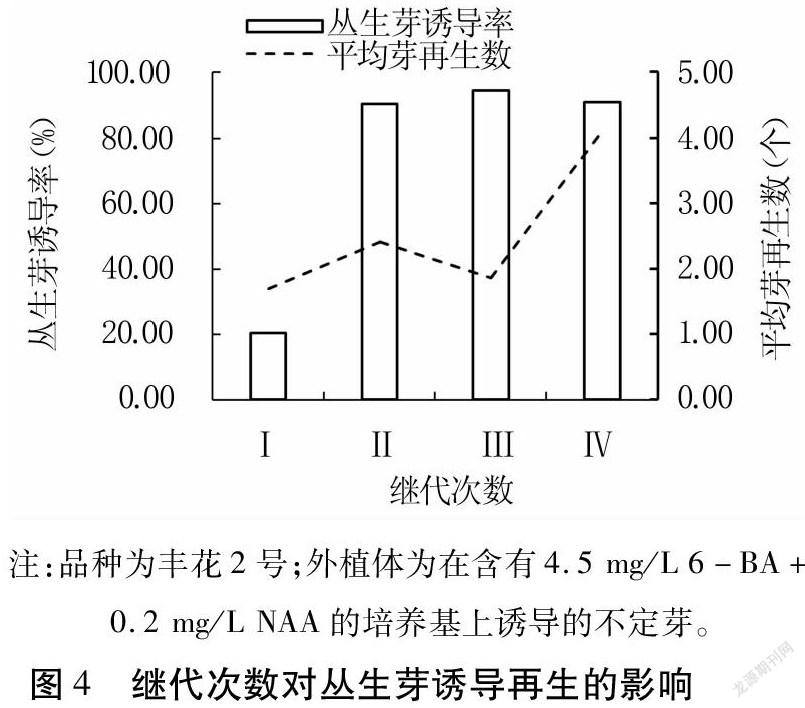
继代过程中发现随着继代次数的增多,继代诱导的丛生芽比例逐步增多。3个品种均存在这种现象。以丰花2号在含有4.5mg/L6-BA+0.2mg/LNAA培养基上诱导的不定芽的继代情况为例(图3和图4),第一次继代丛生芽诱导率仅为20.25%,平均芽再生数约为1.70个;第二次继代后丛生芽诱导率大幅提升至90.11%,平均芽再生数约为2.41个;第三次继代后,丛生芽诱导率达到最大值94.37%,平均芽再生数略有降低,约为1.86个;直至继代4次后,丛生芽诱导率依然大于90%,而平均芽再生数增加至最大值4.11个。由此可见,继代对不定芽再生有着重要影响,可通过适当提高继代次数来为更多具有潜在再生能力的不定芽提供充足养分,从而获得更多再生植株。
2.3 不同品种生根培养差异
再生芽转入生根培养基中,两个月后产生粗壮根系,继续培养可在瓶中开花下针(图5)。在添加0.2mg/LIBA+0.1mg/LNAA的生根培养基中,丰花2号、远杂9102、花814的生根率分别为73.80%、60.32%、50.66%(表4)。
2.4 花生胚小叶再生体系的建立
综合上述试验结果,建立了比较广适的花生胚小叶再生体系:挑选饱满健康的花生种子,消毒并浸泡过夜后在无菌条件下取出完整胚,从基部切下胚小叶,充分分散后作为外植体接种于M519+4.5mg/L6-BA+0.2mg/LNAA进行诱导培养,不定芽诱导过程约需30d;丛生芽诱导及芽再生过程需及时继代,继代培养基为M519+4.0mg/L6-BA,诱导培养60d时第一次继代,后每30d继代一次,以使更多的不定芽伸长、丛生芽生长更为旺盛,本试验共继代3~4次;生根过程需持续两个月,生根培养基为1/2MS+0.2mg/LIBA +0.1mg/LNAA,第一个月时再生芽即可诱导出根,继续培养根系逐渐粗壮,侧根增多,植株生长发育更为健壮,部分植株甚至可在培养瓶中开花下针;将健壮植株移栽至花盆中,在32℃/25℃、16h/8h光/暗循环、60%相对湿度的室内培养,最终收获荚果(图6)。整个再生周期约为8个月。
3 讨论与结论
前人的研究表明基因型依赖性是限制花生离体培养和遗传转化的重要因素[9]。为解决这一问题,本试验以花生胚小叶为外植体,对丰花2号、远杂9102、花814进行再生培养,旨在通过改变激素比例,使之忽略基因型依赖性,从而建立较为广适的再生体系,实现花生离体再生。
不同品种由于内源激素含量不同,外植体离体再生所需的培养条件也不尽相同。本试验用到的3个品种在相同的培养条件(M519+4.5mg/L6-BA+1.4mg/LNAA)下诱导的不定芽形态存在较大差异且生长速度也不同,这表明3个品种内源激素含量存在差异,为建立广适性的再生体系提供了前提。
前人研究已确定花生胚小叶诱导不定芽的激素及浓度范围为6-BA3~6mg/L、NAA1mg/L左右[10-12],不定芽分化则多使用3~5mg/L6-BA[13-15]。本试验所设6-BA和NAA浓度均在此范围内,结果发现6-BA浓度对不定芽诱导的影响较NAA更大,这印证了适宜的6-BA和NAA浓度配比对不定芽诱导和分化起着重要作用[16]。此外,我们还发现6-BA和NAA组合诱导效果优于单独使用TDZ,这表明多激素组合使用再生效果更好,侧面反映花生的生长发育是多激素协调合作的结果[17]。
此外,继代培养过程中我们发现多次继代可使更多具有潜在再生能力的不定芽形成丛生芽,从而提高芽再生率,继代4次后丛生芽诱导率仍大于90%,平均芽再生数为4.11个。这表明在不定芽诱导率较低的情况下,可以通过多次继代获得较多再生苗,这也为后期提高遗传转化效率提供了一定参考。
本研究建立了以胚小叶为外植体的较广适的花生高效再生体系,适宜不定芽诱导的最佳培养基为M519+4.5mg/L6-BA+0.2mg/LNAA,不定芽誘导率均大于50%,最佳继代培养基为M519+4.0mg/L6-BA,芽再生率均大于64%,其中丰花2号高达267.54%,继代4次的丛生芽诱导率仍高于90%;在1/2MS+0.2mg/LIBA+0.1mg/LNAA的生根培养基中,生根率均大于50%。这为下一步进行花生遗传转化研究奠定了基础。

