自噬调节剂对感染日本脑炎病毒小鼠脑部细胞凋亡的影响
张金花,高明星,刘泽霖,谷长勤
(华中农业大学动物医学院,武汉 430070)
自噬(autophagy)是维持体内平衡的一种高度保守过程[1],该过程将细胞质的大分子、过量或受损的细胞器及病原体递送至溶酶体降解,降解产物被机体重复循环利用[2-4]。自噬是一系列自噬体结构演变的过程,由自噬相关基因(autophagy-related gene,ATG)执行精细的调控。雷帕霉素(rapamycin, Rapa)是目前研究中常用的自噬诱导剂,其可以通过抑制mTOR(mechanistic target of rapamycin)通路来促进自噬的发生[5-6]。渥漫青霉素(wortmannin, Wort)主要通过抑制PtdIns3K Ⅲ类磷脂酰肌醇3-激酶(PtdIns3K class Ⅲ phosphatidylinositol 3-kinase)的活性来阻止自噬体的形成[7-8]。氯喹(chloroquine, CQ)在自噬体形成的下游(晚期)抑制自噬体和溶酶体融合和/或阻止溶酶体内自噬“货物”的降解[9-10]。细胞自噬已被证实在衰老、神经退行性疾病、心脏病、肿瘤的发生过程中发挥重要的作用[11]。细胞凋亡是一个进化上保守的过程,对于生物体的发育、生长和组织稳态至关重要[12]。细胞凋亡可被多种细胞信号激活,包括Ca2+浓度升高,氧化损伤引起的羟自由基等活性氧族(reactive oxygen species,ROS)、毒素、NO和激素刺激等[13-15]。凋亡主要信号通路有线粒体途径与死亡受体途径[16]。自噬及凋亡是两种不同的机制,尽管两者都参与决定细胞命运,它们可能在细胞中相互合作或对抗[17]。自噬在细胞中起着双重作用,既可以作为生存机制,也可以作为死亡机制,而凋亡对细胞死亡的调节是单向的[16],它能及时主动清除机体衰老及异常细胞发挥清道夫作用[18-19]。
日本脑炎病毒(Japanese encephalitis virus, JEV)感染主要经皮肤毛细血管或淋巴管至单核巨噬细胞系统进行繁殖。达到一定程度后即侵入血循环,造成病毒血症,并侵入血管内膜及各靶器官,如中枢神经系统、肝、心、肺、肾等,引起全身性病变[20-21]。细胞自噬与细胞凋亡是维持体内平衡的重要机制,在病毒感染过程中,机体可能通过凋亡或自噬机制“牺牲”感染细胞来保护其他细胞。本试验通过自噬调控药物处理感染JEV小鼠,分析自噬调控药物对小鼠脑部JEV感染引起的细胞凋亡的影响。
1 材料与方法
1.1 材料
乙型脑炎病毒P3株由华中农业大学农业微生物国家重点实验室曹胜波教授馈赠,病毒采取乳鼠脑内扩增,空斑试验测定病毒毒价。6周龄 BABL/c 雌鼠305只,购于华中农业大学动物实验中心。鼠源JEV E抗体腹水由华中农业大学农业微生物国家重点实验室曹胜波教授馈赠,华中农业大学基础兽医病理实验室纯化使用。抗Bcl2、Bax、Cas3、Cas8及GAPDH单克隆抗体购自 ABclonal 公司。PCR引物由上海生工技术有限公司合成。
1.2 动物模型构建及临床观察
动物试验遵循《湖北省实验动物管理条例》中的规定。将305只BALB/c雌鼠分为8组,分别为DMEM(0.10 mL)对照组(Control);JEV(105PFU,0.10 mL)感染组(JEV);JEV(105PFU,0.10 mL)+雷帕霉素(Rapa,5.00 mg·kg-1,0.20 mL)组(JEV+Rapa);JEV(105PFU,0.10 mL)+渥漫青霉素(Wort,1.00 mg·kg-1,0.20 mL)组(JEV+Wort);JEV(105PFU,0.10 mL)+氯喹(CQ,50.00 mg·kg-1,0.20 mL)组(JEV+CQ);雷帕霉素(Rapa,5.00 mg·kg-1,0.20 mL)组(Rapa);渥漫青霉素(Wort 1.00 mg·kg-1,0.20 mL)组(Wort);氯喹(CQ,50.00 mg·kg-1,0.20 mL)组(CQ),其中,Rapa、Wort、CQ于感染病毒前2 h给药,之后每天给药,给药时间持续10 d,给毒及给药的方式均为腹腔注射。小鼠持续喂养20 d,每天观察并记录小鼠临床症状,依据小鼠感染JEV后临床症状评分等级,对小鼠症状进行评分[22]。所有试验均按照中国湖北省华中农业大学兽医学院研究伦理委员会推荐的方案进行。
1.3 脑组织样品采集
小鼠在给药及感染病毒后10、20 d进行取样,左侧脑组织冻存,右侧脑大脑皮层芝麻粒大小固定于2.5%戊二醛固定液中,送至谷歌生物公司制备切片染色后TECNA110透射电镜观察并拍照,剩余部分固定于4%甲醛固定液中。
1.4 Tunel 染色
小鼠感染病毒后10 d,取右侧脑组织固定于4%甲醛固定液中。常规二甲苯脱蜡、梯度乙醇脱水、凋亡检测试剂盒和Tunnel法定量检测神经细胞凋亡。在400倍光学显微镜下随机选取5个视野。正常细胞核呈蓝色,阳性凋亡细胞呈棕黄色,并记录阳性凋亡细胞数。
1.5 组织免疫荧光试验
小鼠感染病毒后10 d,取右侧脑组织制作石蜡切片。将石蜡切片脱蜡至水后,置于3%H2O2中30 min,以淬灭内源性过氧化物酶后于柠檬酸盐缓冲液中完成抗原修复。洗涤后,切片在5%BSA中封闭1 h后,将一抗(鼠源抗JEV-E一抗,1∶100;兔源抗Bad一抗,1∶100,)4 ℃孵育过夜。洗涤后,滴加二抗(FITC Goat Anti-Mouse IgG、Cy3 Goat Anti-Rabbit IgG)孵育2 h,洗涤后,用DAPI染色,使用抗免疫荧光淬灭剂封片。计数方式为每张切片10倍镜下的3个视野的细胞数取平均数,其中,每个视野的细胞数为150~200个。
1.6 荧光定量qPCR检测目的基因
小鼠感染病毒后10、20 d,取左侧脑组织冻存。Trizol法提取脑组织总RNA,应用TaKaRa反转录试剂盒将RNA反转录合成cDNA,应用TaKaRa荧光定量PCR试剂盒进行qPCR反应。qPCR反应的引物序列如表1。qPCR反应条件:预变性95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,共40个 循环;熔解曲线分析,95 ℃ 15 s,60 ℃ 30 s,95 ℃ 15 s。采用2-△△Ct分析法计算各样本中目的基因的相对表达水平。
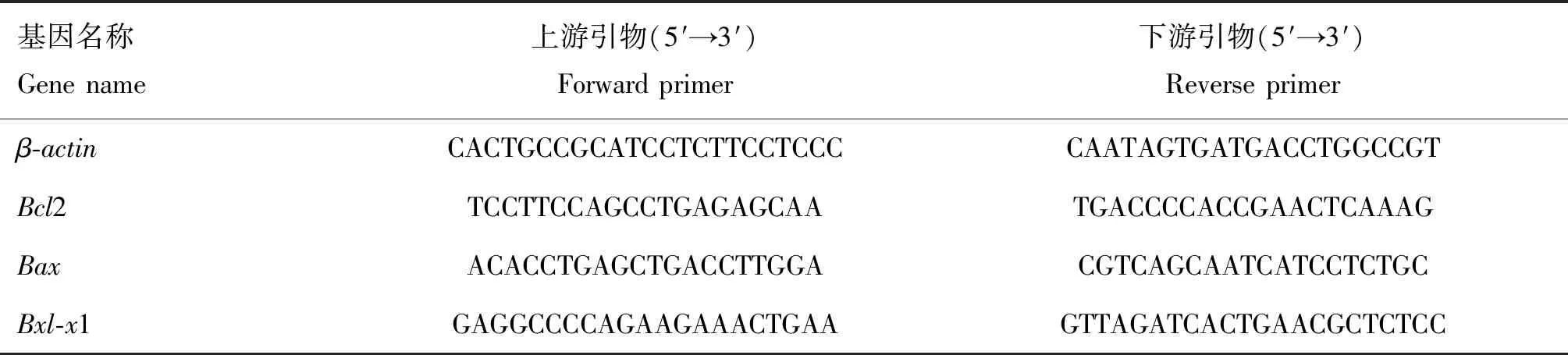
表1 qPCR引物序列
1.7 Western blot检测蛋白表达量
小鼠感染JEV后10 d,取左侧脑组织冻存。提取组织总蛋白,采用BCA法进行蛋白定量测定,参照BCA蛋白定量试剂盒说明书进行。Western blot方法检测Bcl2、Bax、Cas3、Cas8蛋白表达量。常规的SDS-PAGE分离的蛋白,转膜。取出PVDF膜,用5%脱脂奶粉37 ℃封闭1 h。TSBT洗膜后,加入TSBT稀释后的一抗,4 ℃孵育过夜。TSBT洗膜3次,每次10 min,加入TSBT稀释的二抗,37 ℃ 孵育40 min。TBST洗膜3次,每次10 min,配制显色工作液,进行免疫印迹显色,用ImageJ软件进行灰度值分析。以GAPDH为内参检测脑组织Bcl2、Bax、Cas3、Cas8蛋白的相对表达量。
1.8 数据统计分析
使用Graph Pad Prism 6软件,单因素方差分析,对各组小鼠脑组织中炎症因子的mRNA表达进行分析并作图。采用Image J软件对Western blot结果中自噬及炎症相关蛋白的灰度值进行定量统计。
2 结 果
2.1 不同处理组小鼠的临床症状
对小鼠的神经症状进行观察,JEV+Rapa组小鼠症状持续期较长,为5~20 d,且5~20 d均有小鼠出现明显的立毛、弓背及运动功能障碍的表型症状。JEV组小鼠症状持续期较短,为5~12 d,且部分小鼠出现立毛、弓背及运动功能障碍的表型症状。JEV+Wort组小鼠仅在7~10 d有个别小鼠出现轻度的精神沉郁及立毛现象,之后恢复正常。其他组小鼠在饲养期间无明显神经症状出现。对各组小鼠的发病率及生存率进行统计分析,JEV+Rapa组小鼠发病率为65.5%,存活率最低;JEV组小鼠发病率为32.7%;JEV+Wort组小鼠生存率达90%;JEV+CQ组小鼠生存率近100%;Control组及药物对照组小鼠都无患病及死亡情况。
2.2 不同处理组小鼠脑部亚细胞结构变化
利用透射电镜技术(TEM),观察到小鼠感染病毒后10 d,脑组织中自噬体及脑组织亚细胞结构水平的病理变化。Control组小鼠脑部线粒体无严重损伤。JEV组小鼠脑组织出现线粒体变圆、线粒体嵴变短的现象。JEV+Rapa组小鼠脑组织线粒体严重损伤,线粒体变大、变圆,线粒体嵴变短、变浅甚至消失。JEV+Wort及JEV+CQ组小鼠脑组织线粒体轻微损伤(图1)。

箭头.线粒体。比例尺=2 μm
2.3 不同处理组小鼠脑部细胞凋亡差异
利用Tunel染色方法,观察小鼠感染病毒后10 d,脑组织中细胞凋亡阳性信号(图2A)。统计分析发现,与JEV+Wort及JEV+CQ组小鼠相比,JEV+Rapa及JEV组小鼠脑组织较多细胞发生细胞凋亡(图2B)。
A.小鼠脑组织凋亡细胞分布(红色箭头.棕色阳性信号);B.小鼠脑部细胞凋亡差异分析(*.P<0.05;**.P<0.01)
2.4 不同处理组小鼠脑组织细胞凋亡与病毒感染关系分析
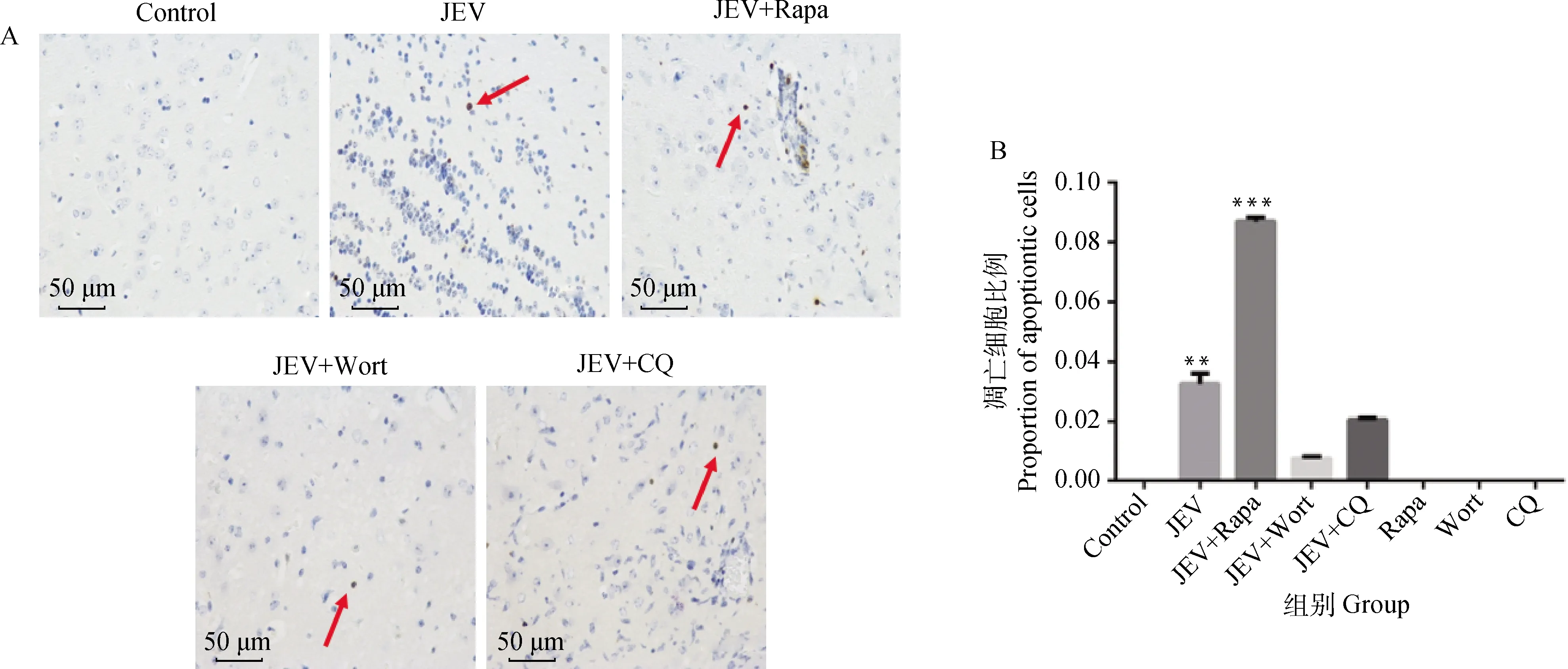
Bad是一个促凋亡现象的标志基因,利用组织免疫荧光技术(IF),观察到病毒感染10 d后不同处理组小鼠脑组织中促凋亡因子Bad与JEV-E蛋白共定位情况不同: JEV组小鼠脑组织少量神经元发生Bad与JEV-E的共定位现象;JEV+Rapa组小鼠脑组织大量神经元发生Bad与JEV-E的共定位现象;JEV+Wort组及JEV+CQ组小鼠脑组织少量神经元出现Bad红色阳性信号及JEV-E绿色阳性信号,但不发生共定位现象(图3)。
A.小鼠脑组织 Bad及JEV-E蛋白免疫荧光成像(红色.Bad蛋白;绿色.JEV-E蛋白);B.小鼠脑组织Bad与JEV-E蛋白共定位的细胞比例(*.P<0.05; **.P<0.01)
2.5 不同处理组小鼠脑组织凋亡因子mRNA表达量差异
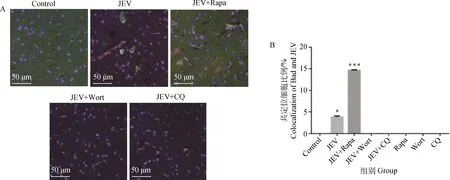
利用qPCR技术分别检测病毒感染后10及20 d 不同处理组小鼠脑组织凋亡因子Bax、Bcl2、Bcl-xl的mRNA相对表达量。结果显示:不同处理组小鼠在病毒感染高峰期10 d时脑组织中Bax的表达量未发生明显差异,而JEV+Wort组及JEV+CQ组Bcl2及Bcl-xl表达量略高于JEV组及JEV+Rapa组小鼠(P<0.05),正常组(Control组)及单独给药组(Rapa组、Wort组、CQ组)小鼠脑组织无明显变化。病毒感染后20 d,不同处理组小鼠脑组织凋亡因子表达量恢复至正常水平(图4)。
*.P<0.05;**.P<0.01;***.P<0.001;n=3
2.6 不同处理组小鼠脑组织细胞凋亡相关蛋白表达量差异
于JEV感染后10 d收集小鼠脑组织,提取组织蛋白,应用Western blot技术评估细胞凋亡相关蛋白的表达量差异。结果显示:不同处理组小鼠脑部Bcl-2蛋白表达量变化未发生明显差异;与JEV+CQ组小鼠比较,JEV+Rapa及JEV组小鼠脑部Bax蛋白表达量较高(P<0.05);与JEV及JEV+CQ组小鼠比较,JEV+Rapa组小鼠脑部Cas3表达量较高(P<0.05)(图5)。
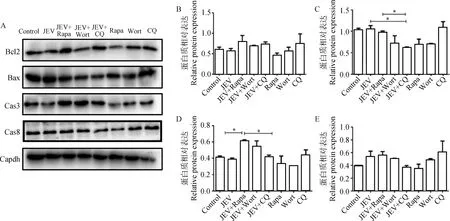
A.Western blot结果;B.Bcl-2/GAPDH;C.Bax/GAPDH;D.Cas3/GAPDH;E.Cas8/GAPDH;*.P<0.05;**.P<0.01;***.P<0.001;n=3
3 讨 论
JEV是一种人畜共患病原体,对人类健康造成重大威胁,尤其是儿童。因此,建立与人类感染后相似的临床症状及病理特征的研究模型至关重要,小鼠作为常用于研究JEV的动物模型,是较简单且有效的研究模型。病毒的接种方式具有多样性,依据本试验的研究目的,腹腔注射可以模仿JEV感染啮齿动物后通过外周血管及淋巴组织向中枢神经系统传输病毒的自然感染过程,是JEV接种感染小鼠的优选途径。
JEV感染小鼠后,小鼠会出现共济失调、运动障碍等明显的神经症状[22]。本次动物试验结果的数据显示,自噬诱导剂Rapa调控的感染JEV的小鼠在感染后5~20 d均出现不同严重程度的临床表现,包括精神沉郁、立毛、弓背及感染高峰期出现的眼球充血、后肢瘫痪及转圈的症状。仅感染JEV的小鼠在病毒感染后5~10 d出现立毛、弓背、眼球充血及后肢瘫痪的临床症状,后期恢复至正常。自噬早期抑制剂Wort调控的感染JEV小鼠部分出现精神沉郁、立毛、弓背的早期轻度症状。自噬晚期抑制剂CQ调控的感染JEV小鼠未出现明显表型症状。正常组及药物对照组小鼠未出现异常表现。JEV感染小鼠的临床症状与之前相关研究[23-24]的结果一致。
JEV感染小鼠脑组织能引起神经元细胞的坏死,其中一种机制就是引起神经细胞凋亡[25]。Bad是促细胞凋亡关键蛋白,能正反馈调控细胞凋亡信号传导,进而诱导细胞凋亡发生[26]。本研究对不同处理组小鼠脑组织中凋亡蛋白Bad与JEV-E蛋白的共定位情况检测分析发现JEV及JEV+Rapa组小鼠脑组织较多神经元发生Bad与JEV-E的共定位,JEV+Wort及JEV+CQ组小鼠脑组织神经元未发生明显共定位现象。另外,本研究对不同处理组小鼠脑部凋亡因子的表达量检测分析发现JEV及JEV+Rapa组小鼠脑部促凋亡因子表达量呈上调趋势。因此,结合之前的试验结果,分析自噬抑制剂Wort及CQ减弱JEV感染引起的神经元凋亡程度,对感染JEV小鼠具有一定的保护作用。
Caspase家族是促细胞凋亡的关键蛋白,通过级联反应触发细胞凋亡[27-28]。Caspase8通过与死亡配体相似的caspase途径和线粒体依赖途径激活caspase3或作用于其他Caspase成员和凋亡相关死亡受体信号通路,诱导细胞凋亡[29-30]。Bcl-2家族蛋白主要控制线粒体凋亡途径,由抗凋亡和促凋亡分子组成。Bcl-2家族蛋白主要分为3类:第1类是抗凋亡蛋白,如Bcl-xl;第2类是促凋亡蛋白,如Bax和Bak;第3类是只有BH3结构域的蛋白[31]。本研究对不同处理组小鼠脑部相关凋亡蛋白的表达量检测分析发现自噬调控药物对感染JEV小鼠脑部凋亡蛋白的表达量无明显影响。结合本课题组研究[32]建立动物模型数据,分析本研究中病毒感染量较低,不足以引起明显的细胞凋亡现象。另外,细胞自噬与细胞凋亡的相互作用较复杂,既相互协同又相互拮抗,细胞凋亡通路的激活或抑制也可能受自噬调控药物调控的自噬过程有关。研究发现,JEV感染神经细胞系,引起内质网应激,并通过P38依赖的,CHOP蛋白介导的通路诱导细胞凋亡[33-35], 而且JNK分子在JEV感染引起的细胞凋亡中起到作用[35-36]。JEV感染引起细胞凋亡的通路复杂多样,具体机制还需进一步研究。
本试验建立自噬调控药物处理的JEV小鼠模型,通过观察感染JEV小鼠的临床症状及脑部线粒体结构损伤程度,检测分析小鼠脑部相关凋亡因子mRNA及蛋白的表达量变化,发现自噬抑制剂渥漫青霉素及氯喹对日本脑炎病毒感染引起的细胞凋亡具有一定的减弱作用,但具体机制需从多个方面深入研究。
4 结 论
建立自噬诱导剂及自噬抑制剂处理的乙型脑炎病毒感染小鼠的动物模型,经研究发现自噬抑制剂渥漫青霉素和氯喹可通过降低Caspase活性,抑制Caspase通路级联反应,减弱乙型脑炎病毒感染小鼠后引起的细胞凋亡反应。

