稳定表达TIGAR基因的BHK-21细胞系的构建及其对新城疫病毒增殖效果的评价
栗永华,刘 伟,徐智凯,刘炜玮,孙英杰,仇旭升,谭 磊,宋翠萍,廖 瑛,丁 铲,孟春春
(中国农业科学院上海兽医研究所,上海 200241)
新城疫(Newcastle disease,ND)是危害我国养禽业的严重疫病之一,新城疫病毒(Newcastle disease virus,NDV)主要通过干扰素、TNF途径和caspase途径诱导受感染细胞发生细胞凋亡,从而产生病变效应[1]。p53抑癌蛋白在细胞应激反应和抑制肿瘤恶性发展中起着重要作用,p53蛋白在DNA修复、细胞凋亡[2]、防止肿瘤细胞的增殖[3-4]以及肿瘤的形成[5-7]等方面发挥了重要的作用。
TP53诱导的糖酵解和凋亡调节因子(TP53-induced glycolysis and apoptosis regulator,TIGAR)的表达降低了细胞内果糖-2,6-二磷酸酶(fructose-2,6-bisphosphatase,F-2,6-P2)的水平,磷酸果糖激酶降低,果糖-6-磷酸(fructose-6-phosphate,F-6-P)水平升高,从而抑制了糖酵解,使6-磷酸葡萄糖(glucose-6-phosphate,G-6-P)进入磷酸戊糖(pentose phosphate pathway,PPP)途径增加[8-9],降低了细胞内活性氧(reactive oxygen species,ROS)的含量[10],从而减少细胞凋亡和DNA损伤,导致内源性TIGAR表达对p53诱导的细胞死亡产生抑制作用[11]。
有研究表明,TIGAR在皮层神经元预处理后,增加PPP途径,促进还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)和谷胱甘肽(glutathione,GSH)的产生,清除ROS,抑制细胞凋亡从而维持细胞存活[12]。一些研究表明,p53基因通过平衡TIGAR和DRAM具有调节应激诱导凋亡和自噬[13-14]。本研究旨在构建有利于NDV增殖的疫苗候选细胞株,所以选用的细胞是易于NDV增殖的BHK-21细胞,在前人研究的基础上,扩增出鸡TIGAR基因并首次扩增出仓鼠的TIGAR基因,构建稳定表达TIGAR基因的BHK-21细胞系。并评价NDV中强弱毒株在不同细胞系中的增殖滴度,意在比较不同来源的TIGAR基因发挥抗凋亡功能差异。为是否可以借助TIGAR基因构建的稳定过表达细胞系,使NDV在疫苗生产中突破不能体外大量扩增的瓶颈作出新的尝试。
1 材料与方法
1.1 质粒、菌株、病毒、细胞
NDV强毒株ZJ1购于中国兽医药品监察所;鸡源3×Flag-TIGAR质粒[20]、Phage质粒、PMD 2G质粒、PAX质粒、Polyboren、NDV中强毒SH15、NDV弱毒株LaSota、NDV强毒株Herts/33、293T细胞系和BHK-21细胞系为本实验室保存,DH5α感受态细胞为天根公司产品。
1.2 抗体与试剂
Flag抗体(货号8146S)、β-actin抗体(货号3700S)、PARP抗体(货号9532S)和Caspase 3兔抗体(货号29629)均购于Cell Signaling Technology公司;NotⅠ限制性内切酶(货号FD0593)、XbaⅠ限制性内切酶(货号FD0684)、DMEM培养基均购于美国Thermo Fisher公司;Blasticidin S HCL(货号S7419)购于Selleck公司;无内毒素质粒大提试剂盒(货号DP117)购于天根生化科技(北京)有限公司;SYBR Green qPCR mix(货号2092)购于广州东盛生物科技有限公司;Trizol、Alexa FlourTM 488 Annexin V/Dead Cell Apoptosis Kit为Thermo Fisher公司产品,TaqDNA聚合酶、dNTP、T4 DNA连接酶为诺唯赞公司产品,M-MLV、RNasin、FuGen转染试剂为Promega公司产品,ECL发光液为圣尔公司产品。
1.3 方法
1.3.1 设计仓鼠TIGAR基因和鸡TIGAR基因的相关引物 根据鸡TIGAR基因的序列(登录号MH511993.1)以及GenBank预测的仓鼠TIGAR基因的序列(登录号:XM_005084096.3)设计引物,见表1。

表1 PCR引物序列
1.3.2 重组慢病毒质粒的构建 将BHK-21细胞按照106的细胞密度接种于6孔板中,待长满后,用800 μL Trizol裂解细胞提取RNA,加入Oligo 18T逆转录为cDNA。再分别以提取的仓鼠cDNA和前期构建的鸡源3×Flag-TIGAR质粒为模板,进行PCR扩增,随后酶切连入Phage包装质粒载体。
1.3.3 构建、鉴定及筛选稳定表达仓鼠源和鸡源TIGAR基因的细胞系 将293T细胞按照2×105的细胞密度传至100 mm的细胞培养皿中。每皿转染PAX(6 μg)、PMD 2G(3 μg)和Phage-TIGAR(9 μg)。转染60 h后,将包装好的慢病毒上清收集冻存备用。随后取适量包装好的慢病毒接种于生长状态良好的BHK-21细胞中,并加入2 μL polyboren提高感染效率。继续培养8 h后更换维持液,并在维持液中加入终浓度为0.4 mg·mL-1的Blasticidin进行加压筛选。对存活细胞用有限稀释法进行亚克隆筛选,将单克隆生长的细胞分别在核酸水平和蛋白水平对TIGAR基因进行鉴定。并将阳性细胞连续传代30次,每隔10代使用qPCR引物鉴定TIGAR基因的表达量以及传代稳定性。采用20 μL qPCR体系:qPCR Mix 10.0 μL,Primer-F、Primer-R各0.4 μL,DNA 2.0 μL,ddH2O 7.2 μL;qPCR程序:94 ℃ 3 min,95 ℃ 15 s、60 ℃ 15 s、72 ℃ 20 s,40个循环。
1.3.4 流式检测重组细胞系的自然凋亡率及抗凋亡能力 将BHK-21、BHK-21-chTIGAR和BHK-21-hamTIGAR细胞按照1×105的数量接种于6孔板,每24 h收集细胞样品于离心管中,直到192 h。将细胞样品于4 ℃ 1 000 r·min-1离心5 min,弃上清,用预冷的PBS洗3次,加入500 μL 1×Binding Buffer重悬细胞,分别再加入5 μL PI和25 μL Annexin V-FITC,室温避光孵育15 min,随后用流式细胞仪检测细胞凋亡情况。随后将上述3种细胞按照1×106的数量接种于6孔板中,分别在培养24和48 h时,使用凋亡诱导剂Staurosporine预先处理2 h后,再使用流式技术检测细胞凋亡率。
1.3.5 Western blot检测重组细胞系的凋亡通路变化情况 将BHK-21、BHK-21-chTIGAR和BHK-21-hamTIGAR细胞系按照1×106的数量接种至6孔板中,待细胞长至70%~80%时,将Herts/33病毒按照0.1 MOI感染细胞。在接毒后的30和36 h收集蛋白样品,使用Western blot检测凋亡相关蛋白的变化情况,并使用image J软件扫描蛋白灰度。
1.3.6 病毒生长滴度测定 将ZJ1、SH15和LaSota 病毒株按照0.01 MOI的病毒量感染BHK-21、BHK-21-chTIGAR和BHK-21-hamTIGAR细胞,在感染后每隔24 h收集细胞上清至96 h,将细胞上清作为病毒原液检测细胞上清中病毒的TCID50。
2 结 果
2.1 Western blot鉴定亚克隆细胞
将测序鉴定为阳性的BHK-21-chTIGAR和BHK-21-hamTIGAR细胞经过亚克隆后扩大保存,并用Western blot(Flag抗体)鉴定外源TIGAR基因的表达情况。结果显示,BHK-21-chTIGAR和BHK-21-hamTIGAR细胞系均获得高表达细胞株(图1),表明两种细胞系构建成功。

A.BHK-21细胞中稳定表达仓鼠TIGAR基因;B.BHK-21细胞中稳定表达鸡TIGAR基因
2.2 qPCR鉴定重组细胞的稳定性
qPCR鉴定结果表明,所得到的BHK-21-chTIGAR细胞中鸡源TIGAR基因和BHK-21-hamTIGAR细胞中仓鼠源TIGAR基因的开放阅读框序列cDNA已经稳定的整合到细胞基因组中,能够随着BHK-21细胞系传代而稳定持续地转录和表达且序列无突变(图2)。

图2 qPCR检测BHK-21-chTIGAR和BHK-21-hamTIGAR细胞稳定性
2.3 重组细胞系的自然凋亡率
流式细胞仪检测结果(图3)表明,BHK-21-hamTIGAR细胞在培养48和72 h后,细胞的自然凋亡率高于BHK-21细胞,且差异显著(P<0.01),在96和144 h其凋亡率显著低于BHK-21细胞(P<0.05),而在120 h无明显差异。BHK-21-chTIGAR细胞的凋亡率在48、72、120和144 h时均明显高于野生型BHK-21细胞,且差异极显著(P<0.01)。

ns.P>0.05;*.P<0.05;**.P<0.01;***.P<0.001
存活试验表明BHK-21-hamTIGAR细胞在生长到96 h时细胞存活率明显高于BHK-21细胞,且差异显著(P<0.05),在144 h明显高于BHK-21细胞,且差异极显著(P<0.001)。而BHK-21-chTIGAR细胞的存活率在72和120 h明显低于BHK-21细胞,且差异极显著(P<0.001),在96和144 h低于BHK-21细胞,且差异显著(P<0.05)。仓鼠源TIGAR重组细胞系在生长后期发挥了很好的抗凋亡作用,而鸡源TIGAR细胞系存活率反而低于野生型BHK-21细胞。
2.4 重组细胞系的抗凋亡能力
使用Staurosporine对BHK-21、BHK-21-chTIGAR和BHK-21-hamTIGAR细胞提前2 h诱导凋亡,利用流式细胞仪检测3种细胞的抗凋亡能力。结果见图4A、B,在BHK-21细胞24 h诱导凋亡后,其早期凋亡率(2.3%)高于BHK-21-hamTIGAR细胞(1.1%),且差异显著(P<0.01);但与BHK-21-chTIGAR细胞的早期凋亡率(2.6%)无显著差异,晚期凋亡率三者均差异不显著。在培养48 h诱导细胞凋亡后,BHK-21细胞的早期凋亡率(13.1%)明显高于BHK-21-chTIGAR细胞的早期凋亡率(5.4%)和BHK-21-hamTIGAR细胞的早期凋亡率(4.9%),且差异均极显著(P<0.01或P<0.001);但晚期凋亡率三者差异亦均无差异。流式检测结果表明BHK-21-hamTIGAR细胞的抗凋亡能力明显高于BHK-21和BHK-21-chTIGAR细胞。
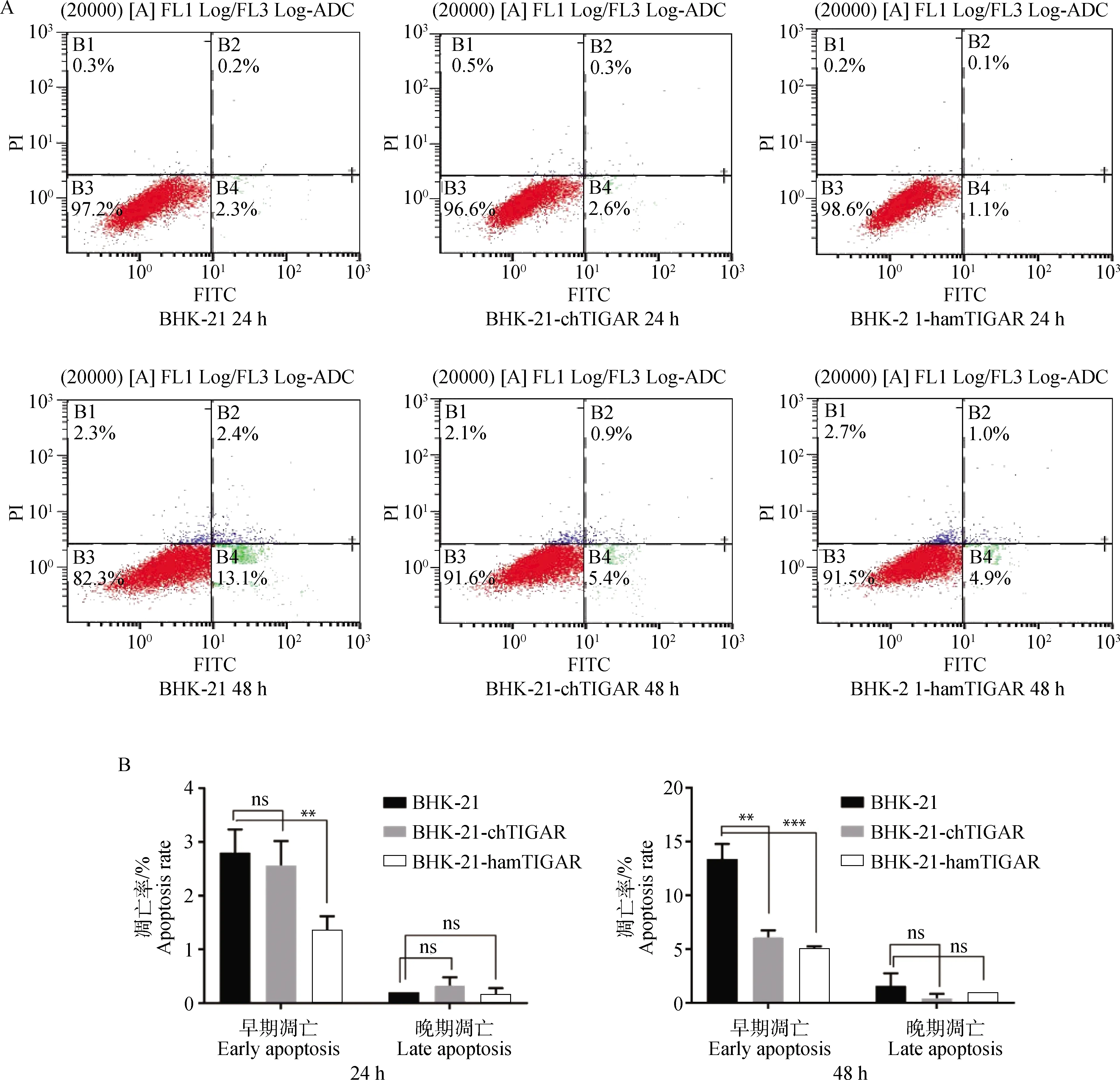
A.流式细胞仪检测细胞凋亡;B.统计分析细胞凋亡率;ns.P>0.05;*.P<0.05;**.P<0.01;***.P<0.001
2.5 重组细胞系凋亡通路变化的Western blot检测
使用相同剂量Herts/33病毒感染BHK-21、BHK-21-chTIGAR和BHK-21-hamTIGAR细胞,并利用Western blot检测细胞内的关键凋亡蛋白的变化情况。结果如图5所示,在病毒感染后30和36 h时,BHK-21-hamTIGAR细胞中PARP、caspase-3的裂解蛋白表达量均低于BHK-21和BHK-21-chTIGAR细胞。BHK-21-hamTIGAR细胞在感染后30 h时,caspase-3表达量显著(P<0.05)下降,PARP的表达量极显著下降(P<0.001)。在感染后36 h时,PARP和caspase-3表达量均极显著下降(P<0.01)。两种凋亡指征蛋白在BHK-21-chTIGAR细胞中的表达量与野生型BHK-21细胞相比无明显变化(Western blot图片结果),灰度扫描后的数据有统计学差异。上述结果在凋亡发生通路方面进一步证实了BHK-21-hamTIGAR具备较高水平的抗凋亡能力。
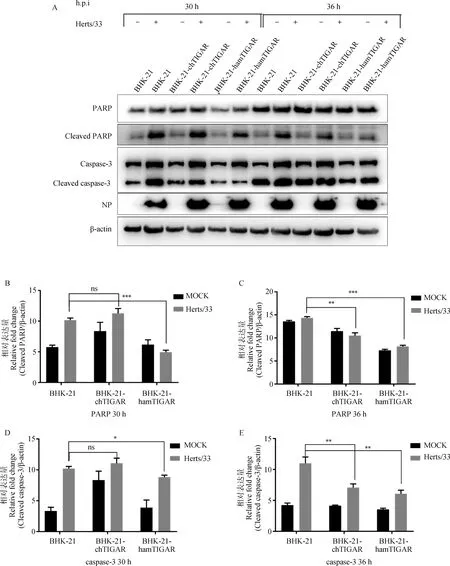
A.Western blot检测BHK-21、BHK-21-chTIGAR和BHK-21-hamTIGAR细胞中PARP、caspase-3的表达量;B.30 h PARP/β-actin的相对表达量;C.36 h PARP/β-actin的相对表达量;D.30 h caspase-3/β-actin的相对表达量;E.36 h caspase-3/β-actin的相对表达量;ns.P>0.05;*.P<0.05;**.P<0.01;***.P<0.001
2.6 病毒生长滴度测定
为比较NDV在稳定表达TIGAR基因的重组细胞系和野生型BHK-21上的增殖水平,分别选取NDV的强、中、弱毒株进行比较。结果如图6所示,感染新城疫强毒ZJ1 72 h时,BHK-21-hamTIGAR细胞内病毒滴度(5.67)高于BHK-21细胞(5.27),且差异显著(P<0.05)。感染新城疫中强毒SH15 48和96 h时,BHK-21-hamTIGAR细胞内病毒滴度(5.37和4.90)分别高于BHK-21细胞(5.13和4.67),且差异显著(P<0.05)。感染新城疫弱毒LaSota 72和96 h时,BHK-21-hamTIGAR细胞内病毒滴度(4.63和4.07)高于BHK-21细胞(4.63和3.77),且差异显著(P<0.05)。但在BHK-21-chTIGAR细胞上3种病毒不同时间点的病毒滴度均与BHK-21野生型细胞无差异。
A.新城疫强毒ZJ1;B.新城疫中强毒SH15;C.新城疫弱毒LaSota; ns.P>0.05; *.P<0.05
3 讨 论
TIGAR蛋白是可以调节糖酵解和凋亡作用的蛋白,TIGAR蛋白通过抑制糖酵解途径,增加磷酸戊糖途径,可产生大量的5-磷酸核糖,是DNA修复和合成的重要原料[15];还可以通过维持还原型谷胱甘肽所需的NADPH水平来调节ROS水平,保护细胞免受ROS的损伤并保持线粒体的完整性,细胞内NADPH升高,ROS和自噬活性降低[16],因此TIGAR具有抑制细胞凋亡和自噬的作用[17-19]。
本研究首次扩增出仓鼠的TIGAR全长基因序列,构建慢病毒包装重组质粒phage-hamTIGAR,利用包装慢病毒的方法构建稳定表达TIGAR基因的BHK-21细胞系,通过Western blot和DNA测序筛选出表达TIGAR基因的BHK-21细胞系并将其纯化;qPCR检测结果表明所构建细胞系可长期稳定表达TIGAR基因。通过Western blot、流式细胞术检测BHK-21-hamTIGAR细胞、BHK-21-chTIGAR细胞和BHK-21细胞的抗凋亡能力,其结果显示,BHK-21-hamTIGAR细胞的抗凋亡能力高于BHK-21-chTIGAR细胞和BHK-21细胞,可能由于仓鼠TIGAR基因对于BHK-21细胞是内源基因,鸡TIGAR基因对于BHK-21细胞是外源基因所导致。测定不同毒力的新城疫病毒在BHK-21-hamTIGAR细胞、BHK-21-chTIGAR细胞和BHK-21细胞上的生长曲线,结果表明新城疫的强中弱毒株在BHK-21-hamTIGAR细胞上的病毒滴度均高于BHK-21-chTIGAR细胞和BHK-21细胞,表明该细胞系可作为NDV高效增殖疫苗株的潜在选择。
有研究将鸡源TIGAR基因过表达至DF-1细胞系后,细胞的抗凋亡能力明显增加[20],本研究将鸡源TIGAR基因稳定表达至BHK-21细胞系中,并没有明显的抗凋亡作用,可能是由于TIGAR基因对于DF-1细胞是内源性基因,而对于BHK-21细胞是异源性基因,所以其抗凋亡效果并不明显,结果中仓鼠源TIGAR对于BHK-21细胞来说属于内源性基因,所以其抗凋亡作用明显,根据这两个试验可以初步猜测将内源性基因过表达后,可能发挥的作用更加明显。付托[21]将人源TIGAR基因稳定表达至CHO细胞系中,通过提高NADPH从而维持细胞内氧化还原稳态,降低ROS的水平,抑制线粒体途径引起的细胞凋亡,从而使CHO细胞抗凋亡能力提升。Ye等[22]用RNA干扰沉默HepG 2细胞中的TIGARmRNA后,主要通过细胞凋亡和自噬作用抑制细胞生长。当细胞受到应激时,TIGAR过表达导致细胞内NADPH升高,并降低ROS水平,抑制细胞自噬,随后通过抑制ROS水平介导细胞凋亡[23-27]。用D-半乳糖处理神经母细胞瘤可以诱导细胞坏死性凋亡和自噬[28]。这些结果都与本文的结论相一致,表明通过控制TIGAR基因的表达可对细胞的凋亡水平进行精确调控。
4 结 论
利用慢病毒包装法成功构建过表达TIGAR基因的BHK-21细胞系。构建的BHK-21-hamTIGAR细胞相比于BHK-21细胞和BHK-21-chTIGAR细胞其抗凋亡功能明显提高,且病毒滴度也明显增加,有助于新城疫病毒的复制,构建的BHK-21-hamTIGAR细胞可用作新城疫的候选疫苗细胞株。

