肝细胞癌患者肝切除术后严重并发症列线图风险预测模型的建立与评价
邱洁净,莫新少,滕艳娟,陈似霞,唐雯桢
(1.广西医科大学第一临床医学院,广西 南宁 530021;2.广西医科大学第一附属医院 肝胆外科,广西 南宁 530021)
原发性肝细胞癌是我国第四大常见恶性肿瘤,居我国肿瘤相关死因的第二位[1]。目前肝切除术仍旧是肝癌患者的主要治疗方式,近10年来,随着科学技术的发展及医疗水平的提高,肝癌术后患者的病死率逐步下降,然而肝切除术后并发症的发生率仍然维持在较高水平[2-4],研究[3,5]表明术后并发症会延长患者的住院时间,增加住院费用,增加围术期病死率,甚至影响患者的生存率。有效及可靠的肝切除术后严重并发症的风险预测工具对早期筛查肝切除术后严重并发症发生的高危人群并采取相应措施预防术后并发症的发生具有重要意义。
既往有关肝切除术后严重并发症的风险预测模型存在样本量较小,预测因子不全、研究无法被重复等局限性[2,6-8],且大部分是基于传统的医疗和护理理念进行研究,随着医疗技术的进步和理念的更新,加速康复外科理念及多学科协作模式的应用和发展,使得肝切除术患者围术期管理得到较大优化,肝切除术后严重并发症的发生及其影响因素也有所变化[9-10],以往的风险预测模型可能不适用于新兴医疗护理观念,因此,本研究拟通过分析我院应用快速康复理念治疗和护理的肝癌手术患者的临床资料,探讨肝切除术后严重并发症的影响因素,旨在建立术后严重并发症的个体化列线图风险预测模型,以为肝癌患者围术期管理的优化提供参考依据。
1 资料与方法
1.1 一般资料
纳入某医院肝胆外科2018年1月—2020年6月行肝切除术的肝细胞癌患者,纳入标准:⑴ 病理诊断为肝细胞癌患者;⑵ 首次行肝切除术患者;⑶年龄>18岁;排除标准:⑴ 肝细胞癌复发患者;⑵ 行二步肝切除的肝细胞癌患者;⑶ 急诊手术患者;⑷ 资料不完整者。
1.2 临床资料收集
所有临床资料都通过医院HIS(Hospital Information System,HIS)系统前瞻性地收集,包括性别、年龄、吸烟史、饮酒史、合并症、乙肝、肝硬化、门静脉高压、肿瘤数目、肿瘤大小、体质量指数(BMI)、术前住院首次实验室检查结果:总胆红素(TBIL)、白蛋白(ALB)、天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、前白蛋白(PA)、凝血酶原时间(PT)、血红蛋白(Hb)、血小板(PLT)、术前甲胎蛋白(AFP)与术后第1天实验室检查结果(具体同术前)、美国麻醉医师学会(American Society of Anesthesiologists,ASA)分级、手术方式、麻醉方式、手术时间、术中出血量、术中输血量、术中输液量、肝门阻断时间、术中输注红细胞、术中输注血浆等;术后并发症的评估根据Clavien-Dindo分级评估[11],本研究将术后住院期间发生III级及以上并发症定义为严重并发症。
1.3 统计学处理
本研究采用SPSS2 4.0 对数据进行统计分析,符合正态分布的连续型变量用均数±标准差(±s)进行描述,组间比较采用t 检验,非正态分布的连续型变量采用中位数(四分位数)[M(IQR)]进行描述,组间比较采用Mann-Whitney秩和检验,计数资料用例数(百分比)[n(%)]表示,采用χ2检验或Fisher检验进行比较,首先进行单因素分析,将单因素分析中P<0.1的变量纳入Logistic回归分析,根据回归分析结果采用R软件建立列线图模型,用Bootstrap方法对预测模型内部验证,用C-指数、受试者工作曲线(receiver operating curve,ROC)下面积及校准曲线评价模型的预测效能[12],P<0.05为差异有统计学意义。
2 结 果
2.1 肝癌手术患者严重并发症发生情况
本研究共纳入854例肝癌肝切除术患者,其中191例(22.4%)患者发生I级并发症,28例(3.2%)患者发生II级并发症,71例(8.3%)患者为IIIa级并发症。5例(0.6%)患者为IIIb级并发症,10例(1.2%)患者发生IV级并发症,无V级并发症患者。严重并发症的发生率为10.1%。
2.2 患者术后严重并发症发生的单因素分析
比较严重并发症组和无严重并发症组的临床资料,筛选有关严重并发症的影响因素。两者在肝硬化、大肝癌切除、手术部位、手术方式、术中输注红细胞、术中输注血浆、AFP水平、肿瘤大小、术前AST、术后第1天ALB、AST、ALT、PA、PT、Hb、手术时间、术中出血量、术中输血量、术中输液量、肝门阻断时间方面差异有统计学意义(均P<0.05)(表1)。
2.3 患者术后严重并发症发生的多因素分析
将单因素分析中P<0.1的变量作为自变量,以严重并发症作为因变量,进行Logistic二元回归分析。结果显示,肝硬化、手术方式、术中血浆输注、手术时间、术后白蛋白、POD1天冬氨酸转氨酶6个变量是术后严重并发症的独立影响因素(均P<0.05)(表2)。
2.4 患者术后严重并发症发生风险的列线图模型的建立与验证
基于Logistic回归分析的结果,将独立影响因素引入R软件建立个体化列线图风险预测模型(图1)。并绘制校准曲线和ROC曲线,校准曲线显示预测值与实际观测值基本一致,表明列线图模型预测的准确度较好(图2)。ROC曲线下面积为0.788(0.74~0.836),模型的区分度较好(图3)。Bootstrap方法对列线图模型进行内部验证的结果显示模型的C-index指数为0.774,表明列线图模型在内部验证中的表现良好。

表1 术后严重并发症的影响因素的单因素分析Table1 Univariate analysis of influencing factors for severe postoperative complications
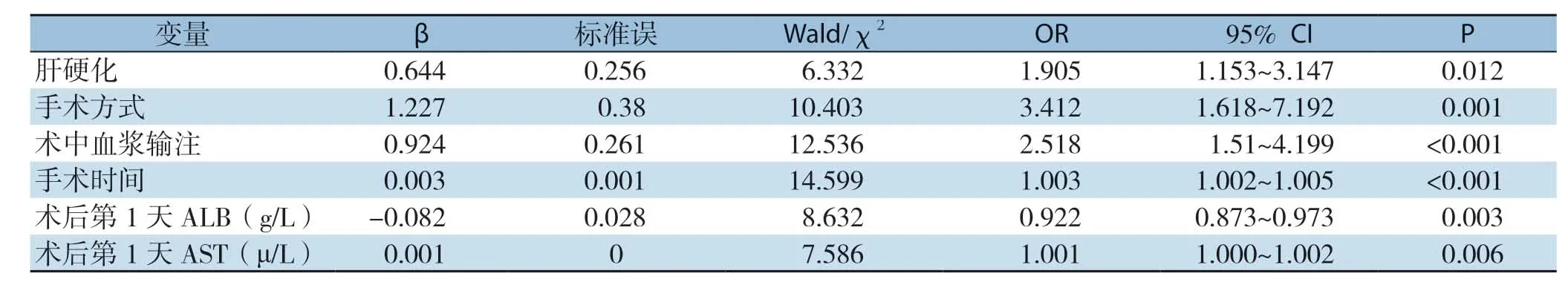
表2 多因素分析术后严重并发症的影响因素Table2 Multivariate analysis of influencing factors for postoperative severe complications

图1 肝癌手术患者术后严重并发症发生风险的列线图模型Figure1 Nomogram to predict severe postoperative complications after hepatectomy for HCC
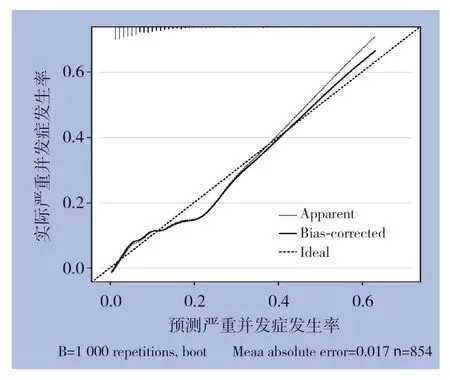
图2 校准图Figure2 The calibration plot

图3 列线图模型预测肝切除术后严重并发症发生风险的ROC曲线Figure3 ROC curve of nomogram to predict severe postoperative complications after hepatectomy for HCC
3 讨 论
本研究建立了肝切除术后严重并发症的个体化列线图风险预测模型,医务人员可通过该模型早期筛查术后严重并发症的发生的高危人群,并及时采取相应防治措施对患者进行提前干预,这有利于降低患者术后严重并发症的发生率,减轻患者的经济负担,降低医务人员的诊疗护理压力。研究结果显示肝切除术后严重并发症的发生率为10.1%,低于Hyder等[13](19%)和Wang等[14](30%)的研究,这可能是由于本研究中的肝切除术患者应用了加速康复外科治疗及护理理念,术前积极的评估、多学科合作诊疗、术中麻醉优化、术后早期进食、早期下床活动等加速康复外科措施的应用使得肝切除术后严重并发症发生率低于从前的传统治疗护理模式。本研究基于现有的医疗水平及加速康复外科理念,建立的风险预测模型,改变了以往只有在患者发生相关症状后才采取措施干预的理念,对患者进行早期筛查,与患者进行风险沟通并共同制定术后康复计划,有利于提高患者治疗及护理的依从性,促进患者快速康复。
目前已存在一些有关肝切除术后并发症风险预测模型的研究,Breitenstein等[2]建立了一个由ASA分级、AST、大肝癌切除,合并肝空肠造口术或结肠切除4个预测因子组成的风险评分系统,但其研究不能被其他学者重复[15];之后我国学者Wang等[14]建立了乙肝肝细胞癌肝切除术后并发症的风险评分系统,Ma等[8]也建立了肝脏恶性肿瘤术后严重并发症的风险评分系统,但上述有关肝切除术后并发症风险模型尚未纳入术中预测因子及术后预测因子,因此可能不适用于患者的术后管理。本研究所建立预测模型由肝硬化、手术方式、术中血浆输注、手术时间、术后ALB、术后AST 6个变量组成,包含术前、术中及术后预测因子,对肝细胞癌患者术后治疗、护理及康复计划的制定与实施具有较强的指导意义。
本研究结果表明,肝硬化是肝切除术后严重并发症的独立危险因素。既往一项研究表明,肝脏硬度越大,肝切除术后并发症的发生危险越大[16]。肝硬化会增加患者术后腹水、胸腔积液、术后感染、出血等并发症的风险[17],一方面肝硬化患者肝静脉回流受阻时,肝内淋巴液生成增多,超过胸导管引流能力,淋巴管内压力增高,使大量淋巴液自肝包膜和肝门淋巴管渗出至胸腔或腹腔,形成大量腹水和难治性胸腔积液;另一方面肝硬化患者抵抗力低下,免疫力下降等增加了病原体的入侵繁殖的机会,加上手术应激使其易于术后发生感染性并发症。此外,肝硬化患者行肝切除术后,有效残余肝体积进一步减少,这增加了患者术后出现肝功能衰竭、肝性脑病等严重并发症的风险。
肝脏是合成蛋白和凝血因子的重要器官,在我国大部分肝细胞癌患者有乙肝或肝硬化基础肝脏病,肝功能损害严重,导致其蛋白合成障碍、凝血功能紊乱,使得围术期输注血制品在肝切除术中较为常见[18],本研究结果表明术中输注血浆会增加肝切除术后并发症的发生风险,这与以往研究一致[19-20]。目前有关输血相关术后并发症的机制尚未阐明,可能与输血所导致的全身炎症反应和免疫抑制相关[21],相关机制还需进一步探讨。
随着微创手术设备及术者知识技术经验水平的提高,使得微创手术在肝脏疾病被广泛应用。本研究结果表明与开腹手术相比,微创肝切除术后并发症的发生率更低。这与既往研究一致[22-24]。相关研究表明腹腔镜肝切除术可在一定程度上降低肝细胞及T淋巴细胞的损伤,从而促进机体术后肝功能及免疫功能的恢复[25]。此外微创手术具有切口小、术区可视化更清晰的优点,在减少术中出血、术中输血从而减少术后严重并发症中具有重要意义。
本研究结果表明,手术时间是肝切除术后严重并发症的独立影响因素。这与Okamura等[5]研究结果一致,手术时间长意味着手术难度较大,患者长时间处于麻醉和插管状态,且随着手术时间延长术中液体输入量也随之增加,患者心脏负荷和肺部负担加重,导致患者容易术后心血管及肺部并发症[26],以往研究也证实了这一点[27-28]。此外,术后早期低ALB水平和高AST水平会增加术后严重并发症的发生风险。术后早期白蛋白和AST水平一方面反映了肝切除术对患者肝功能的影响程度,另一方面也反映了患者术后肝功能的恢复速度。术后低蛋白血症导致患者血浆胶体渗透压降低,机体营养状况受损,使得患者易发生手术切口感染、胸腔积液等并发症[19,29]。AST水平是反映肝功能的敏感指标,当肝细胞损伤严重时,AST从细胞内大量进入血液循环,并持续处于高水平状态,这在一定程度上增加了肝切除术后肝衰竭、出血、感染等严重并发症的风险[30]。
列线图可以将多因素分析结果可视化,较易于临床推广。通过建立的列线图模型,有利于医务工作者直观的分析患者行肝切除术后严重并发症的风险权重[31]。根据本研究的列线图模型,假设当某位患者患有肝硬化,行开腹肝切除术、术中有输注血浆、手术时间为600min,术后第1天ALB为30 g/L、AST为500U/L,则该患者总得分为177.5分,发生术后严重并发症的风险为62%。本研究所建立的列线图模型ROC曲线下面积为0.788,具有良好的区分度和校准度。
与以往有关肝切除术后严重并发症风险预测模型的研究相比,本研究纳入术前、术中及术后早期临床指标建立可视化、直观化列线图预测模型,模型中所需的临床资料获取方便、评估简捷,为肝细胞癌患者术后管理的优化、术后严重并发症的防治提供了参考依据。但本研究属于单中心研究,尚未对模型进行外部验证,今后应对模型进行时间和空间的外部验证,以提高模型的适用性。

