啤酒花颗粒中微生物的分离筛选及对啤酒风味的影响
潘振奇,付冬梅,苑晓倩,王越
(大连工业大学生物工程学院,辽宁 大连 116034)
啤酒花是啤酒酿造的重要原料,它赋予了啤酒爽口的苦味和特有的香味。啤酒花可以在酿造过程中的麦汁煮沸、回旋沉淀、发酵、贮酒等任何阶段添加。其中,在麦汁发酵和贮酒过程中添加酒花的方式,称为“干加酒花”(dry hopping)[1]。干加酒花是一种冷浸渍发酵工艺,酒花不经煮沸,以颗粒或全花形式在发酵过程或储藏期添加,可以达到增加啤酒香气的目的,这种工艺已成为啤酒行业研究的热点[2-4]。干加酒花工艺现在之所以能在啤酒生产中应用,是酿酒师认为啤酒花除了可以赋予啤酒酒花香气,还具有抑制啤酒中杂菌的生长、维护生物稳定性的作用。已有的研究表明酒花中的主要成分由α-酸由葎草酮、辅葎草酮和加葎草酮构成,能够抑制无酒花抗性的微生物存活,如短乳杆菌[5]。李宪臻等[6]认为酒花苦味酸能破坏细胞跨膜pH值梯度而抑制微生物生长。酒花苦味酸作为质子载体,通过破坏质子移动势的跨膜pH值梯度,使细胞内pH值降低而影响细胞营养转运和代谢过程,从而抑制对酒花敏感菌的生长[7-8]。尽管酒花已经被证实具有抑菌作用,但是由于酒花颗粒的加工和储存条件的差异,同时,干加酒花工艺在中国啤酒生产中的应用刚刚起步,相关的研究正在进行,因此该工艺对啤酒的生物稳定性会带来怎样的影响尚未可知。
从啤酒的生物稳定性来看,啤酒是保压兼性厌氧发酵,生成酒精和 CO2,表压 0.8 MPa~1.2 MPa,对微生物而言并不是理想的生存环境。但是,由于发酵设备和管路中不可避免会有灭菌的死角,长期积累,一些微生物如乳酸菌、野生酵母等仍能以啤酒残糖、氨基酸、发酵副产物和微量元素等作为生长因子而生存[9]。当污染微生物达到一定数量时,对发酵过程及酒体口味均会产生不良影响,会与酵母进行营养竞争,进而影响酵母的代谢,导致啤酒发酵异常,对啤酒的稳定性和风味会产生一定的影响[10-11]。徐岩等[12]对啤酒酿造过程中的腐败菌进行了研究,发现污染细菌后发酵过程中的pH值下降迅速,异戊醇、异丁醇和总酸偏高。田小群等[13]从啤酒厂分离出31株啤酒腐败菌,对其进行了生理生化检验和16S rDNA测序,结果表明31株菌分属 5个种 Lactobacillus brevis、Lactobacillus plantarum、Lactobacillus paracasei、Lactobacillus conostoc、Lactobacillus citreum,其中部分腐败菌对啤酒的风味影响较大,导致啤酒醇、酯类和总酸提高。
本研究从干加酒花啤酒工艺的常用的酒花颗粒中分离微生物,并进行生理生化和分子鉴定,研究了啤酒花颗粒中的微生物对啤酒风味的影响,为干加酒花工艺制备的啤酒研究和生产提供理论依据。
1 材料与方法
1.1 材料与试剂
啤酒花颗粒:上海金啤有限公司(均为铝箔纸袋5℃密封条件下保存);酵母:Saccharomyces cerevisiae,由大连工业大学生物催化技术国家与地方联合实验室保存。
正丙醇(>99.8%)、乙酸乙酯(>99.9%)、乙酸异戊酯(>99.5%)、乙酸异丁酯(>99.5%)、异丁醇(>99.5%)、异戊醇(>99.8%)、辛酸乙酯(>99.8%)、色胺(>99%)、腐胺(>98%)、酪胺(>98%)、亚精胺(>97%)、精胺(>97%):中国医药(集团)上海医药有限公司。
细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒、DL3000 DNA Marker、TransTaq-T DNAPolymerase(250U)、10×TransTaq-TBuffer、2.5mmol/L脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTPs)、6×DNA Loading Buffer:美国 Trans Taq公司。
1.2 培养基
麦汁培养基:8°P麦汁;史娃兹鉴别培养基(schwartz differential medium,SDM):动物组织消化物 5.0 g/L、酵母浸粉3.0 g/L、麦芽浸粉3.0 g/L、葡萄糖10.0 g/L、糊精0.11 g/L、亚硫酸钠 2.92 g/L、碱性品红0.47 g/L、琼脂15.0g/L;麦汁碳酸钙固体培养基:8°P麦汁、琼脂20g/L、碳酸钙20 g/L;营养琼脂培养基:蛋白胨10 g/L、牛肉膏3 g/L、氯化钠 5 g/L、琼脂 15 g/L~20 g/L;NBB 培养基:上海子起生物科技有限公司。
1.3 仪器与设备
H1750R离心机:湘仪离心机仪器有限公司;PM1000高效液相色谱:日立高新技术(上海)国际贸易有限公司;7890B气相色谱仪:美国Agilent(安捷伦)科技公司;100 L啤酒生产设备:哈尔滨汉德轻工医药装备有限责任公司;T1000聚合酶链式反应(polymerase chain reaction,PCR)仪:美国 Bio-Rad 公司。
1.4 方法
1.4.1 酒花微生物的筛选
取常用的干加酒花颗粒(均为铝箔纸袋5℃密封条件保存),按5%比例加入麦汁培养基中,30℃摇床富集培养48 h,自然沉降后收集上清菌液,用无菌生理盐水按梯度稀释至10-1~10-5,分别涂布于营养琼脂培养基、SDM培养基和麦汁碳酸钙固体培养基中,按照菌落形态和镜检结果,采用平板划线法进一步分离。
复筛:将分离得到的菌株接种于NBB固体培养基中25℃厌氧培养3 d~5 d,挑取生长菌落,斜面营养琼脂培养基保存。
1.4.2 酒花微生物的计数
取10 g酒花颗粒加入100 mL无菌水中,28℃振荡1 h,自然沉降后收集上清菌体原液,用无菌生理盐水按梯度稀释至10-1~10-5,采用固体培养基菌落计数法,微生物数量约为600 cfu/g酒花。
1.4.3 酒花微生物的鉴定
形态观察及生理生化鉴定:参考《常见细菌系统鉴定手册》[14]对分离的微生物进行形态观察和生理生化鉴定。
分子生物学鉴定:采用细菌基因组DNA提取试剂盒提取筛选菌株的基因组DNA,以其为模板对菌株的16S rDNA进行PCR扩增。PCR扩增引物16S rDNA通用引物为[15]:1492R、27F;PCR 扩增体系 30 μL:10×buffer3μL,10×TransTaq-T 0.2μL,引物P1和P2各3 μL,DNA 模板 1 μL,dNTPs 2 μL,ddH2O 17.8 μL。PCR 扩增程序:预变性10min,94℃变性30s,55℃退火30s,72 ℃延伸1 min,29个循环;72℃再延伸10 min,4℃保存。PCR扩增产物经1%琼脂糖凝胶电泳检测,确认PCR扩增片段。将PCR扩增产物送至北京六合华大基因科技有限公司武汉分公司进行测序。
将测序结果提交至美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)的Genbank数据库中进行基本局部比对搜索工具(basic local alignment searchtool,BLAST)比对,选取同源性较高的模式菌株的16S rDNA序列,采用MEGA-X 10.1软件中的邻接(neighbor joining,NJ)法构建系统发育树。
1.4.4 干加酒花啤酒发酵
将麦汁煮沸1 h,冷却到18℃。取3 L麦汁于杀菌过的5 L发酵罐中,加入啤酒酵母5×106个/mL,安装发酵栓,在发酵栓内注入5mL2.61mol/L硫酸溶液封口。由于Saccharomyces cerevisiae酿造啤酒通常在18℃~20℃下发酵[16],因此,本试验采用20℃恒温培养箱发酵,取分离纯化的微生物接种于麦汁中,培养24 h后,按照酒花颗粒中菌落数,在入罐24 h的啤酒发酵液中添加1.8×105个/hL的酒花微生物菌落(按干加酒花量为300 g/hL折算),以未加微生物的啤酒发酵液作空白,以干加300 g/hL酒花为比较对象。考虑到酒花微生物对啤酒发酵结束后风味和品质的影响,待发酵液比重降到1.007 0以下,发酵结束,检测发酵液总酸、风味物质和生物胺。
1.4.5 啤酒总酸测定
参照 GB/T 4928—2008《啤酒分析方法》[17]。
1.4.6 啤酒低挥发性风味物质的检测
样品测定[18]:取5 mL过滤后的待测液加入顶空进样瓶中,加内标物(正丁醇)1 μL。立即加密封垫和铝盖并压紧,将样品置于顶空进样器上,利用保留时间定性,峰面积定量的内标法进行各风味物质含量的计算。气相色谱条件:安捷伦7890B毛细管柱,HP-5色谱柱(30m×0.32mm×0.5μm),进样口温度200℃,检测器温度230℃,氢气 45 mL/min,空气 450 mL/min;载气(氮气)8 mL/min;采用分流进样,分流比1∶1;色谱柱升温程序:38℃保温2 min,10℃/min升温至60℃保温 0 min,20℃/min升温至 120℃,40℃/min升温至200℃保温0 min。顶空进样条件:样品瓶加热温度55℃;进样针温度65℃;传输温度120℃;加热时间36 min。循环时间20 min;进样时间0.2 min;抽样时间0 min;载气压力 19 Pa。
1.4.7 啤酒生物胺液相检测
样品处理[19]:将样品于4℃,10 000 r/min条件离心10 min,取上清液10 mL于烧杯中,加氯化钠过饱和溶液,再添加0.1 mol/L氢氧化钠调至pH12,取5 mL样品于15 mL离心管,加入5 mL正丁醇/三氯甲烷(1∶1,体积比)混合,振荡5 min,4℃3 600 r/min离心10 min,重复上述两次,合并萃取液。加入0.1 mL 1 mol/L盐酸,氮吹仪水浴(40℃)吹干,加入1 mL 0.1 mol/L盐酸溶解后,溶液进行衍生。生物胺衍生测定方法:取上述处理后溶液0.5 mL于10 mL试管,加入1 mL丹磺酰氯和1.5 mL饱和碳酸氢钠,60℃烘箱静置15 min,取出后加入1 mL纯水摇匀。氮吹仪水浴(40℃)吹至3 mL,加入3 mL乙醚,振荡2 min。吸取萃取液于15 mL离心管中,重复上述步骤,合并萃取液,氮吹仪水浴(40℃)吹干,最后用1 mL甲醇溶解残留物,待用。液相色谱条件:色谱柱为 C18柱(250 mm×4.6 mm×5 μm);紫外检测波长为254 nm;流动相A为甲醇溶液,B为超纯水,流速为1 mL/min;进样量为10 μL;柱温为30℃。
1.4.8 数据处理
利用Excel与SPSS18.0软件对数据进行分析处理,使用MEGA-X 10.1软件构建系统发育树。
2 结果与分析
2.1 酒花微生物的分离与鉴定
从酒花颗粒中按照方法“1.4.1”经初筛未检出霉菌、乳酸菌和酵母,只在营养琼脂培养基上有细菌菌落,具体见图1。复筛经NBB厌氧培养共获得3株菌分别编号为Y1、Y2、Y4,其生理生化试验结果见表1。
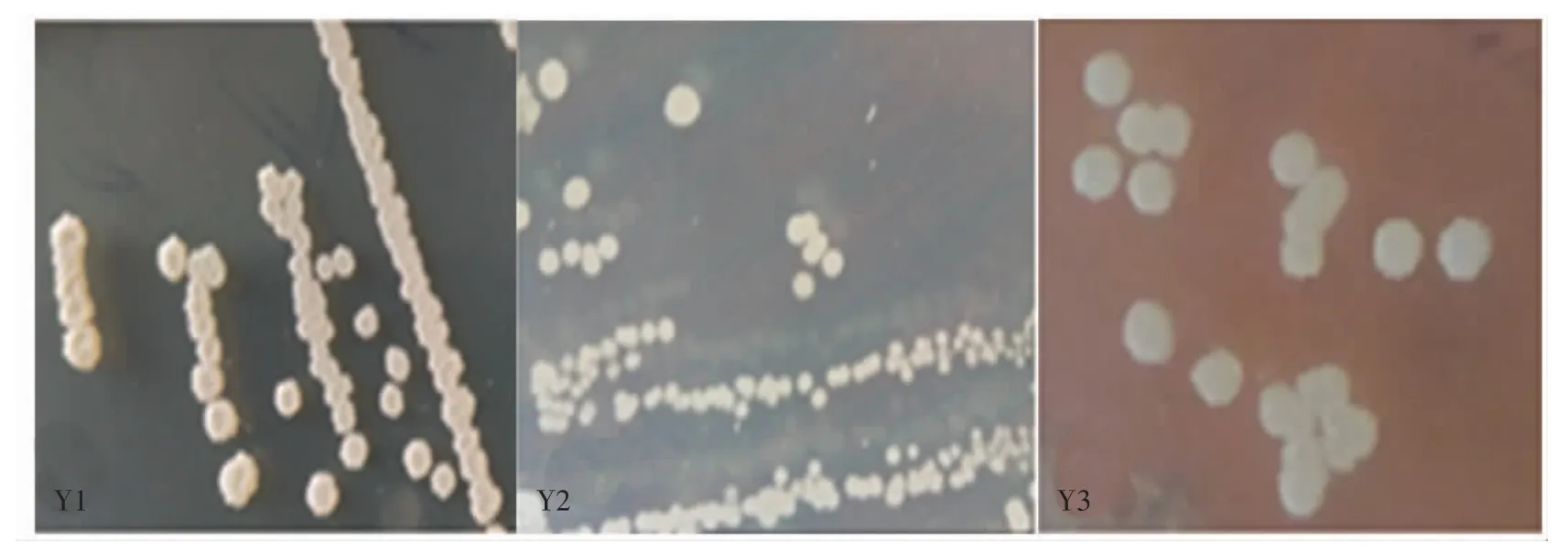
图1 3株细菌的菌落形态Fig.1 Colony morphology of 3 strains of bacteria

表1 3株细菌生理生化鉴定结果Table 1 Morphological and physiological and biochemical results of 3 strains of bacteria
由图1可知,Y1的菌落呈白色,表面褶皱且边缘不规则,菌落中央凹陷;Y2菌落呈浅黄色,表面及边缘光滑;Y4菌落呈乳白色,边缘褶皱不规则且较薄。由表1可知,3株菌都能利用葡萄糖和蔗糖,Y1和Y4菌不能利用半乳糖和蜜二糖,3株菌革兰氏染色为阳性,都具有过氧化氢酶活性,能耐受10%的盐度,能在10℃~45℃范围内生长,该生理生化特征与Bacillus和Terribacillus相似,初步判断为芽孢杆菌[20-22]。
基于16SrDNA序列构建的菌株系统发育树见图2。
由图2可知,菌株Y1与Bacillus velezensis strain ND聚于一支,Y2与Terribacillus saccharophilus strain MER 108聚于一支,Y4与Bacillus sp.C87聚于一支,亲缘关系最近。由NCBI Blast同源性分析,Y1菌与Bacillus velezensis strain ND同源性达100%,Y2菌与Terribacillus saccharophilus strain MER 108的同源性达99%,Y4与Bacillus sp.C87同源性达99.93%。根据生理生化测定结果和16S rDNA系统发育分析及序列同源性比对,可将3个菌株鉴定为:Y1为贝莱斯芽孢杆菌(Bacillus velezensis),Y2为嗜糖土地芽孢杆菌(Terribacillus saccharophilus),Y4 为芽孢杆菌(Bacillus sp.)。
2.2 酒花微生物对啤酒发酵风味的影响
2.1试验表明啤酒花颗粒中存在着Bacillus和Terribacillus。当啤酒采用干加酒花工艺酿造时,这些细菌会随着酒花颗粒进入到发酵液中,降低啤酒的生物稳定性。有研究表明[23-24],啤酒腐败菌乳酸杆菌代谢产物如乳酸、乙酸等有机酸会改变啤酒的风味,并引起啤酒酪胺、组胺等生物胺的提高,导致啤酒腐败。一些芽孢杆菌如地衣芽胞杆菌、蜡样芽孢杆菌、迟缓芽孢杆菌和甲基营养型与酿酒酵母混合培养后会提高酿酒酵母代谢高级醇类和酯类化合物的能力[12]。因此,为研究干加酒花工艺时啤酒花颗粒中细菌对啤酒风味的影响,分别将从酒花颗粒中筛选到的Y1、Y2和Y4接种到啤酒发酵液,检测总酸、低沸点挥发性物质和生物胺的变化。
2.2.1 对啤酒总酸的影响
在入罐24 h的啤酒发酵液中分别添加Y1、Y2、Y4菌和酒花,按照方法“1.4.4”中的量添加,以未加细菌的啤酒发酵液作空白,在20℃发酵结束后,测定啤酒的总酸,结果见图3。

图2 基于16S rDNA序列构建的菌株系统发育树Fig.2 16S rDNA sequence based phylogenetic tree of the strains

图3 干加酒花对啤酒总酸的影响Fig.3 Effect of dry hopping on total acid of beer
由图3可以看出,与空白比较,干加酒花后,啤酒的总酸增加了12%。有文献报道[25],啤酒中酸类物质主要来源于麦芽中的酸和发酵产酸。干加酒花促进了啤酒总酸的提高,分析其原因,尽管酒花树脂含有α-酸和β-酸,但是溶解度很低,约为4.70×10-5mL/100 mL~27.6×10-5mL/100 mL[26]。因此总酸度提高可能和酒花中的微生物代谢有关。进而考察了Y1、Y2和Y4菌对啤酒的总酸影响。从图3看出,3株菌都提高了啤酒总酸,其中Y2菌产酸量最高,达到了2.2 mL/100 mL,比空白提高了32%,但都符合国标GB/T 4928—2008中啤酒总酸小于2.6 mL/100 mL的要求。研究报道蜡样芽胞杆菌具有耐酸性,其代谢可以产生乳酸、乙酸、丁酸等有机酸[27-28]。因此,干加酒花使啤酒总酸增加可能是由酒花中细菌代谢产酸引起的,且不同微生物对总酸的影响差异较大。
2.2.2 酒花中细菌对啤酒风味物质的影响
为研究酒花及酒花中细菌对啤酒风味物质的影响,按照方法“1.4.4”在啤酒发酵液中分别添加Y1、Y2和Y4菌,发酵结束后,利用方法“1.4.6”检测高级醇和酯类物质含量,试验结果见表2。
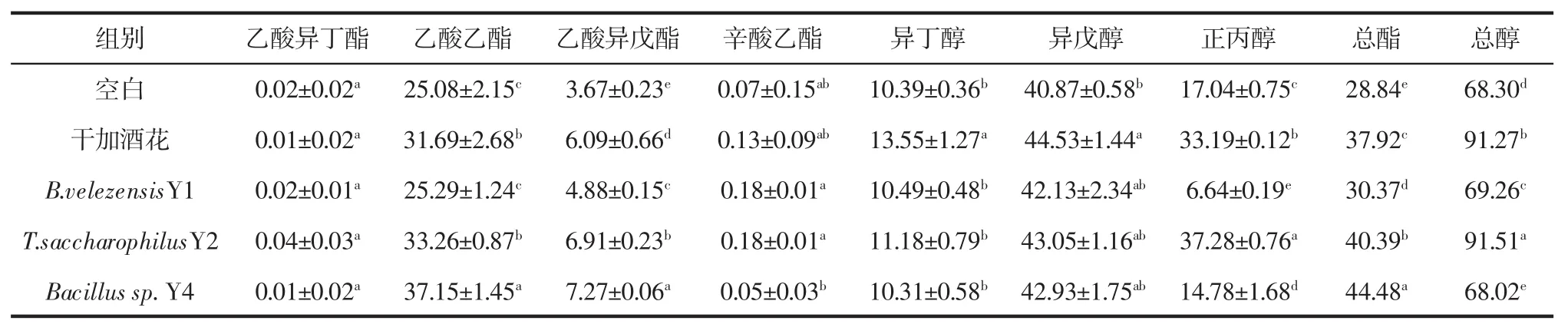
表2 啤酒风味物质的含量Table 2 Content of flavor substances in beer mg/L
由表2看出,和空白比较,干加酒花的啤酒总醇含量增加了33.63%。作为重要的高级醇风味物质,尤其是正丙醇的增加有助于提高啤酒香味,使啤酒香气更加柔和[29-30]。添加酒花中B.velezensisY1和T.saccharophilusY2菌,啤酒总醇都有所增加,其中投放T.saccharophilusY2菌的啤酒总醇增加了33.23%,结果说明干加酒花啤酒总醇的增加与酒花中的细菌参与代谢有关。
酯类化合物也是影响啤酒风味的重要组成成分之一。主要酯类风味乙酸异戊酯的风味阈值在2.6 mg/L~6 mg/L之间,会使啤酒呈现出独特的“香蕉”香味,超出阈值则会产生一种使人不愉快的气味。乙酸乙酯的风味阈值在26 mg/L~45 mg/L之间会给啤酒带来水果的果香味,超出阈值会产生不协调的、刺鼻的溶剂气味[31-32]。试验结果表明干加酒花的啤酒乙酸异戊酯和乙酸乙酯均在风味阈值内,并且干加酒花的啤酒总酯增加了31.48%,投放3种细菌啤酒总酯含量均增加,其中Bacillus sp.Y4使啤酒总酯含量增加54.23%。综上所述,酒花中的Bacillus和Terribacillus会促进啤酒总酯的增加,对总醇的影响因菌种而异。
2.2.3 啤酒中生物胺的测定
为了考察酒花中细菌对啤酒生物胺的影响,按照方法“1.4.4”在啤酒发酵液中分别添加细菌和酒花。按照方法“1.4.7”检测发酵液生物胺含量,结果见表3。
由表3看出,和空白比较,干加300 g/hL酒花对啤酒的总生物胺影响明显,增加了31.11%。PavelKala等[33]在用啤酒乳酸菌混合培养物接种的啤酒中发现酪胺、组胺和尸胺含量的增加。表明啤酒中的生物胺含量提高与杂菌代谢有关。因而考察了酒花中的细菌对生物胺的影响。从结果看,B.velezensisY1、T.saccharophilus Y2和Bacillus sp.Y4和酵母混合发酵都增加了生物胺,分别增加了190.94%、15.88%和32.47%。其中酒花中的B.velezensisY1菌按1.8×105个/hL(按干加酒花量为300 g/hL中所含微生物折算)接入发酵液时,产生的生物胺达到了27.96 mg/L,超过了啤酒中生物胺的一般限量20 mg/L[34]。试验表明干加酒花提高了啤酒的生物胺含量,这是由酒花中的Bacillus和Terribacillus的代谢引起的,不同菌种影响也不尽相同,干加酒花工艺对啤酒生物稳定性和品质会带来潜在的风险。
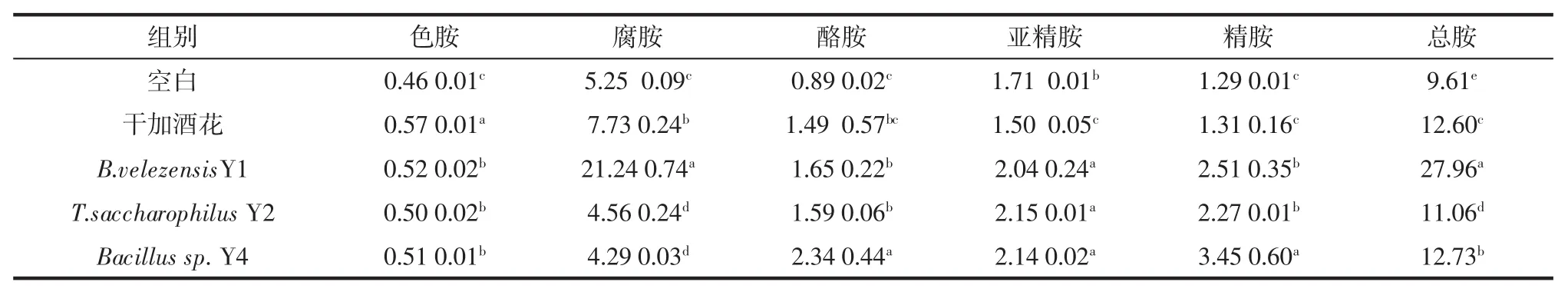
表3 啤酒生物胺的含量Table 3 Content of biogenic amines in beer mg/L
3 结论
干加酒花啤酒作为一种近年来受大众欢迎的饮品,因其突出的口味和饱满的香气而受到市场的青睐。但是在干加酒花过程中,存在被微生物污染的可能,这些微生物通过自身产生或者间接作用于酿酒酵母从而影响啤酒的风味。本文从啤酒花颗粒中分离筛选出3株细菌,经生理生化和分子鉴定属于Bacillus和Terribacillus属。干加酒花能改变啤酒的总酸、总醇、总酯及生物胺含量。将啤酒花颗粒中筛选到的Y1、Y2和Y4投放于啤酒中,发现干加酒花对啤酒风味和生物胺的影响主要是由酒花颗粒中细菌的代谢引起的,从而会引起啤酒风味的改变,表明酒花颗粒如果不经过杀菌处理,干加酒花工艺对啤酒生物稳定性和品质会带来潜在的风险。

