中药材桔梗及其易混品的DNA条形码分子鉴定
赵新悦,刘蕊,冯红,毛雯雯,曹飞,张兰兰
(1.河北大学 药学院,河北 保定 071002;2.数字本草检测科技有限公司,河北 保定 071002)
中药桔梗[1]为桔梗科植物桔梗Platycodongrandiflorum的干燥根,具有宣肺、祛痰、利咽、排脓之功效.研究表明,桔梗中主要活性成分桔梗皂苷D可明显降低白色念珠菌对口腔黏膜的感染.皂苷D、D3和远志皂苷 D可抑制人癌细胞株的增殖[2],桔梗多糖对宫颈癌实体瘤小鼠肿瘤生长有显著的抑制作用[3].此外,桔梗还具有降血糖、抗氧化的功效[4].丰富的药理作用,使得桔梗药材被广泛应用.然而,桔梗市场一直存在真伪混杂现象.因外形相似不易区分,有些不良商家以南沙参(Adenophoratetraphylla)、霞草(Gypsophilaoldhamiana)掺入或冒充桔梗售卖[5],但南沙参清热养阴,霞草活血散淤,作为桔梗应用于临床时不能宣肺利咽,很大程度上延误患者病情,如若将霞草误认为桔梗使用时,可能引起患者出血增多,为临床增加了不必要的风险.目前,徐优芬[6]、王千枝[7]、万秋娥[8]等采用植物形态、药材性状、显微鉴别、激光拉曼光谱等方法对桔梗及其易混品进行鉴别,其方法本身对技术人员的专业技术能力要求较高,其结果重复性差、工作量大.
目前,DNA条形码技术已成为中药材鉴定的重要方法[9].2010年中国学者提出将ITS2(internal transcribed spacer 2)作为药用植物标准DNA条形码[10],且已成功应用于豆科等多个科属药用植物及药材鉴定[11-13].已有研究表明[14],基于ITS基因序列的桔梗及其伪品的基源植物构建邻接法(NJ) 聚类树,桔梗样品可聚成一个单系,但对其位点特异性PCR鉴定未见相关报道.
本文以桔梗、南沙参、霞草为研究对象,优化DNA提取方法和设计桔梗特异性引物,对桔梗进行特异性PCR鉴定.本方法操作简单,快速,无需测序,可特异性鉴别桔梗及其易混品,为桔梗药材的基原鉴定提供科学依据,并进一步完善桔梗药材质量控制系统.
1 仪器和材料
1.1 仪器
LDZM-20KCS Ⅲ立式压力灭菌锅(上海申安);Scientz-48高通量组织研磨器(宁波新芝生物);Legend Micro 17离心机(Thermo Fisher Scienific);Epoch酶标仪(伯腾);ABI profile梯度PCR仪(Life Technologies);DYCP31DN电泳仪(北京六一生物);JS-680D凝胶图像分析系统(上海培育科技).
1.2 材料
本实验所用样品均购自药材市场,收集后放置于硅胶中常温干燥保存,备用;样品共计17批,均经本公司鉴定人员鉴定,样品信息详见表1.
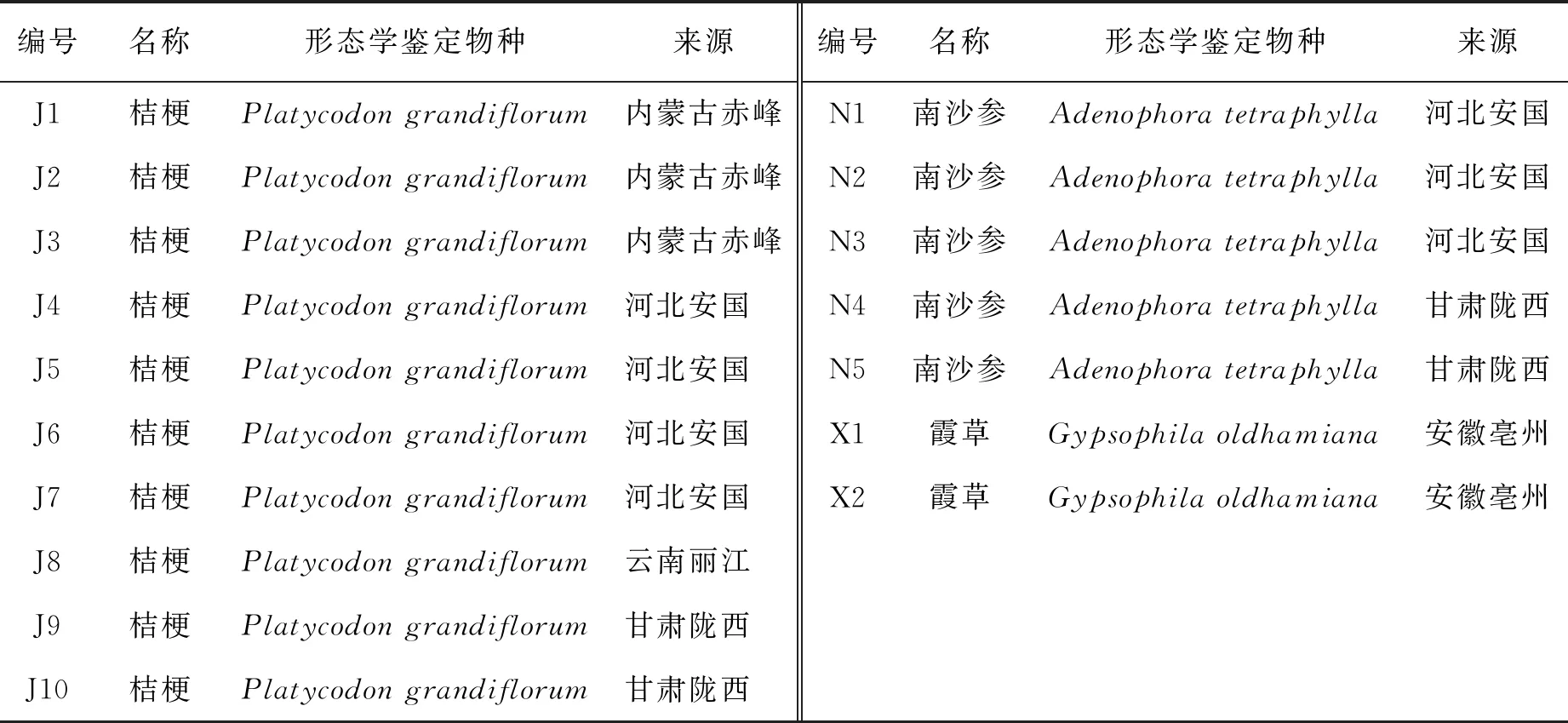
表1 实验所需植物材料
2 实验方法
2.1 基因组DNA的提取
随机选择桔梗、南沙参、霞草样品各2批,采用体积分数为75%的乙醇对样品表面擦拭消毒并置于洁净处挥干,使用高通量组织研磨仪研磨,称取样品粉末30 mg于2 mL离心管中,采用植物基因组DNA提取试剂盒法、改良CTAB(cetyltrimethylammonium bromide)法、SDS(sodium dodecyl sulfate)法3种DNA提取方法进行实验(表2).并以通用引物ITS 2F/3R进行PCR扩增[15],以DNA浓度、纯度与PCR扩增成功率为评判指标,选择最适合桔梗及其易混品药材DNA提取的方法.

表2 基因组DNA提取方法比较
2.2 序列分析
将测序获得和NCBI网站下载的桔梗、南沙参、霞草的ITS基因序列(登录信息见表3)用MEGA 7.0软件进行序列查看,用Clustal W进行多序列比对,删除前后两端多余的序列,并计算种间和种内的遗传距离.基于Kimura-2-parameter双参数模型用NJ将比对过的序列构建系统发育树,用自举检验法(bootstrap 1 000次)检验各分支的支持率.
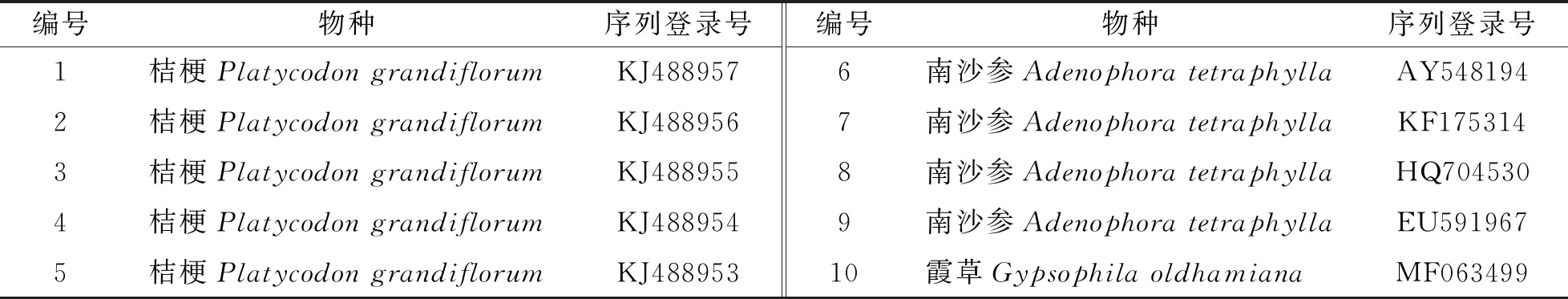
表3 NCBI下载的各基因序列信息
2.3 特异性引物设计
通过MEGA7.0分析比较桔梗及其易混品的ITS序列差异,查找桔梗的特异性位点.基于特异性位点设计桔梗特异性引物,并送至北京美吉桑格生物有限公司进行合成.利用该引物对各药材DNA进行特异性PCR扩增,以验证引物的可用性.
2.4 桔梗位点特异性PCR方法建立
基于本研究提取的桔梗及其易混品的基因组DNA和设计的桔梗特异性引物U1/D1,建立桔梗位点特异性PCR方法,并对其进行PCR条件优化.
本研究分别考察了引物U1/D1的退火温度、循环次数、DNA模板浓度以及引物浓度等因素对PCR反应效率的影响,筛选最适PCR扩增条件.各因素具体参数设计如下:
退火温度考察分别设置为56、58、60、62 ℃;循环次数考察分别设置为33、35、37、39个循环;DNA模板考察分别设置为50、100、200、400 ng;最适引物浓度考察分别设置为0.5、1.0、2.5、5.0 μmol/L.
最后,为了进一步检验桔梗位点特异性,将所有样品基因组DNA进行扩增,同时设置未加模板DNA的PCR反应为空白对照.
3 结果与分析
3.1 基因组DNA的提取
DNA纯度常以A260/A280来表示,1.8~2.0表示所提取的DNA纯度较好,小于1.8说明有蛋白质污染,大于2.0说明有RNA残留.从表4可知,3种方法提取的DNA均有污染,试剂盒法提取基因组DNA平均纯度为0.76,所提DNA中含有较多蛋白质,改良CTAB法为2.13,SDS法为2.20,有少量RNA残留.而选取相同样品量时,改良CTAB法和SDS法所提DNA质量浓度均在120 ng/μL以上,而试剂盒法提取DNA质量浓度只有20 ng/μL.就提取DNA的纯度和质量浓度而言,改良CTAB法≈SDS法>试剂盒法.
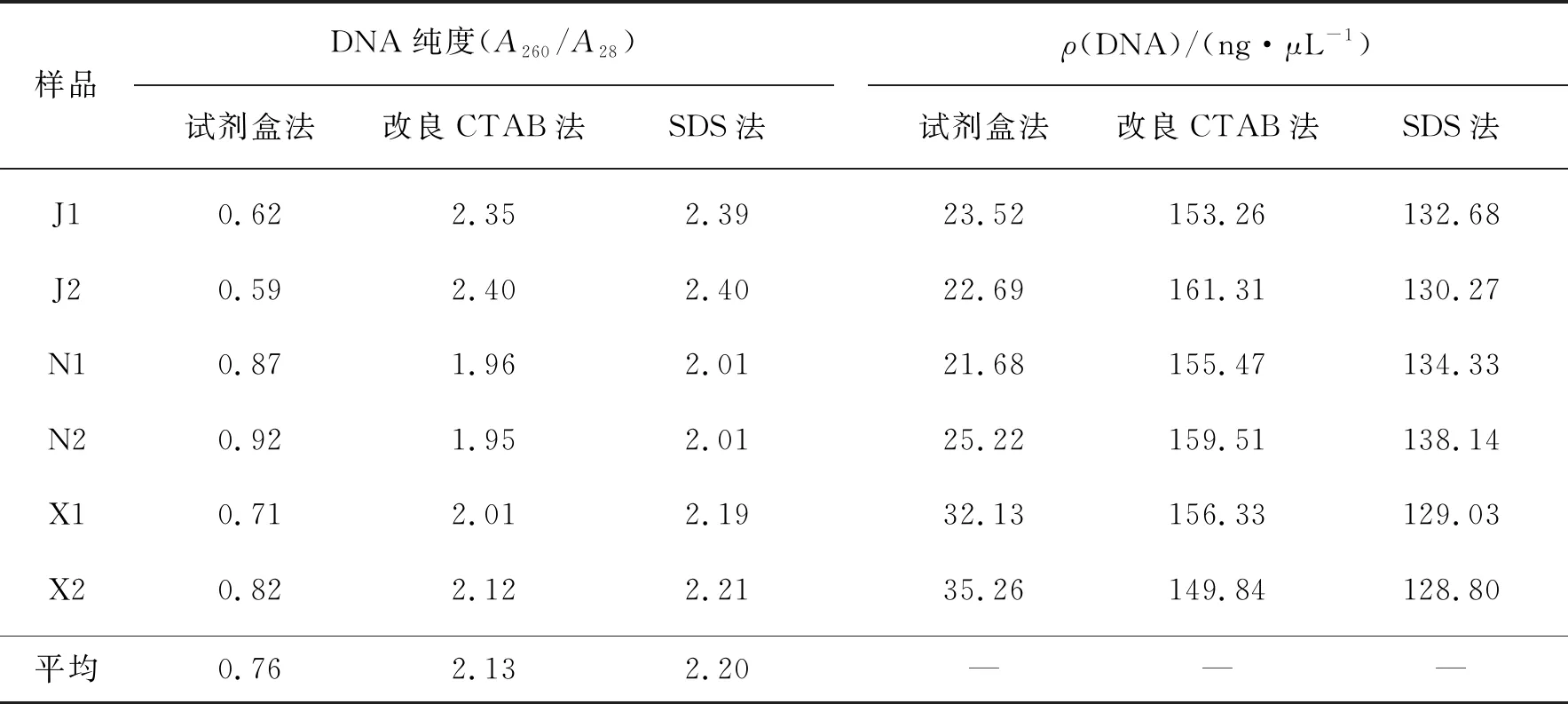
表4 3种方法所提取的DNA质量汇总
PCR扩增成功率见图1,试剂盒法和改良CTAB法显示条带6条,成功率为100%,但试剂盒法显示条带弥散,SDS法显示条带4条,成功率为66.7%.就扩增成功率而言,改良CTAB法>试剂盒法>SDS法.
综上对3种常用基因组DNA提取方法的比较可知,改良CTAB法提取的桔梗及其易混品的DNA含有少量RNA,质量浓度在150 ng/μL,且PCR扩增成功率为100%,最适于桔梗及其易混品的DNA提取.
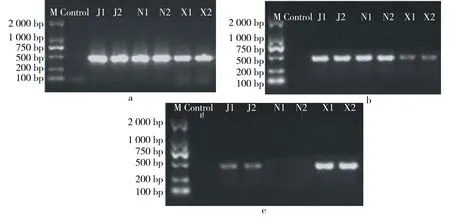
M.Marker; J.桔梗;N.南沙参;X.霞草.图1 试剂盒法(a)、改良CTAB法 (b)、SDS法(c)提取DNAFig.1 DNA extraction by kit method (a)、modified CTAB method (b)、SDS method (c)
3.2 聚类分析和遗传距离计算
将28条ITS序列构建NJ系统发育树,见图2.

图2 基于ITS序列的桔梗及易混品的NJ系统发育树(bootstrap 1 000 次重复)Fig.2 NJ of Platycodon grandiflorum and miscible based on ITS sequence (bootstrap 1 000 replicates)
从图2可以看出:3种植物的ITS序列分别聚为一支,不同来源的桔梗样品聚为一个单系,支持率高达99.但测序所得序列与下载序列未单独聚在一起,而是分别聚为一个分支.易混品南沙参与霞草均各自聚为一个单系,支持率分别为97和93,其中霞草为石竹科植物,与另外两者亲缘关系最远,南沙参与桔梗的亲缘关系较近.
将处理好的ITS序列导入MEGA 7.0软件,基于Kimura-2-parameter模式计算种内种间遗传距离:所有样品之间的平均遗传距离为0.378,桔梗种内遗传距离为0.004,南沙参种内遗传距离为0.016,霞草种内遗传距离为0.007,桔梗与易混品南沙参之间的遗传距离为0.264,与霞草间的遗传距离为0.893.种内最大遗传距离均小于种间最小遗传距离,该结果与赵月梅等[14]研究结果一致,由此可见,基于ITS基因序列的DNA条形码技术能够有效地鉴定桔梗及其易混品.
3.3 特异性引物设计与鉴别
比对桔梗及其易混品霞草、南沙参的ITS序列,查找在293位依次为G、C、A,在538位为G、T、T,见图3.采用Primer Primier 5.0 软件设计桔梗特异性引物U1/D1(U1:5' GCTGTGACCGCTCCTCG 3';D1:5' CCTGTATCCGCTCCACCTG 3'),并送至北京美吉桑格生物有限公司进行引物合成.使用此引物对上节所得DNA模板进行扩增,结果见图4,发现仅桔梗可以特异性扩增出264 bp大小的条带.

图3 293位(a)和538位(b)序列比对Fig.3 293 position(a) and 538 position(b) sequence alignment
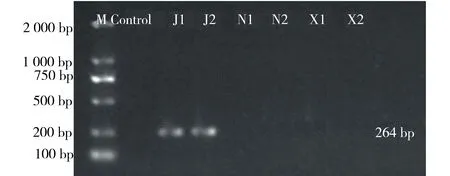
M.Marker; J.桔梗;N.南沙参;X.霞草.图4 桔梗特异性引物鉴别结果Fig.4 Platycodon grandiflorum specific primer identification results
3.4 桔梗位点特异性PCR方法建立
通过琼脂糖凝胶电泳显示条带的清晰明亮程度作为PCR扩增效率的评判指标,见图5.退火温度在56 ℃条件下桔梗扩增条带较为清晰;37~39个循环的扩增条带均清晰明亮,且程度相当;DNA模板在50~400 ng,随着DNA浓度增加,扩增条带由暗到亮到暗的过程,100 ng条件下桔梗扩增条带最为清晰且明亮;最适引物浓度考察时,引物在5.0 μmol/L条件下,桔梗扩增条带最为清晰,且无非特异性扩增;PCR特异性考察时,仅10批桔梗可扩增出特异性单一条带,其他样品均未扩增出特异性条带,从而验证此方法可以特异性地鉴别桔梗药材.优化后的反应体系为:2×Taq PCR Mix需12.50 μL,正反向引物(5.0 μmol/L)各1.00 μL,模板(基因组DNA约0.1 μg/μL)需2.00 μL,ddH2O补至25.00 μL.PCR反应条件:94 ℃预变性5 min后,94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸45 s,37个循环后,72 ℃延伸10 min.

M.Marker;J.桔梗;N.南沙参;X.霞草.图5 退火温度 (a)、循环次数 (b)、 DNA模板量 (c)和引物浓度优化 (d)及特异性验证结果 (e)Fig.5 Annealing temperature (a),cycling number (b),amount of DNA (c)and optimize primer concentration (d),specificity verification results (e)
4 讨论
桔梗是中国常见的中药材之一,分布于东北、华北、华东、华中各省以及两广、云南、四川等地.朝鲜、日本、苏联的远东和东西伯利亚地区的南部也有分布,范围较广.由于地理环境的差异,导致桔梗药材外观无法统一,质量也参差不齐,不仅使传统鉴别增加了难度,更是增加了易混品相互混淆的几率.目前市场上因外形无法区分的桔梗易混品主要是南沙参和霞草2个品种[16].三者在药效和药性上具有一定差异,药材的混用将直接影响到桔梗临床用药的安全和疗效.因此,对桔梗及其易混品进行深入的鉴定研究,对规范桔梗药材市场以及临床用药有重要意义.
植物DNA提取一般先后经历细胞壁和细胞膜裂解、蛋白质分离变性、核酸沉淀及DNA浓缩等多个步骤.桔梗药材在加工、贮藏过程中会造成DNA不同程度的降解,且自身含有的大量多糖,会与DNA结合形成黏稠的胶状物,使DNA难以溶解.本文通过比对3种提取方法,以DNA纯度、浓度和扩增成功率作为评价指标,得出改良CTAB法更适于桔梗及易混品的DNA提取,原因为CTAB是一种去污剂,可与核酸形成复合物,当降低溶液盐浓度到一定程度(<0.3 mol/L NaCl)时,复合物从溶液中沉淀,通过离心就可将CTAB与核酸的复合物同蛋白质、多糖类物质分开[17],可以有效防止桔梗多糖对DNA提取过程的干扰.基于ITS基因序列的DNA条形码技术能够有效地鉴定桔梗及其易混品,在此基础上,分析挖掘稳定的特异性位点,设计桔梗特异性鉴别引物,并对特异性PCR扩增条件进行优化,实现快速准确地鉴别桔梗及其易混品.
本文设计的桔梗特异性引物具有专属性强,重复性好,建立的方法操作简单,特异性强,耗时较短,无需测序,降低检测成本,只需通过琼脂糖凝胶电泳条带即可将正品桔梗与其易混品区分.本文建立了快速区分桔梗及其混伪品的分子鉴定方法,为桔梗DNA条形码技术研究进行补充与完善,并有望得到广泛的推广应用.
——辨别味之苦甜

